高一元素化合物方程式书写
- 格式:docx
- 大小:32.88 KB
- 文档页数:4

元素化合物化学⽅程式-⾼中化学必修⼀元素及其化合物的化学⽅程式有※的,还要写离⼦⽅程式!⼀、钠及钠的重要化合物1、常温钠与氧⽓反应4Na+O2=2Na2O2、加热条件下钠与氧⽓反应2Na+O2△Na2O23、※钠与⽔反应2Na+2H2O=2NaOH+H2↑2Na+2H2O=2Na++2OH-+H2↑4、※过氧化钠与⽔反应2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O=4Na++4OH-+O2↑5、过氧化钠与⼆氧化碳反应(呼吸⾯具,供氧剂)2Na2O2+2CO2=2Na2CO3+O2↑6、※氢氧化钠溶液中通少量⼆氧化碳2NaOH+CO2=Na2CO3+H2O2OH-+CO2=CO32-+H2O7、※氢氧化钠溶液中通过量⼆氧化碳NaOH+CO2 =NaHCO3 (OH-+CO2 =HCO3-) 可以分成两步写2NaOH+CO2=Na2CO3+H2O(2OH-+CO2=CO32-+H2O) Na2CO3+CO2+H2O=2NaHCO3 (CO32-+CO2+H2O=2 HCO3-) 8、※碳酸钠与盐酸反应Na2CO3+2HCl=2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑9、※碳酸氢钠与盐酸反应NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑10、※碳酸钠溶液不与氢氧化钠溶液反应,碳酸氢钠溶液与氢氧化钠溶液反应NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH-=CO32-+H2O11、※碳酸钠溶液和碳酸氢钠溶液分别都能与氢氧化钙(钡)溶液反应,都有⽩⾊沉淀⽣成沉淀Na2CO3+Ca(OH)2=CaCO3↓+2N aOHCO32-+Ca2+=CaCO3↓NaHCO3(少)+Ca(OH)2=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH-=CaCO3↓+H2O2NaHCO3(过)+Ca(OH)2=CaCO3↓+Na2CO3+2H2O2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O 12、※碳酸钠溶液与氯化钙(钡)溶液反应有⽩⾊沉淀⽣成,碳酸氢钠溶液不与氯化钙(钡)溶液反应Na2CO3+CaCl2=CaCO3↓+2NaClCO32-+Ca2+=CaCO3↓13、※碳酸钠溶液能吸收⼆氧化碳⽓体发⽣反应,碳酸氢钠溶液不能吸收⼆氧化碳⽓体Na2CO3+CO2+H2O=2NaHCO3CO32-+ CO2+H2O =2HCO3-14、碳酸钠稳定受热不分解,碳酸氢钠不稳定受热分解2NaHCO3△Na2CO3+CO2↑+H2O⼆、铝及其重要化合物1、⾦属铝常温能与氧⽓反应,表⾯⽣成致密氧化膜(加热也可);铝在氯⽓中燃烧。

一、卤族元素:F 2+H 2===2HF (阴暗处爆炸)2F 2+2H 2O===4HF+O 2 (水是还原剂) Cl 2+H 22HCl (将H 2在Cl 2点燃;混合点燃、加热、光照发生爆炸) 3Cl 2+2P2PCl 3 Cl 2+PCl 3PCl 5 Cl 2+2Na 2NaCl3Cl 2+2Fe 2FeCl 3 Cl 2+Cu CuCl 2 Cl 2+2FeCl 2===2FeCl 3 (在水溶液中:Cl 2+2Fe 2+===2Fe 3++3Cl -)Cl 2+2NaBr===2NaCl+Br 2 Cl 2+2Br -=2Cl -+Br 2Cl 2+2KI===2KCl+I 2 Cl 2+2I -=2Cl -+I 2Cl 2+Na 2S===2NaCl+S ↓ Cl 2+S 2–=2Cl –+S ↓Cl 2+H 2S===2HCl+S ↓ (水溶液中:Cl 2+H 2S=2H ++2Cl –+S ↓)Cl 2+SO 2+2H 2O===H 2SO 4+2HCl Cl 2+SO 2+2H 2O=4H ++SO 42–+2Cl – Cl 2+H 2O==HCl+HClO (加碱或光照促进歧化) Cl 2+H 2O H ++Cl –+HClOCl 2+2NaOH==NaCl+NaClO+H 2O Cl 2+2OH –=Cl –+ClO –+H 2OCl 2+2Ca(OH)2==CaCl 2+Ca(ClO)2+2H 2O Cl 2+2OH –=Cl –+ClO –+H 2O3Cl 2+6KOH(浓)5KCl+KClO 3+3H 2O 3Cl 2+6OH –5Cl –+ClO 3–+3H 2O4HCl(浓)+MnO 2MnCl 2+Cl 2↑+2H 2O 4H ++2Cl –+MnO 2Mn 2++Cl 2↑+2H 2O 16HCl+2KMnO 4===2KCl+2MnCl 2+5Cl 2↑+8H 2O 16 H ++10Cl -+2MnO 4–=2Mn 2++5Cl 2↑+8H 2O 6HCl+KClO 3==KCl+3Cl 2↑+3H 2O 6H ++5Cl –+ClO 3–=3Cl 2↑+3H 2O14HCl+K 2Cr 2O 7===2KCl+2CrCl 3+3Cl 2↑+7H 2O 14H ++6Cl –+Cr 2O 72–=2Cr 3++5Cl 2↑+7H 2O 3HClO+HI===HIO 3+3HCl 3HClO+I -=IO 3–+3H ++Cl –HClO+H 2SO 3===H 2SO 4+HCl HClO+H 2SO 3=3H ++SO 42–+Cl – 2HClO 2HCl+O 2↑(保存在棕色瓶中)二、氧族元素:S+O 2SO 2 S+H 2SO 4(浓)3SO 2↑+2H 2OS+6HNO 3(浓)H 2SO 4+6NO 2↑+2H 2O S+4H ++6-3NO ==6NO 2↑+2H 2O+-24SO3S+4HNO 3(稀)3SO 2+4NO ↑+2H 2O 3S+4H ++4-3NO 3SO 2+4NO ↑+2H 2O 2H 2S+3O 2(足量)2SO 2+2H 2O 2H 2S+O 2(少量)2S ↓+2H 2O 2H 2S+SO 2===3S ↓+2H 2O H 2S+H 2SO 4(浓)===S ↓+SO 2↑+2H 2O 3H 2S+2HNO 3(稀)===3S ↓+2NO ↑+4H 2O 3H 2S+2H ++2NO 3–=3S ↓+2NO ↑+4H 2O 5H 2S+2KMnO 4+3H 2SO 4===2MnSO 4+K 2SO 4+5S ↓+8H 2O 5H 2S+2MnO 4–+6H +=2Mn 2++5S ↓+8H 2O 3H 2S+K 2Cr 2O 7+4H 2SO 4===Cr 2(SO 4)3+K 2SO 4+3S ↓+7H 2O 3H 2S+Cr 2O 72–+8H +===2Cr 3++3S ↓+7H 2O 3Na 2S+8HNO 3(稀)===6NaNO 3+2NO ↑+3S+4H 2O 3S 2-+8H ++2NO 3-=2NO ↑+3S+4H 2O Na 2S+Cl 2==2NaCl+S ↓(在水溶液中) S 2-+Cl 2=2Cl -+S ↓H 2S+CuCl 2===CuS ↓+2HCl (弱酸制强酸的典型反应) H 2S+Cu 2+=CuS ↓+2H +2SO 2+O 2+2H 2O===2H 2SO 4(这是SO 2在大气中缓慢发生的环境化学反应)2SO 2+O 2催化剂 加热 2SO 3SO2+Cl2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl–SO2+Br2+2H2O===H2SO4+2HBr Br2+SO2+2H2O=4H++SO42–+2Br–SO2+I2+2H2O===H2SO4+2HI I2+SO2+2H2O=4H++SO42–+2I–SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO32NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑(硫酸工业尾气处理)SO2+Ca(OH)2===CaSO3↓+H2O (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)H2SO3+2H2S===3S↓+3H2OH2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2) H2SO3+X2+H2O=4H++SO42-+X–2H2SO3+O2==2H2SO42H2SO3+O2=4H++SO42-H2SO3+H2O2===H2SO4+H2O H2SO3+H2O2=2H++SO42–+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O 5H2SO3+2MnO4–=2Mn2++4H++3SO42–+3H2O H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl H2SO3+2Fe3++H2O=4H++2Fe2+ +SO42–3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O 3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O2Na2SO3+O2===2Na2SO4 (Na2SO3在空气中易变质)2H2SO4(浓)+C CO2↑+2SO2↑+2H2OH2SO4+Fe(Al)室温下钝化6H2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr===SO2↑+Br2+2H2O (不能用浓硫酸与NaBr制取HBr)H2SO4(浓)+2HI===SO2↑+I2+2H2O (不能用浓硫酸与NaI制取HI)H2SO4(稀)+Fe===FeSO4+H2↑2H++Fe=Fe2++H2↑三、氮族元素:N2+3H2催化剂2NH3N2+3Mg Mg3N2N2+O2 2NO高温高压2NH3+3CuO3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl 8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)2N2+6H2O 4NH3+5O2催化剂4NO+6H2O△4NH3+6NO===5N2+6H2O (用氨清除NO)NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(侯德榜制碱:用于工业制备小苏打,苏打)2NO+O2===2NO23NO2+H2O===2HNO3+NO (NO2不是硝酸的酸酐)NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4HNO3(浓)+C CO2↑+4NO2↑+2H2O6HNO3(浓足)+Fe===Fe(NO3)3+3NO2↑+3H2O 6H++3NO3-+Fe=Fe3++3NO2↑+3H2O4HNO3(浓)+Fe(足)===Fe(NO3)2+2NO2↑+2H2O 4H++2NO3-+Fe=Fe2++2NO2↑+2H2O4HNO3(稀足)+Fe===Fe(NO3)3+NO↑+2H2O 4H++NO3-+Fe=Fe3++NO↑+2H2O4HNO34NO2↑+O2↑+2H2O (保存在棕色瓶中)Ca(OH)2+2NH4Cl2CaCl2+2NH3↑+2H2O (实验室制NH3)NaOH+NH4Cl NaCl+NH3↑+H2O四、碳族元素:C+O2(足量)CO2 2C+O2(少量)2COC+CO22CO C+H2O(g)CO+H2(生成水煤气)2C+SiO2Si+2CO(制得粗硅) Si(粗)+2Cl2SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2SiO2Si+C SiC(金刚砂) 4HF+Si===SiF4+2H2↑Si+2NaOH+H2O==Na2SiO3+2H2↑(Si+2OH-+H2O=-2SiO+2H2↑)34HF+SiO2===SiF4+2H2O(可测定矿样或钢样中SiO2的含量,玻璃雕刻)2CO+O22CO2CO+CuO Cu+CO2CO2+H23CO+Fe2O32Fe+3CO2CO+H2O催化剂加热CO2+2Mg2MgO+C (CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)CO2+NH3+H2O===NH4HCO3CO2+2NH3(过量)+H2O===(NH4)2CO3CO2+2NaOH(过量)==Na2CO3+H2O 2OH-+CO2=CO32–+H2OCO2(过量)+NaOH==NaHCO3OH-+CO2=HCO3–CO2+Ca(OH)2(过量)==CaCO3+H2O Ca2++2-OH+CO2=CaCO3↓+H2O2CO2(过量)+Ca(OH)2==Ca(HCO3)2OH―+CO2=HCO3–CO2+CaCO3+H2O==Ca(HCO3)2CO2+CaCO3+H2O=Ca2++2HCO3–SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3Na2SiO3+CO2 (制取玻璃) SiO2+CaCO3CaSiO3+CO2(制取玻璃)H2SiO3 SiO2↓+H2ONa2SiO3+2HCl===H2SiO3↓+NaCl SiO32-+2H+=H2SiO3↓Na2SiO3+CO2+2H2O===H2SiO3↓+Na2CO3SiO32-+CO2+2H2O=H2SiO3↓+CO32-一、钠及其化合物:4Na+O2==2Na2O 2Na2O+O22Na2O22Na+O2Na2O22Na+S==Na2S(爆炸)2Na+2H2O==2NaOH+H2↑2Na+2H2O=2Na++2OH―+H2↑4Na+TiCl44NaCl+Ti 2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2H2O=4Na++4OH–+O2↑2Na2O2+2CO2==2Na2CO3+O2↑2NaHCO3Na2CO3+H2O+CO2↑NaHCO3+NaOH==Na2CO3+H2O HCO3-+OH-=CO32–+H2ONa2CO3+H2O+CO2===2NaHCO3CO32-+H2O+CO2=2HCO3-Na2CO3+HCl===NaHCO3+NaCl CO32-+H+=HCO3-Na2CO3+2HCl===2NaCl+H2O+CO2↑CO32-+2H+=CO2↑+H2ONaHCO3+HCl===NaCl+H2O+CO2↑HCO3-+H+=CO2↑+H2O二、铝及其化合物2Al+3Cl22AlCl34Al+3O2===2Al2O3 (常温生成致密氧化膜而钝化,在氧气中燃烧)3S+2Al Al2S3 (只能由单质制取,不能由离子制取)4Al+3MnO22Al2O3+3Mn 2Al+Cr2O3Al2O3+2Cr (铝热反应)2Al+Fe2O3Al2O3+2Fe 2Al+3FeO Al2O3+3Fe2Al+6HCl===2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+6H+=2Al3++3H2↑2Al+6H2SO4(浓)Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O Al+4H++NO3–=Al3++NO↑+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H2↑2Al+2OH–+2H2O=2AlO2–+3H2↑Al2O3+3H2SO4===Al2(SO4)3+3H2O Al2O3+6H+=2Al3++3H2OAl2O3+2NaOH===2NaAlO2+H2O Al2O3+2OH―=2AlO2―+H2OAl(OH)3+3HCl==AlCl3+3H2O Al(OH)3+3H+=Al3++3H2OAl(OH)3+NaOH==NaAlO2+2H2O Al(OH)3+OH–=AlO2–+2H2OAlCl3+3NaOH==Al(OH)3↓+3NaCl Al3+ +3OH–=Al(OH)3↓AlCl3+4NaOH==NaAlO2+3NaCl +2H2O Al3+ +4OH–=AlO2–+2H2OAlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl Al3++3NH3·H2O=Al(OH)2↓+3NH4+NaAlO2+H2O+HCl===Al(OH)3↓+NaCl AlO2-+H2O+H+=Al(OH)3↓NaAlO2+4HCl===AlCl3+NaCl +2H2O AlO2-+4H+=Al3++2H2OCO2(不足)+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3CO2+3H2O+AlO2–=Al(OH)3↓+CO32–CO2(足)+NaAlO2+2H2O===Al(OH)3↓+NaHCO3CO2+2H2O+AlO2–=Al(OH)3↓+HCO3–三、铁、铜及其化合物3Cl2+2Fe2FeCl33Fe+2O2 Fe3O4S+Fe FeS (既能由单质制取,又能由离子制取)S+2Cu Cu2S (只能由单质制取,不能由离子制取) Cl2+Cu CuCl23Fe+4H2O(g)Fe3O4+4H2↑6FeO+O2===2Fe3O4Fe+2HCl===FeCl2+H2↑Fe+2H+=Fe2++H2↑Fe+CuCl2===FeCl2+Cu Fe+Cu2+=Fe2++CuFeO+4HNO3===Fe(NO3)3+NO2+2H2O FeO+4H++NO3―=Fe3++NO2↑+2H2OFe2O3+3H22Fe+3H2O(制还原铁粉) Fe3O4+4H23Fe+4H2O CuO+H2Cu+H2O FeO+2HCl===FeCl2+H2O FeO+2H+=Fe2++H2OFe2O3+6HCl===2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O Fe3O4+8H+=2Fe3++Fe2++4H2OCl2+2Fe2+===2Fe3++2Cl 2Fe2++H2O2+2H+=2Fe3++2H2O6Fe2+ + 3ClO- + 3H2O === 2Fe(OH)3↓ + 4Fe3+ + 3Cl-3Fe2+ +4H+ +NO3-===3Fe3+ +NO↑+2 H2OMnO4- + 5Fe2+ + 8H+ === Mn2+ + 5Fe3+ + 4H2O6Fe2+ + Cr2O72- + 14H+ == 6Fe3+ + 2Cr3+ + 7H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl H2SO3+2Fe3++H2O=4H++2Fe2+ +SO42–2FeCl3+Fe==3FeCl22Fe3++Fe=3Fe2+2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版) 2Fe3++Cu=2Fe2++Cu2+2FeCl3+H2S===2FeCl2+2HCl+S↓2Fe3++H2S=2Fe2++2H++S↓2FeCl3+2KI===2FeCl2+2KCl+I22Fe3++2I-=2Fe2++I2FeCl3+3NH3·H2O===Fe(OH)3↓+3NH4Cl Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+FeCl3+3KSCN==Fe(SCN)3+3KCl Fe3++3SCN-=Fe(SCN)3(红色,用于Fe3+的特性检验)2Fe(OH)3Fe2O3+3H2O Cu(OH)2CuO+H2O 4Fe(OH)2+O2+2H2O===4Fe(OH)3。

高一必修一铁及其化合物的化学反应方程式
铁及其化合物是当今世界中相当重要的物质,自史前以来就被大量使用。
这种稀有金属由于其易于锻造及耐腐蚀而十分受人们欢迎,用于建造桥梁和房屋,也曾在很多国家发行货币。
铁在单质状态下是黑色的,与氧及其他元素化合会形成有色,重量较轻的化合物。
铁及其化合物的化学反应方程式主要有以下几种:
1、铁与硫化氢的反应:Fe + H2S → FeS + H2
2、铁与四氧化三铁的反应:Fe + Fe2O3 → 3FeO
3、铁与硫酸的反应:Fe + H2SO4 → FeSO4 + H2
4、铁与氧气的反应:4Fe + 3O2 → 2Fe2O3
5、铁与氧的反应:4Fe + 3O2 → 2Fe2O3
铁及其化合物在人们的生活中占据了非常重要的地位,它们可以高效地把资源转化为实用的物资。
通过上述化学反应方程式可以看出,铁与其他元素在反应中表现出了明显的不同性质。
实验表明,铁是一种非常可靠的建造材料,因此,它在建筑、桥梁、货币制作和发电等领域都有着极大的应用价值。

高中化学元素及化合物所有化学方程式非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)三, 非金属氢化物(HF,HCl,H2O,H2S,NH3) 1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O 2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四,非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五,金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O六,含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七,碱低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八,盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。

金属及其化合物1、钠放置在空气中 4Na + O2 = 2Na2O2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)3、铝箔被氧气氧化 4Al + 3O2 △2O34、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】5、高温下铁与水反应 3Fe + 4H2O(g) 高温Fe3O4 + 4H26、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】7、铝与氢氧化钠溶液反应(实际是钠和水反应) 2Al + 2NaOH + 2H2O = 2NaAlO2(偏铝酸钠) + 3H2↑【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O = 4NaOH + O2↑【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】9、过氧化钠可用在呼吸面具和潜水艇中作为【供氧剂】,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O210、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑【 CO32- + 2H+ = H2O + CO2↑】11、小苏打(碳酸氢钠)溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑【HCO3- + H+ = H2O + CO2↑】12、小苏打受热分解 2NaHCO3△Na2CO3 + H2O +CO2 ↑13、小苏打和氢氧化钠溶液溶液反应NaHCO3+NaOH= Na2CO3 + H2O 【HCO3-+ OH - = H2O + CO32- 】14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O 【Al2O3 + 2OH - === 2AlO2- + H2O】15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O 【Al2O3 +6H+ = 2Al3+ +3H2O】16、硫酸铝溶液中滴加过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O 【Al(OH)3 + 3H+ = Al3+ + 3H2O】18、Al(OH)3与NaOH溶液反应: Al(OH)3 + NaOH NaAlO2 +2H2O【Al(OH)3 + OH - = AlO2- +2H2O】19、氢氧化铝受热分解 2Al(OH)3△Al2O3+3H2O20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑【Fe + 2H+ = Fe2+ + H2↑】21、氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 【Fe 2O 3 + 6H + = 2Fe 3++ 3H 2O 】 22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl 2 + H 2O 【FeO + 2H += Fe 2++ H 2O 】 23、氯化铁溶液中滴入氢氧化钠溶液 FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl【Fe 3++ 3OH - = Fe(OH)3 ↓(红褐色沉淀)】 24、硫酸亚铁溶液中滴加氢氧化钠溶液Fe SO 4+ 2NaOH = Fe(OH)2↓+ Na 2SO 4 【Fe 2++ 2OH - = Fe(OH)2 ↓(白色沉淀)】25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O 2 +2H 2O = 4Fe(OH)3 26、氢氧化铁受热分解 2Fe(OH)3△Fe 2O 3+3H 2O27、氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 【2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - 】 28、氯化铁溶液中加入铁粉2FeCl 3 + Fe =3FeCl 2 【2Fe 3++ Fe =3Fe 2+】非金属及其化合物1、硅及其化合物的转化关系※ ①SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)※ ②SiO 2+2NaOH = Na 2SiO 3+H 2O( SiO 2+2OH -= SiO 32-+H 2O )※ ③Na 2SiO 3+2HCl = H 2SiO 3(胶体)+2NaCl ( SiO 32-+2H += H 2SiO 3(胶体))④ SiO 2+CaO 高温 CaSiO 32、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3②Cu +Cl 2 点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2(2Fe 3++Cu = 2Fe 2++Cu 2+)④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O(MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O) ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑(不稳定性)(Cl 2+H 2O = H ++Cl -+HclO) (2HClO 2H ++2Cl -+O 2↑)※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O (工业制漂白粉) Ca(ClO)2+CO 2+H 2O = CaCO 3↓+2HClO(漂白原理)3、硫及其化合物的转化关系Na 2SiO 3 SiF 4 SiO 2 H 2SiO 3CaSiO 3 ① ② ③④ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨点燃或光照 光照光照①S +O 2 点燃 SO 2 ※②SO 2+O 2 催化剂 加热 2SO 3③SO 3+H 2O = H 2SO 4(工业制硫酸) ④SO 2+H 2O H 2SO 3⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O(SO 2+Ca 2++2OH -=CaSO 3↓+H 2O )⑥SO 3+CaO = CaSO 4 或 SO 3+Ca(OH)2 = CaSO 4+H 2O※⑦Cu+2H 2SO 4(浓) △ CuSO 4+SO 2↑+2H 2O ※⑧C +2H 2SO 4(浓) △CO 2↑+2SO 2↑+2H 2O4、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO ( 3NO 2+H 2O =2H ++2NO 3-+NO)※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O)※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂高温高压 2NH 3 (3Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O ) (工业制氨气)⑦NH 3+HCl = NH 4Cl NH 4HCO 3 △NH 3↑+H 2O+CO 2↑(铵盐受热易分解)⑧NH 4Cl△NH 3↑+HCl ↑(水溶液中)( NH 3+H += NH 4+) ⑧NH 4Cl +NaOH △ NaCl+NH 3↑+H 2O (NH 4++OH-△NH 3↑+H 2O) ※⑧2NH 4Cl +2Ca(OH)2 △ CaCl 2+2NH 3↑+2H 2O⑨4NH 3+5O 2 催化剂△ 4NO +6H 2OSO 42 3 CaSO 3 4① ⑨ ⑧⑦ ⑥ ④ ③ N 2 NH 3 NH 4Cl NO 3② ③高温或放电。

一、钠及其化合物(1)钠1.钠与非金属:O2Cl2S4Na+O2=2Na2O2Na+O2= Na2O22. 钠与水: 浮熔游响红2Na+2H2O=2NaOH+H2↑3.钠与盐溶液:CuSO4溶液2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH)2↓+ Na2SO44.钠与酸:盐酸2Na+2HCl=2NaCl+H2↑(2)氧化钠过氧化钠2Na2O+ O2 =2Na2O22Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2(3)氢氧化钠:碱的通性2NaOH+CO2=Na2CO3+ H2ONaOH+CO2=NaHCO3(4)碳酸钠碳酸氢钠1.与酸CO32-+2H+=H2O+CO2↑CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑2.受热分解2NaHCO3=Na2CO3+H2O+CO2↑3.与盐:CaCl2溶液、BaCl2溶液CO32-+Ca2+=CaCO3↓4.与碱NaHCO3+NaOH=Na2CO3+H2O5.转化Na2CO3+H2O+CO2=2NaHCO3Na2CO3+HCl=NaHCO3+NaCl2NaHCO3=Na2CO3+H2O+CO2↑NaHCO3+NaOH=Na2CO3+H2O 二、铝及其化合物(1)铝1.铝与非金属单质:O2Cl24Al+3O2= 2Al2O32. 铝与酸2Al+6HCl= 2AlCl3+3H2↑3.铝与强碱2Al+2NaOH+2H2O= 2NaAlO2+3H2↑(2)氧化铝:两性氧化物,不溶于水。
Al2O3+6HCl =2AlCl3+3H2OAl2O3+6H+=2Al3++3H2OAl2O3+2NaOH =2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O(3)氢氧化铝:两性氢氧化物。
1.两性Al(OH)3+3HCl =AlCl3+3H2OAl(OH)3+NaOH= NaAlO2+2H2O2.不稳定性2Al(OH)3Al2O3+3H2O3. 实验室制取氢氧化铝Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4 Al3++3NH3•H2O =Al(OH)3↓+3NH4+(4)Al3+、Al(OH)3与AlO2—相互转化Al3++3OH-=Al(OH)3↓Al3+ + 4OH—=AlO2—+ 2H2OAl(OH)3+OH-=AlO2-+2H2OAl(OH)3 + H+=Al3+ +3 H2OAlO2—+ H+ + H2O = Al(OH)3↓AlO2—+ 4H+ = Al3+ +2 H2O△△△△△三、铁及其化合物(1)铁1. 铁与非金属:O2、Cl2、S3Fe+2O Fe3O42Fe+3Cl22FeCl3Fe+S FeS2. 铁与水蒸气3Fe+4H2O(g)== Fe3O4 +4H23.铁与酸:盐酸、稀硫酸Fe+2H+=Fe2++H2↑4. 铁与盐溶液Fe+CuSO4=FeSO4+CuFe+2FeCl3=3 FeCl2(2)铁的氧化物:FeO(黑色粉末)、Fe3O4(黑色粉末、具有磁性)、Fe2O3(红棕色粉末)1.与酸FeO+2HCl=FeCl2+H2↑Fe2O3+6HCl=2FeCl3+3H2OFe3O4+8HCl=FeCl2+2FeCl3+4H2O2. 与还原剂反应FeO+H2Fe+H2OFe2O3+3CO2Fe+3CO23.不稳定性6FeO+O2 2 Fe3O4(3)铁的氢氧化物:Fe(OH)2 (白色固体) 、Fe(OH)3 (红褐色固体) 1.与酸Fe(OH)2+2H+ =Fe2++2H2OFe(OH)3+3H+=Fe3++3H2O2.不稳定性4Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3Fe2O3+3H2O(4)Fe2+及Fe3+离子的检验:①Fe2+的检验:(浅绿色)a) 加氢氧化钠溶液,产生白色沉淀,迅速变成灰绿色,最后变红褐色。

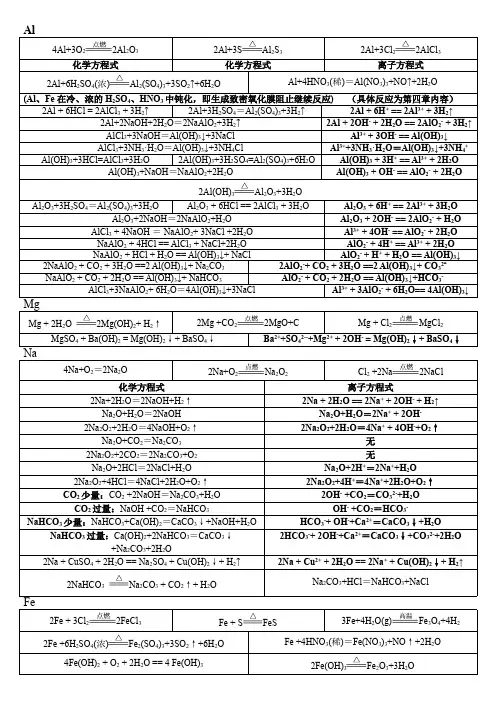
1元素及其化合物方程式4Na+O 2===2Na 2O 2Na+O 2△Na 2O 2Na 2O+H 2O===2NaOH Na 2O+H 2O=== 2Na ++2OH —Na 2CO 3+HClNaHCO 3+NaCl CO 32—+H +===HCO 3— NaOH+CO 2(过量)=== NaHCO 3 OH -+CO 2=== HCO 3—Ca(OH)2+Na 2CO 3==CaCO 3↓+ 2NaOH Ca 2++CO 32—=== CaCO 3↓ Ca(OH)2+2NaHCO 3==CaCO 3↓+ Na 2CO 3+2H 2O ,其中NaHCO 3过量 Ca 2++2OH -+2HCO 3—=== CaCO 3↓+CO32—+2H 2OCa(OH)2+NaHCO 3==CaCO 3↓+ Na OH+H 2O ,其中NaHCO 3少量 Ca 2++OH —+HCO 3—=== CaCO 3↓+H 2O4Al+3O 22Al 2O 3 2Al(OH)3 Al 2O 3+3H 2O AlCl 3+3NaOH (少量)===Al(OH)3↓+3NaCl Al 3++3OH —===Al(OH)3↓ AlCl 3+4NaOH (过量)===NaAlO 2+3NaCl+2H 2O Al 3++4OH —===AlO 2—+2H 2O NaAlO 2+2H 2O+CO 2=Al(OH)3↓+NaHCO 3 AlO 2—+2H 2O+CO 2 = Al(OH)3↓+HCO 3—AlCl 3+3NaAlO 2+6H 2O == 4Al(OH)3↓+3NaCl Al 3++3AlO 2—+6H 2O = 4Al(OH)3↓23Fe+4H 2O(g)△Fe 3O 4+4H 2 2Fe(OH)3△Fe 2O 3+3H 2O2FeCl 2+Cl 2=== 2FeCl 3 2Fe 2++Cl 2=== 2Fe 3++2Cl — 2FeCl 3+Fe === 3FeCl 2 2Fe 3++Fe === 3Fe 2+ 2FeCl 3+Cu===2FeCl 2+CuCl 2 2Fe 3++Cu===2Fe 2++Cu 2+ Fe+CuSO 4=== FeSO 4+Cu Fe+Cu 2+===Fe 2++Cu Fe 2O 3+6HCl===2FeCl 3+3H 2O Fe 2O 3+6H +==2Fe 3++3H 2O Fe(OH)2+2HCl===FeCl 2+2H 2O Fe(OH)2+2H +===Fe 2++2H 2O Fe(OH)3+3HCl===FeCl 3+3H 2O Fe(OH)3+3H +===Fe 3++3H 2O FeCl 2+2NaOH===Fe(OH)2↓+2NaCl Fe 2++2OH —===Fe(OH)2↓ FeCl 3+3NaOH===Fe(OH)3↓+3NaCl Fe 3++3OH —===Fe(OH)3↓Fe+S△FeS Fe 3++3SCN —===Fe(SCN)34、硅及其化合物SiO 2+2NaOHNa 2SiO 3+H 2O SiO 2+2OH —===SiO 32—+H 2OSiO 2+4HFSiF 4↑+2H 2O Na 2SiO 3+2HCl===H 2SiO 3(胶体)+2NaCl SiO 2+2C 高温Si+2CO↑ SiO 2+CaO 高温CaSiO 3Na 2SiO 3+H 2O+CO 2 H 2SiO 3↓+Na 2CO 3 SiO 32—+H 2O+CO 2 H 2SiO 3↓+CO 32—5、氯及其化合物 2Fe+3Cl 2点燃2FeCl 3 Cu+Cl 2点燃CuCl 2 2HClO 2HCl+O 2↑Cl 2+2KBr ===2KCl+Br 2 Cl 2+2Br —===2Cl —+Br 2 Cl 2+2KI ===2KCl+I 2 Cl 2+2I —===2Cl —+I 2 Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO Ca 2++2ClO —+H 2O+CO 2=CaCO 3↓+2HClO Cl 2+H 2O HCl+HClO Cl 2+H 2O H ++Cl —+HClOCl 2+2NaOH NaCl+NaClO+H 2O Cl 2+2OH - Cl —+ClO —+H 2O MnO 2+4HCl(浓) △MnCl 2+ Cl 2↑+2H 2O MnO 2+4H ++2Cl△Mn 2++ Cl 2↑+2H 2O6、硫及其化合物2SO 2+O 2催化剂加热2SO 3 2H 2SO 4(浓)+Cu△CuSO 4+SO 2↑+2H 2OC+2H 2SO 4 △CO 2↑+2SO 2↑+2H 2O SO 2+2H 2S =3S ↓+2H 2O SO 2+Cl 2+2H 2O =H 2SO 4+2HCl SO 2+Cl 2+2H 2O =4H ++2Cl —+SO 42— S+O 2点燃SO 2 Fe+S △FeS SO 2+H 2O H 2SO 3 SO 3+Ca(OH)2=CaSO 4+H 2O Ca(OH)2+SO 2=CaSO 3↓+H 2O Ca+2OH —+SO 2=CaSO 3↓+H 2O7、氮及其化合物 N 2+O 22NO SO 3+H 2O =H 2SO 4 N 2+3H 2催化剂 高温高压2NH 32NH 4Cl+Ca(OH)2 △CaCl 2+2NH 3↑+2H 2O NH 3+HCl =NH 4Cl 3NO 2+H 2O =2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3—+NO4HNO 3(浓)+CuCu(NO 3)2+2NO 2↑+2H 2O 4H ++2NO 3—+Cu=Cu 2++2NO 2↑+2H 2O8HNO 3(稀)+3Cu 3Cu(NO 3)2+2NO↑+4H 2O 8H ++2NO 3—+3Cu===3Cu 2++2NO↑+4H 2O NH 4Cl△NH 3↑+HCl↑ NH 4HCO 3△NH 3↑+H 2O↑+CO 2↑ NH 3+H 2ONH 3•H 2O NH 4+ +OH —。

必修1元素化合物化学方程式汇总 氯、溴、碘一、氯气的工业生产原理:电解饱和食盐水 2NaCl+2H 2O2NaOH+ H 2↑+ Cl 2↑阴极 阳极 二、氯气的实验室制取原理:MnO 2+4HCl (浓)△MnCl 2+Cl 2↑+2H 2O三、氯气的性质 1.与金属的反应 2Fe+3Cl 2点燃2FeCl 3 Cu+Cl 2点燃CuCl 2 2Na+Cl 2点燃2NaCl 2.与非金属的反应 H 2+Cl 2点燃2HCl 2P+3Cl 2点燃2PCl 3 2P+5Cl 2点燃2PCl 53.与水的反应 Cl 2+H 2OHCl+HClO ( 次氯酸)4.Cl 2与碱溶液的反应Cl 2+2NaOH=NaCl+NaClO+H 2O2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O(制漂白粉) Ca(ClO)2+CO 2+H 2O=CaCO 3↓+2HClO (漂白原理) Ca(ClO)2+2HCl=CaCl 2+2HClO 四、溴、碘的化学性质 1.与金属的反应2Fe+3Br 2=2FeBr 3 Fe+I 2△FeI 2 (氧化性Br 2>I 2)2.与非金属的反应 F 2+H 2=2HF 冷暗处爆炸 Cl 2+H 2点燃2HClBr 2+H 2△ 2HBr I 2+H 2△2HI(氧化性F 2> Cl 2>Br 2> I 2) 3.与水的反应2F 2+2H 2O=4HF+O 2 X 2+H 2O=HX+HXO(Cl 2,Br 2,I 2) 4.与碱溶液的反应Br 2+2NaOH=NaBr+NaBrO+H 2O5.置换反应Cl 2+2NaBr=2NaCl+Br 2 Cl 2+2NaI= 2NaCl+I 2 Br 2+ 2NaI= 2NaBr+ I 2(氧化性F 2> Cl 2>Br 2> I 2 还原性I —>Br - >Cl ->F -)五、.卤化银Ag + Cl -= AgCl ↓(白色沉淀) Ag + +Br -= AgBr ↓(淡黄色沉淀)Ag + +I -= AgI ↓(黄色沉淀) (X -的检验,Ag + X -= AgX ↓)2AgBr 光照2Ag ++Br 2钠一.钠的化学性质 1.与非金属的反应4Na +O 2=2Na 2O (白色) 2Na + O 2△Na 2O 2 (淡黄色)2Na +Cl 2点燃2NaCl 2.与水反应:2Na + 2H 2O = 2NaOH + H 2↑3.与酸反应2Na+2HCl=2NaCl+H 2 ↑ 2Na+H 2SO 4=Na 2SO 4+H 2↑4.与盐反应:A.盐溶液:钠与硫酸铜溶液的反应①2Na + 2H 2O = 2NaOH + H 2 ↑ ②CuSO 4 + 2NaOH = Na 2SO 4 + C u (O H )2 ↓方程式叠加总反应方程式:CuSO 4 + 2Na + 2H 2O = Cu(OH)2 ↓+ Na 2SO 4 + H 2↑ B.钠和熔融盐反应 2Na+CuSO 4(熔融) = Cu+Na 2SO 44Na+TiCl 4 (熔融) = Ti+4NaCl二、钠的制备工业上通常采用电解熔融的 NaCl 2NaCl电解2Na + Cl 2↑三、过氧化钠2Na 2O 2+2H 2O=4NaOH+O 2↑ 2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑ 四、碳酸钠与碳酸氢钠 1.与酸的反应Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ NaHCO 3+HCl=NaCl+H 2O+CO 2↑ 2.与碱的反应Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH 2NaHCO 3+Ca(OH)2=CaCO 3↓+Na 2CO 3+H 2O NaHCO 3+NaOH = +Na 2CO 3+H 2O 3.与盐的反应Na 2CO 3+CaCl 2=2NaCl+CaCO 3↓ Na 2CO 3+BaCl 2=2NaCl+BaCO 3↓4、热稳定性 2NaHCO 3 △Na 2CO 3+H 2O+CO 2↑镁一、化学性质1.与非金属的反应 2Mg + O 2 点燃2MgO 3Mg + N 2 点燃Mg 3N 2 (Mg 3N 2 +6H 2O=3Mg (OH )2+2NH 3↑ Mg 3N 2 +8HCl=3MgCl 2+2NH 4Cl )Mg + Cl 2△MgCl 2 Mg + S△MgS2.与水的反应Mg + 2H 2O△M g (O H )2 + H 23。

高一化学方程式大全以下是一些常见的高一化学方程式示例:
1. 酸碱中和反应:
酸 + 碱→盐 + 水
例如:HCl + NaOH → NaCl + H2O
2. 酸与金属反应:
酸 + 金属→盐 + 氢气
例如:2HCl + Zn → ZnCl2 + H2
3. 碱与非金属氧化物反应:
碱 + 非金属氧化物→盐 + 水
例如:2NaOH + CO2 → Na2CO3 + H2O
4. 化合物分解反应:
化合物→元素(或氧化物)
例如:2HgO → 2Hg + O2
5. 金属与非金属氧化物反应:
金属 + 非金属氧化物→相应的金属氧化物
例如:2Na + Cl2O → Na2O + Cl2
6. 酸与碳酸盐反应:
酸 + 碳酸盐→盐 + 二氧化碳 + 水
例如:2HCl + Na2CO3 → 2NaCl + CO2 + H2O
7. 酸与金属氧化物反应:
酸 + 金属氧化物→盐 + 水
例如:2HCl + MgO → MgCl2 + H2O
8. 酸与金属碳酸盐反应:
酸 + 金属碳酸盐→盐 + 二氧化碳 + 水
例如:2HCl + CaCO3 → CaCl2 + CO2 + H2O
这只是一小部分高一化学中常见的方程式示例。
化学方程式的种类非常多,根据不同的反应类型和化学反应方程的基本规律,可以衍生出更多的方程式。
在学习化学的过程中,会接触到更多不同类型的反应方程式,并学习如何正确地写出它们。

必修1化学方程式1、常温下钠与氧气反应:4Na + O2 = 2Na2O (白色)2、钠在空气中燃烧:2Na + O2△Na2O2(淡黄色)3、钠在氯气中燃烧:2Na + Cl2△2NaCl (白烟)4、钠与硫共热:2Na +S △2S5、钠与水反应:2Na + 2H2O = 2NaOH + H2↑6、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑7、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O28、铁在氧气中燃烧:3Fe+2O2点燃Fe3O49、铁与水蒸气反应:3Fe + 4H2O(g) △Fe3O4 + 4H210、2NaHCO3△Na2CO3 + CO2↑+ H2O11、Al与盐酸反应:2Al+6HCl===2AlCl3+3H2↑12、Al2O3与盐酸反应:Al2O3 + 6HCl===2AlCl3 + 3H2O13、Al(OH)3与盐酸反应:Al(OH)3 +3HCl=== AlCl3 + 3H2O14、Al与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O===2NaAlO2 + 3H2↑2Al + 2 OH- + 2H2O===2AlO2- + 3H2↑15、Al2O3与氢氧化钠溶液反应:Al2O3 + 2NaOH === 2NaAlO2 + H2OAl2O3 + 2OH-=== 2 AlO2- + H2O16、Al(OH)3与氢氧化钠溶液反应:Al(OH)3 + NaOH === NaAlO2 + 2H2O17、氧化亚铁与盐酸反应:FeO+2HCl=FeCl2 +H2O18、氧化铁与盐酸反应:Fe2O3 + 6HCl= 2FeCl3 + 3H2O19、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓(红褐色)20、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓(白色)生成的白色沉淀迅速变成灰绿色最终变成红褐色4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)321、实验室制取氢氧化铝(铝盐溶液加氨水):Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4Al3+ + 3NH3•H2O = Al(OH)3↓ + 3NH4+22、氢氧化铝加热分解:2Al(OH)3△Al2O3 + 3H2O23、氢氧化铁加热分解:2Fe(OH)3△3H2O + Fe2O3(红棕色粉末,俗称铁红)24、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3白色沉淀迅速变成灰绿色,最终变成红褐色25、FeCl3溶液与铁粉反应:2FeCl3 + Fe = 3FeCl22Fe3+ + Fe = 3Fe2+26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-27、FeCl3溶液与铜反应:2FeCl3 + Cu = 2FeCl2+CuCl22Fe3+ + Cu = 2Fe2++Cu2+28、除去碳酸氢钠溶液中的碳酸钠,方法:通过量CO2Na2CO3 +CO2 + H2O = 2NaHCO3 CO32- + CO2 + H2O = 2HCO3-29、锂在空气中燃烧:4Li + O2△2Li2O30、金属钾与水的反应:2K + 2H2O = 2KOH + H2↑31、氟气与氢气在暗处就能剧烈化合:F2 + H2 = 2HF32、氟气与水的反应:2F2 + 2H2O = 4HF +O2↑33、卤素单质间的置换反应:氯水与饱和溴化钠溶液:Cl2 + 2NaBr = Br2 + 2NaCl氯水与饱和碘化钾溶液:Cl2 + 2KI = I2 + 2KCl溴水与饱和碘化钾溶液:Br2 + 2KI = I2 + 2KBr34、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2H2O催化剂加热 35、二氧化硅与氧化钙高温反应:SiO 2 + CaO 高温CaSiO 336、二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O37、硅酸钠与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H 2SiO 3↓38、氯气的实验室制法:MnO 2+4HCl (浓) △ MnCl 2+Cl 2↑+ 2H 2O 39、氯气与金属反应:2Fe + 3Cl 2点燃 2FeCl 3 (棕色烟) Cu + Cl 2 点燃CuCl 2 (棕黄色的烟) 2Na + Cl 2点燃 2NaCl (白烟) 40、氯气与氢气反应:H 2+Cl 2 △2HCl (苍白色火焰,有白雾生成)41、氯气与水反应:Cl 2 + H 2O = HCl + HClO次氯酸光照分解:2HClO HCl + O 2↑42、氯气与氢氧化钠溶液反应:Cl 2 + 2NaOH = NaCl + NaClO + H 2O43、氯气与消石灰反应制漂白粉:2Cl 2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O44、漂白粉长期置露在空气中:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO45、硫的燃烧 S +O 2 点燃 SO 246、二氧化硫与水反应:SO 2 + H 2O H 2SO 347、二氧化硫与氧气反应:2SO 2+O 22SO 3 48、SO 3与氧化钙反应:SO 3+CaO =CaSO 449、三氧化硫与水反应:SO 3 + H 2O = H 2SO 450、二氧化硫与Ca (OH )2溶液反应:SO 2 + Ca (OH )2 = CaSO 3 +H 2O51、氮气与氧气在放电下反应:N 2 + O 2 2NO52、一氧化氮与氧气反应:2NO + O 2 = 2NO 253、二氧化氮与水反应:3NO 2 + H 2O = 2HNO 3 + NO54、合成氨反应:N 2+3H 2 催化剂 高温高压2NH 3 氨水受热分解:NH 3•H 2O △ NH 3↑ + H 2O光照 放电55、氨水显碱性的原因: NH3 + H2O NH3•H2O NH4+ + OH—56、氨气与氯化氢反应:NH3 + HCl = NH4Cl氯化铵受热分解:NH4Cl △NH3↑ + HCl↑57、碳酸氢氨受热分解:NH4HCO3△NH3↑ + H2O↑ + CO2↑58、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2O59、氨的催化氧化:4NH3+5O2催化剂△4NO+6H2O60、氨气的实验室制取法:2NH4Cl + Ca(OH)2△CaCl2 + 2H2O + 2NH3↑61、浓硫酸与铜反应:Cu + 2H2SO4(浓) △4+ 2H2O + SO2↑62、浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2↑+ 2SO2↑ + 2H2O63、浓硝酸与铜反应:Cu + 4HNO3(浓) ===Cu(NO3)2 + 2H2O + 2NO2↑64、稀硝酸与铜反应:3Cu + 8HNO3(稀)=== 3Cu(NO3)2 + 4H2O + 2NO↑选考1、向碳酸钠溶液中逐滴滴加稀盐酸,现象:开始无现象,然后有气泡生成,溶液中碳酸根离子的物质的量的变化趋势:先增大再减小,发生反应的离子方程式:CO32- + H+ = HCO3- HCO3- + H+ = CO2↑+ H2O2、向AlCl3溶液中逐滴加入NaOH溶液至过量,现象是:有白色沉淀生成,白色沉淀先逐渐增多,后逐渐减少直至消失;有关离子方程式:Al3+ + 3OH-=== Al(OH)3↓Al(OH)3 + OH-=== AlO2- + 2H2O3、向NaAlO2溶液中逐滴滴加稀盐酸至过量,现象是:有白色沉淀生成,白色沉淀先逐渐增多,后逐渐减少直至消失;有关离子方程式:AlO2- + 2H2O + H+ === Al(OH)3↓Al(OH)3 + 3H+=== Al3+ + 3H2O 4、向明矾溶液中加入氨水,现象是:有白色沉淀生成,有关离子方程式是:Al3+ + 3NH3•H2O = Al(OH)3↓ + 3NH4+5、向含1mol明矾的溶液中加入含2mol Ba(OH)2的溶液,化学方程式是:KAl(SO4)2 + 2Ba(OH)2 = KAlO2 + 2BaSO4↓+ 2H2O。
高考化学元素化合物主要方程式汇总在高考化学中,我们需要了解的元素化合物主要方程式有很多。
以下是一些常见的元素化合物的主要方程式以及相关的知识点:1.水的电离方程式:H2O(l) ⇌ H+(aq) + OH-(aq)这个方程式描述了水在一定条件下发生电离产生氢离子(H+)和氢氧离子(OH-)。
水是一个中性物质,在纯净水中,H+和OH-的浓度相等,即pH=72.金属氧化物的氧化反应:2Mg(s)+O2(g)→2MgO(s)这个方程式描述了镁和氧气反应产生氧化镁(MgO)。
金属氧化物的氧化反应是金属与氧气反应的一种常见类型,产生金属氧化物。
3.金属与非金属的离子化反应:Na(s)+Cl2(g)→2NaCl(s)这个方程式描述了钠与氯气反应产生氯化钠。
电负性差异较大的金属与非金属反应时,金属会失去电子形成阳离子,非金属会获得电子形成阴离子,从而形成离子化合物。
4.碳酸及碳酸盐的反应:HCl(aq) + Na2CO3(aq) → 2NaCl(aq) + CO2(g) + H2O(l)这个方程式描述了盐酸和碳酸钠反应产生氯化钠、二氧化碳和水。
碳酸及碳酸盐的反应会产生二氧化碳气体,并引起溶液中的酸碱中和反应。
5.过氧化氢的分解反应:2H2O2(aq) → 2H2O(l) + O2(g)这个方程式描述了过氧化氢分解为水和氧气。
过氧化氢是一种强氧化剂,在分解反应中释放出氧气。
6.硫酸和金属的反应:H2SO4(aq) + 2Na(s) → Na2SO4(aq) + H2(g)这个方程式描述了硫酸和钠反应产生硫酸钠和氢气。
硫酸是一种强酸,能够与金属反应产生盐和氢气。
高中元素化合物部分知识网络及重要化学方程式1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Na和H2O的反应:2Na+2H2O===2Na++2OH-+H2↑②Na和CH3COOH的反应:2Na+2CH3COOH===2CH3COO-+2Na++H2↑③Na2O2和H2O的反应:2Na2O2+2H2O===4Na++4OH-+O2↑④Na2O2和CO2的反应:2Na2O2+2CO2=== 2Na2CO3+O2⑤NaH和水的反应:NaH+H2O===Na++OH-+H2↑⑥向NaOH溶液中通入过量CO2:OH-+CO2===HCO-3⑦向Na2CO3溶液中通入过量CO2:CO2-3+CO2+H2O===2HCO-3⑧将Na2CO3和Ca(HCO3)2混合:CO2-3+Ca2+===CaCO3↓⑨将NaHCO3溶液和NaOH溶液等物质的量混合:HCO-3+OH-===CO2-3+H2O⑩将NaHCO3溶液与澄清石灰水等物质的量混合:HCO-3+Ca2++OH-===CaCO3↓+H2O⑪将NaHCO3溶液与少量澄清石灰水混合:2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O⑫向饱和Na2CO3溶液中通入过量CO2气体2Na++CO2-3+CO2+H2O===2NaHCO3↓2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Al和NaOH溶液的反应:2Al+2OH-+2H2O===2AlO-2+3H2↑②Al(OH)3和NaOH溶液的反应:Al(OH)3+OH-===AlO-2+2H2O③Al(OH)3和盐酸的反应:Al(OH)3+3H+===Al3++3H2O④Al2O3和NaOH的反应:Al2O3+2OH-===2AlO-2+H2O⑤Al2O3和盐酸的反应:Al2O3+6H+===2Al3++3H2O⑥NaAlO2和少量盐酸的反应:AlO-2+H++H2O === Al(OH)3↓⑦NaAlO2和过量盐酸的反应:AlO-2+4H+===Al3++2H2O⑧向NaAlO2溶液中通入过量CO2气体:AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3⑨将NaAlO2与NaHCO3混合:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3⑩将NaAlO2与AlCl3溶液混合:3AlO-2+Al3++6H2O===4Al(OH)3↓⑪向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-===AlO-2+2H2O⑫向AlCl3溶液加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH+4⑬将AlCl3溶液与NaHCO3溶液混合:Al3++3HCO-3===Al(OH)3↓+3CO2↑3.铁及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
元素化合物常见方程式1、常温下钠与氧气反应: 4Na+O2=2Na2O2、钠在氧气中燃烧: 2Na+O2 = Na2O23、钠在氯气中燃烧: 2Na+Cl2=2NaCl4、钠和水反应: 2Na+2H2O=2NaOH+H2↑5、钠和盐酸反应: 2Na+2HCl=2NaCl+H2↑6、钠投入到硫酸铜溶液: 2Na+CuSO4 +2H2O =Cu(OH)2↓+Na2SO4+ H2↑7、表示钠露置空气中变化过程:Na----Na2O----NaOH----Na2CO3•10H2O---Na2CO38、氧化钠和水反应: Na2O+H2O=2NaOH9、过氧化钠和水反应: 2Na2O2+2H2O=4NaOH+O2↑10、氧化钠和CO2反应: Na2O+CO2=Na2CO311、过氧化钠和CO2反应: 2Na2O2+2CO2=2Na2CO3+O212、氧化钠和盐酸反应: Na2O+2HCl=2NaCl+H2O13、过氧化钠和盐酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑14、碳酸氢钠受热分解: 2NaHCO3=Na2CO3+H2O+CO2↑15、碳酸钠溶液和足量盐酸反应: Na2CO3+2HCl=NaCl+H2O+CO2↑16、碳酸氢钠和盐酸反应: NaHCO3+HCl=NaCl+H2O+CO2↑17、碳酸钠溶液和氢氧化钙溶液反应: Ca(OH)2+Na2CO3=CaCO3↓+2NaOH18、碳酸氢钠溶液和足量氢氧化钙溶液反应:Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O19、碳酸氢钠溶液和少量氢氧化钙溶液 Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O20、加热法鉴别固体碳酸钠和碳酸氢钠的反应原理:2NaHCO3=Na2CO3+H2O+CO221、沉淀法鉴别碳酸钠和碳酸氢钠:CaCl2+Na2CO3=CaCO3↓ +2NaCl22、稀盐酸滴加法鉴别碳酸钠和碳酸氢钠: CO32-+H+=HCO3- HCO3-+H+=H2O+CO2↑23、铝在氧气中受热: 4Al+3O2= 2Al2O324、铝和盐酸反应: 2Al+6HCl=2AlCl3+3H2↑25、铝和氢氧化钠溶液反应: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑26、氧化铝和盐酸反应: Al2O3+6HCl=2AlCl3+3H2O27、氧化铝和氢氧化钠反应: Al2O3+2NaOH=2NaAlO2+H2O28、氢氧化铝和盐酸反应: Al(OH)3+3HCl=AlCl3+3H2O29、氢氧化铝和氢氧化钠反应: Al(OH)3+NaOH=NaAlO2+2H2O30、氢氧化铝的制备:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl31、向氯化铝溶液中滴加氢氧化钠溶液至过量:Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O32、向氢氧化钠溶液中滴加氯化铝溶液至过量:Al3++4OH-=AlO2-+2H2O 3AlO2-+Al3++6H2O=4Al(OH)3↓33、向偏铝酸钠溶液中滴加盐酸至过量:AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O34、向盐酸中滴加偏铝酸钠溶液至过量:AlO2-+4H+=Al3++2H2O 3AlO2-+Al3++6H2O=4Al(OH)3↓35、铁在纯氧燃烧: 3Fe+2O2 = Fe3O436、铁在氯气中燃烧: 2Fe+3Cl2 = 2FeCl337、铁和硫粉共热: Fe+S = FeS38、铁和水蒸气高温下反应: 3Fe+4H2O = Fe3O4+4H239、铁和盐酸反应: Fe+2HCl=FeCl2+H2↑40、氧化铁和盐酸反应: Fe2O3+6HCl=2FeCl3+3H2O41、氧化亚铁和稀硝酸反应: 3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O42、四氧化三铁和盐酸反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O43、氢氧化亚铁和盐酸反应: Fe(OH)2+2HCl=FeCl2+2H2O45、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)346、硅在氧气中加热: Si+O2 = SiO247、硅和氟气反应: Si+2F2=SiF448、硅在氯气中高温反应: Si+2Cl2 = SiCl449、碳和二氧化硅高温反应: 2C+SiO2= Si+2CO↑50、硅和氢氟酸反应: Si+4HF=SiF4↑+2H2↑51、硅和氢氧化钠水溶液反应Si+2NaOH+H2O=Na2SiO3+2H2↑52、少量CO2通入NaOH溶液中: 2NaOH+CO2 = Na2CO3+H2O53、过量CO2通入NaOH溶液中: NaOH+CO2 = NaHCO354、SiO2和NaOH溶液反应: 2NaOH+SiO2 = Na2SiO3+H2O55、SiO2和纯碱共热: Na2CO3+SiO2= Na2SiO3+CO2↑56、CO2和Na2O反应: Na2O+CO2= Na2CO357、SiO2和Na2O反应: Na2O+SiO2=Na2SiO358、钠在氯气中燃烧: 2Na+Cl2= 2NaCl59、铜在氯气中燃烧: Cu+Cl2 = CuCl260、铁在氯气中燃烧: 2Fe+3Cl2 =2FeCl361、氢气在氯气中燃烧: H2+Cl2= 2HCl62、氯气和水的反应: Cl2+ H2O = HCl+HClO63、和氢氧化钠溶液的反应: Cl2 +2NaOH= NaCl+NaClO+H2O64、和碘化钾溶液反应: 2KI+Cl2 = I2+2KCl65、和氯化亚铁溶液的反应:2FeCl2 +Cl2= 2FeCl366、和Na2SO3溶液的反应:Na2SO3+Cl2+H2O = Na2SO4+2HCl67、氯气通入SO2水溶液: SO2+2H2O+Cl2=H2SO4+2HCl68、氯水中所存在的化学反应: Cl2+ H2O = HCl+HClO 2HClO = 2HCl+O2↑69、漂白液的制取原理: 2NaOH+Cl2= NaCl+NaClO+H2O70、漂白粉的制取原理: 2Ca(OH)2+2Cl2= CaCl2+Ca(ClO)2+2H2O71、漂白粉漂白原理: Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO72、漂白粉在长时间放置过程中发生的变化:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2HClO= 2HCl+O2↑73、氢气和硫粉共热: H2+S = H2S74、铁粉和硫粉共热: Fe+S = FeS75、铜粉和硫粉共热: 2Cu+S = Cu2S 76、硫在氧气中燃烧: S+O2 = SO277、硫和氢氧化钠溶液共热: 3S+6NaOH=2Na2S+Na2SO3+3H2O78、SO2和水反应: SO2+H2O=H2SO379、SO2和氧化钠反应: Na2O+SO2=Na2SO380、少量SO2通入NaOH溶液: 2NaOH+SO2=Na2SO3+H2O81、过量SO2通入NaOH溶液:NaOH+SO2=NaHSO382、SO2通入Na2CO3溶液: Na2CO3+SO2=Na2SO3+CO283、SO2的催化氧化: 2SO2+O22SO384、H2S通入SO2水溶液: 2H2S+SO2=3S↓+2H2O85、过量SO2通入澄清石灰水:Ca(OH)2+2SO2=Ca(HSO3)286、SO3和水反应: SO3+H2O=H2SO487、SO3和CaO反应: CaO+SO3= CaSO488、SO3和NaOH溶液反应: 2NaOH+SO3=Na2SO4+H2O89、铜和浓硫酸共热: Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O90、碳粉和浓硫酸共热: C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O91、S粉和浓硫酸共热: S+2H2SO4(浓)=3SO2+2H2O92、氮气与氧气的反应: N2+O2= 2NO93、氮气与金属镁的反应: 3Mg+N2 = Mg3N294、氮化镁和水反应: Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑95、NO的氧化: 2NO+O2=2NO296、二氧化氮和水反应: 3NO2+H2O=2HNO3+NO97、二氧化氮、氧气和水的反应:4NO2+O2+2H2O=4HNO398、一氧化氮、氧气和水的反应4NO+3O2+2H2O=4HNO399、氨气和水反应: NH3+H2O NH3•H2O100、氨气和盐酸反应: NH3+HCl=NH4Cl101、向AlCl3溶液中通入氨气: AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl102、氨气的催化氧化: 4NH3+5O2= 4NO+6H2O103、实验室制取氨气: 2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑104、工业合成氨: N2+3H22NH3105、氯化铵受热分解: NH4Cl=NH3+HCl106、碳酸氢铵受热分解: NH4HCO3=NH3↑+H2O↑+CO2↑107、硝酸不稳定性: 4HNO3 = 2H2O+4NO2↑+O2↑136、铜和浓硝酸反应; Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O108、铜和稀硝酸反应: 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O109、碳和浓硝酸反应:C+4HNO3(浓) = CO2↑+4NO2↑+2H2O110、氧化亚铁和稀硝酸反应: 3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O111、少量铁和稀硝酸反应: Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O112、过量铁和稀硝酸反应: 3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O。
高中化学元素及化合物所有化学方程式非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+O3(浓)===4H3PO4+2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)三, 非金属氢化物(HF,HCl,H2O,H2S,NH3) 1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O 2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四,非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五,金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O六,含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七,碱低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八,盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。
高一化学方程式一、碱金属:1. 新切的钠有银白色光泽,但很快发暗;方程式:4Na+O2=2Na2O;该产物不稳定。
钠在空气中燃烧时,发出黄色的火焰;同时生成淡黄色的固体,方程式:2Na+O2==== Na2O2。
锂燃烧方程式:4Li+O2==== 2Li2O;钾燃烧方程式:K+O2==== KO2。
2.钠与氧气在不点火时平稳反应,硫的化学性质不如氧气活泼,将钠粒与硫粉混合时爆炸,方程式:2Na+S=Na2S3. 钠与水剧烈反应后滴有酚酞的水变成红色,方程式:2Na+2H2O=2NaOH+H2↑;钾与水反应更剧烈,甚至爆炸,为了安全,常在小烧杯上盖一块小玻璃片。
4. 过氧化钠粉末用脱脂棉包住,①滴几滴水,脱脂棉燃烧;方程式:2Na2O2+2H2O=4NaOH+O2↑;②用玻璃管吹气,脱脂棉也燃烧;相关的方程式:2Na2O2+2CO2=2Na2CO3+O2↑;这两个反应都是放热反应,使脱脂棉达到着火点。
在过氧化钠与水或CO2反应生成O2的两个反应中,为生成1mol O2,需要的Na2O2的物质的量都为2mol,同时需要的H2O或CO2的物质的量都为2mol。
5. 纯碱的化学式是Na2CO3,它不带结晶水,又俗名苏打。
碳酸钠晶体化学式是Na2CO3·10H2O,在空气中不稳定,容易失去结晶水,风化,最后的产物是粉末状,叫无水碳酸钠。
钠、氧化钠、过氧化钠、氢氧化钠等在空气中露置的最后产物都是无水碳酸钠。
6. 碳酸钠和碳酸氢钠两种固体物质都能够与盐酸反应放出气体,相关离子方程式分别为:CO32-+2H+=H2O+CO2↑;HCO3-+H+=H2O+CO2↑;其中,以碳酸氢钠与盐酸的反应速度更快.7. 碳酸钠和碳酸氢钠的热稳定性较差的是碳酸氢钠,其加热时发生分解,方程式是:2NaHCO3=Na2CO3+H2O+CO2↑。
在这个分解反应中,一种物质生成了三种物质,(1)高锰酸钾分解:2KMnO4==== K2MnO4+MnO2+O2↑(2)碳酸铵或碳酸氢铵分解:(NH4)2CO3==== 2NH3↑+H2O+CO2↑8. 除去碳酸钠固体中的少量NaHCO3的方法是加热;除去碳酸氢钠溶液中混有的少量Na2CO3溶液的方法是:通入足量CO2气体:Na2CO3+CO2+H2O=2NaHCO3。
高中化学元素及其化合物方程式高中化学是化学课程的一部分,涵盖了基本的化学知识、化学实验技能和实践能力。
其中,学习元素和化合物方程式是非常重要的一部分。
在接下来的内容中,我们将介绍一些高中化学中常见的元素及其化合物方程式。
氧(O)是自然界中最常见的元素之一、常见的氧化合物有氧化铁、二氧化硅、二氧化碳等。
氧化铁(Fe2O3)是一种常见的氧化物,它可由铁与氧气反应得到:4Fe+3O2→2Fe2O3氢(H)是宇宙中最丰富的元素之一,常见的氢化合物有水、氨气等。
水(H2O)是一种普遍存在的化合物,它由氢气与氧气反应得到:2H2+O2→2H2O氯(Cl)是一种常见的卤素元素,它与其他元素反应形成的化合物具有较强的氧化性。
氯气(Cl2)与氢气反应会形成氢氯酸(HCl):H2+Cl2→2HCl碳(C)是生命的基本元素之一,它与氧气反应会形成二氧化碳(CO2),这是一种广泛存在于自然界中的气体:C+O2→CO2氮(N)是大气中最主要的组成元素之一,它与氢气反应可以形成氨气(NH3):N2+3H2→2NH3硫(S)是一种常见的非金属元素,它与氧气反应会形成二氧化硫(SO2):2S+O2→2SO2铁(Fe)是地壳中最常见的金属元素之一,它与硫反应会形成硫化铁(FeS):Fe+S→FeS铜(Cu)是一种常见的金属元素,在空气中会与氧气反应生成氧化铜(CuO):2Cu+O2→2CuO氧化镁(MgO)是一种常见的金属氧化物,它由镁与氧气反应得到:2Mg+O2→2MgO这只是一小部分常见的元素及其化合物方程式。
在高中化学课程中,学生将会学习更多的元素以及它们之间的反应方程式,以便更好地理解化学原理和实验技能。
希望这篇文章对您的学习有所帮助!。
八、硫及其化合物
1. (1)硫与铁反应:Fe+S FeS (2)硫与铜反应: 2Cu+S Cu 2S (3)硫与钠反应: 2Na+S==Na2S(爆炸)(4)硫与汞反应:Hg+S==HgS
2.硫与氢气反应: S+H2H2S
3.硫在空气中燃烧:S+O2SO2
4.硫与浓硫酸反应:2H2SO4(浓)+S3SO2↑+2H2O
5.硫与浓硝酸反应:S+6HNO3(浓)H2SO4+6NO2↑+2H2O
6.硫与热的NaOH溶液反应:3S+6NaOH2Na2S+Na2SO3+3H2O
8.氢硫酸与NaOH溶液反应:
(1)NaOH溶液少量H2S+NaOH==NaHS+H2O
(2)NaOH溶液过量H2S+2NaOH==Na2S+2H2O
9.氢硫酸与硫酸铜溶液反应:H2S+CuSO4==CuS↓+H2SO4
10.氢硫酸与酸性KMnO4溶液反应:
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S↓+8H2O
11.氢硫酸与FeCl3溶液反应:2FeCl3+H2S=2FCl2+2HCl+S↓
12.氢硫酸与氯水反应:H2S+Cl2===S↓+2H Cl
13.实验室制备氢硫酸:FeS+H2SO4===FeSO4+H2S↑
14.硫化氢在空气中燃烧:
2H2S+3O2(足量)2SO2+2H2O
2H2S+O2(少量)2S+2H2O
15. SO2作为酸性氧化物
(1)与水反应:SO2+H2O H2SO3
(2)向澄清石灰水溶液中通入SO2:
催化剂 ①SO 2少量SO 2+Ca(OH)2===CaSO 3↓+H 2O
②SO 2过量2SO 2(过量)+Ca(OH)2==Ca(HSO 3)2
(3)与CaO 反应:SO 2+CaO==CaSO 3
(4)与NaHCO 3溶液反应:SO 2+NaHCO 3==NaHSO 3+CO 2
16. SO 2的强还原性
(1)与酸性KMnO 4溶液反应:
5SO 2+2KMnO 4+2H 2O=2MnSO 4+2H 2SO 4+K 2SO 4
(2)与氯水、溴水、碘水反应:
SO 2+X 2+2H 2O===H 2SO 4+2HX (X 表示Cl,Br,I)
(3)与FeCl 3溶液反应:SO 2+2FeCl 3+2H 2O=2HCl+2FeCl 2 +H 2SO 4
(4)与双氧水应: SO 2+H 2O 2===H 2SO 4
(5)与氧气反应:2SO 2 + O 2 2SO 3
17.向氢硫酸中通入SO 2:2H 2S+SO 2===3S↓+2H 2O
18.向硝酸酸化的BaCl 2溶液中通入SO 2:
3SO 2+3BaCl 2+2HNO 3+2H 2O===3BaSO 4↓+2NO+6HCl
19.实验室制备SO 2:H 2SO 4(浓)+Na 2SO 3===NaSO 4+SO 2↑+H 2O
20.硫酸型酸雨的形成:
SO 2+H 2O H 2SO 3 、2H 2SO 3+O 2===2H 2SO 4
21.向Na 2SO 3溶液中滴加稀盐酸溶液:
Na 2SO 3+HCl (少量)===NaCl+NaHSO 3
Na 2SO 3+2HCl (过量)===2NaCl+SO 2↑+H 2O
22. 向Na 2SO 3溶液中滴加FeCl 3溶液:
23. 向Na 2SO 3溶液中滴加酸性KMnO 4溶液:
26.向氢碘酸中滴加浓硫酸:H2SO4(浓)+2HI===SO2↑+I2+2H2O
27.铜与浓硫酸反应:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O
28.铁与浓硫酸加热下反应:
6H 2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2O
29.木炭与浓硫酸反应:2H2SO4(浓)+C CO2↑+2SO2↑+2H2O
30.实验室制HCl:H2SO4(浓)+2NaCl Na2SO4+2HCl↑
31.实验室制HI:H3PO4(浓)+NaI NaH2PO4+HI↑
(不挥发性酸制取挥发性酸,磷酸是非氧化性酸)
31.SOCl2
32.S OCl2与NaOH
33.向Na2S2O3溶液中滴加稀硫酸:
34.向碘水中滴加Na2S2O3
35.向双氧水中滴加酸性KMnO4溶液:
36.向FeSO4溶液中滴加双氧水:
37.双氧水与Ba(OH)2溶液反应生成正盐的反应:。