初三化学竞赛常见推断题题型
- 格式:doc
- 大小:536.50 KB
- 文档页数:8

一、化学推断题1.构建知识网络是一种重要的学习方法。
如图是初中化学常见的单质、氧化物、酸、碱、盐五种不同类别的物质与CO2的知识网络图,“一”表示相连的两种物质能发生化学反应,“→”表示一种物质一步转化成另一种物质(部分反应条件未标出)。
请回答:(1)A的化学式是_____,E的化学式是_____;(2)C﹣D的化学方程式是_____。
2.已知A、B、C、D、E是初中化学中常见的五种物质,均含有同一种元素。
其中,只有A为单质,B和C含有的元素完全相同,D与其它四种物质属于不同的类别,E是一种重要建筑材料的主要成分,它们在一定条件下的转化关系如图所示(反应条件和部分反应物、生成物己省略),请回答:(1)D的化学式为__________________(2)请写出下列反应的化学方程式A→C:_______________________;B→E: __________________在日常生活中,对可能有物质C生成的情况,我们应怎样处理_______。
(3)请写出由A元素形成的两种单质的名称________。
A的单质之间组成元素虽然相同,但性质、用途却有着明显的差异,其原因是________。
由此,你对物质的结构、性质、用途之间的关系有什么认识_________。
A的单质用途非常广泛,请举出一例____。
3.如下图所示,A-G是初中化学常见的其中物质。
图中“”表示转化关系,“”表示相互能反应。
F可以用于改良酸性土壤,D、E组成元素相同,B、C、G常温下为气体,在实验室中常用A制取G。
(1)F的化学式是;物质A的一种用途是。
(2)D C反应的化学方程式是。
(3)F G反应的化学方程式是。
(4)图中涉及B物质的反应中,未出现的基本反应类型是。
4.结合下列所示实验,回答有关问题。
(1)有氨味的气体是;(2)经检验,无色溶液C中含有NaCl,则可推测出 X溶液为溶液;(3)进一步测定可知,无色溶液 C的 pH >7,向其中加入适量的Na2SO4溶液,无现象,写出色溶液 C中所含溶质的有可能情况。

初三化学物质推断题专题训练一、叙述式推断题1. 有一包白色粉末,可能由硫酸钠、碳酸钠、硫酸铜、氯化钡、硝酸钡、硝酸钾中的几种物质组成。
做下列实验,观察到的现象是:(1)将此固体粉末加入足量水中,得到白色沉淀,上层清液无色。
(2)向(1)中加入足量稀硝酸,沉淀部分溶解,并产生无色气体。
AgNO溶液,又有白色沉淀生成。
(3)滤出(2)中的沉淀,向滤液中滴加3根据以上现象推断:该粉末中一定含有,一定不含有,可能含有。
2. 某实验室的废液中,可能含有氯化铁、硫酸、硫酸钠、氯化钠、氢氧化钠,碳酸钠和硝酸钡中的一种或多种。
初三化学课外活动小组的同学对废液进行了如下实验:(1)取废液观察,为无色溶液;(2)取少量废液,向其中滴加氯化钡溶液,有白色沉淀产生,继续加入稀硝酸,无明显现象;(3)另取少量废液,向其中加入铁粉后,产生大量气泡。
根据以上实验现象可推断:废液中肯定含有,肯定不含有,不能确定是否含有。
三、连线式推断题5、已知A、B、C、D、E、F为常见物质,其中A、B质。
它们相互转化的关系如右图所示(图中反应条件略去)。
(1)X在反应①中起作用。
(2)写出有关物质的化学式:A 、C 。
(3)若F不溶于稀硫酸,写出反应③的化学方程式,该反应的基本类型是__________。
与D具有相同化学性质,并能与E发生反应,且反应基本类型与③相同的物质有。
6.下图中的A、B、C、D、E、F分别表示石灰水、硫酸铜溶液、碳酸钠溶液、氯化钡溶液、盐酸和金属铁,它们之间的连线表明相邻的两种物质之间能发生反应。
试根据图中关系确定A、B、C、D、E、F各物质的化学式。
四、框图式推断题7、市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体A(化学式为2Na2CO3·3H202)和灰黑色固体B(不溶于水)与水混合反应制得氧气,某同学对A、B两种物质进行探究,实验步骤及现象如下图所示:另做实验发现,B在①、③反应前后质量均不变,且可重复使用。

中考化学物质推测题1.已知X 是有毒且不溶于水的气体,Y 是不支持焚烧的气体,Z 是不溶于水的固体,X、 Y、 Z 之间有以下转变关系。
请回答以下问题。
(1)写出 X 的化学式 ___________________________________________ ;(2)写出 Z 和稀盐酸反响生成 Y 的化学方程式: ___________________________(3)“物质的构成与构造决定物质的性质”是重要的化学思想。
气体X、Y 都含有 ________元素和 ________元素,但它们的物理性质、化学性质都不一样。
请举出X、Y 性质不一样的一个例子 ________________________________ 。
2.现有 A~ F 六种常有物质,此中 B 是食品包装中的常用的干燥剂, A、 B、C 三种白色固体都含有同种金属元素, E 是固体单质, D、E、F 都含有同种非金属元素,它们的转变关系以以下图。
请回答:EAC DB F( 1)写出以下物质的化学式:C_____________ B_____________ E_______________。
( 2)写出以下变化的化学方程式:A C:___________________________________________;F D:_______ __________________________________。
3.以下图中物质是你在初中化学中见过的物质。
除①外,其余反响的条件均已略去。
⑴写出反响①的化学方程式________________________ 。
⑵假如 E 为单质或许氧化物, D 都是同种物质,则 D 的化学式为 ______;假如 E为单质或许酸, D 都是同种物质,则D的化学式为 ____________ ;假如 E为单质或许酸, F 都是同种物质,则 F 的化学式为 ____________ 。
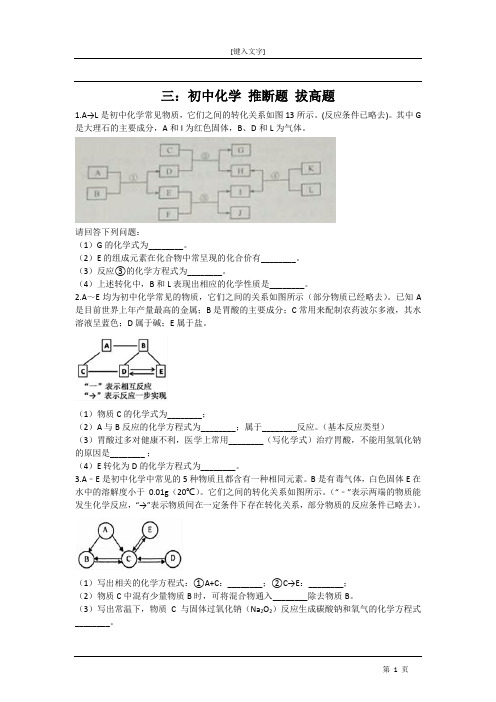
三:初中化学推断题拔高题1.A→L是初中化学常见物质,它们之间的转化关系如图13所示。
(反应条件已略去)。
其中G 是大理石的主要成分,A和I为红色固体,B、D和L为气体。
请回答下列问题:(1)G的化学式为________。
(2)E的组成元素在化合物中常呈现的化合价有________。
(3)反应③的化学方程式为________。
(4)上述转化中,B和L表现出相应的化学性质是________。
2.A~E均为初中化学常见的物质,它们之间的关系如图所示(部分物质已经略去)。
已知A 是目前世界上年产量最高的金属;B是胃酸的主要成分;C常用来配制农药波尔多液,其水溶液呈蓝色;D属于碱;E属于盐。
(1)物质C的化学式为________;(2)A与B反应的化学方程式为________;属于________反应。
(基本反应类型)(3)胃酸过多对健康不利,医学上常用________(写化学式)治疗胃酸,不能用氢氧化钠的原因是________ ;(4)E转化为D的化学方程式为________。
3.A﹣E是初中化学中常见的5种物质且都含有一种相同元素。
B是有毒气体,白色固体E在水中的溶解度小于0.01g(20℃)。
它们之间的转化关系如图所示。
(“﹣”表示两端的物质能发生化学反应,“→”表示物质间在一定条件下存在转化关系,部分物质的反应条件已略去)。
(1)写出相关的化学方程式:①A+C:________;②C→E:________;(2)物质C中混有少量物质B时,可将混合物通入________除去物质B。
(3)写出常温下,物质C与固体过氧化钠(Na2O2)反应生成碳酸钠和氧气的化学方程式________。
4.A~D是初中化学常见的四种物质,A、B、C为氧化物,D为单质,B、D中含有地壳中含量第二的金属元素,它们的关系如图所示,“→"表示一种物质可转化为另一种物质。
请回答:(1)写出C的一种用途________。

初三化学经典推断题很高兴你对初三化学感兴趣!初三化学经典推断题主要涉及基本的化学知识和推理能力。
以下是一些可能出现的经典推断题,希望能帮助你加深对化学知识的理解:1、已知物质A是一种晶体,具有良好的导电性质,能与酸反应产生氢气,它的化学式可能是什么?答案:物质A可能是金属,因为金属通常是良好的导电体,而且能与酸反应产生氢气。
2、某实验室使用稀硫酸与金属反应,观察到氢气气泡产生。
试判断反应中金属的活动性。
答案:由于金属与稀硫酸反应产生氢气,说明金属的活动性较稀硫酸高,它属于较活泼的金属。
3、某气体X在常温常压下不能燃烧,不能支持燃烧,同时它还能使一枚悬挂的燃烧木条熄灭。
请推断气体X的身份。
答案:气体X可能是二氧化碳(CO2)。
二氧化碳是一种无色无味的气体,在常温常压下不能燃烧,也不能支持燃烧。
同时,它能使燃烧中的木条熄灭,因为二氧化碳能抑制燃烧。
4、某种碱性氧化物能与某种酸反应,产生盐和水。
推断该碱性氧化物的化学式。
答案:碱性氧化物的化学式可能是NaOH。
它是氢氧化钠,与酸反应产生盐和水的反应通常被称为中和反应。
5、下面是某个元素的电子排布:1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰。
请推断该元素的原子序数和元素符号。
答案:该元素的原子序数是30,元素符号是Zn(锌)。
这个电子排布符合锌的电子排布。
这些问题是初三化学经典推断题的一些例子。
在学习化学的过程中,理解化学原理和反应特性十分重要。
练习这样的推断题可以帮助你巩固所学的知识,提高解决化学问题的能力。
如果有更多问题,欢迎继续咨询!。

九年级上册化学推断题专题及答案
九年级上册化学推断题专题及答案
一、推断题
1、当遇到某一物质X及其特定的溶液时,应该进行什么样的操作来进
行试验?
答:可以用适当的实验设备,将物质X溶解于特定溶液中,观察溶解
度是否变化,并并测量其浓度变化或溶解度变化。
2、当遇到一种新物质需要进行持续检测时,建议采用什么方法?
答:建议采用一种叫做滴定分析技术的方法,可以检测一种新物质的
浓度变化,以及溶解度的变化情况。
3、化学反应中,当反应物的相对分子质量不同时,反应速率如何改变?
答:总的来说,当反应物的相对分子质量不同时,反应速率会变得更快,但是它仍然受到反应物浓度等外部因素的影响。
二、实验推断题
1、向氯气溶液中加入NaOH溶液,会发生什么反应?
答:当NaOH溶液和氯气溶液混合时,会发生氧化-还原反应,即氧化氯气,溶液中产生氢氧化钠,氯气溶液由浓变得更稀。
2、将固体铁丝放入液态甲醛中,会发生什么化学反应?
答:当铁丝进入甲醛溶液中时,会发生氧化还原反应,金属铁会被甲醛中氧化成铁醚,即铁(III)氧化物。
3、将漂白粉与水混合,会发生什么化学反应?
答:当漂白粉和水混合时,水中溶液会受到Oxidation-Activation(氧化还原反应),漂白粉中含有氯气,水中氯气会产生氧化还原反应。
初中化学竞赛辅导材料第十一讲 物质推断题1.A 、B 、C 、D 、E 、F 是初中化学中常见的六种物质,其中:A 、B 是单质,C 、D 、E 、F 均为两种元素组成的化合物。
常温下,A 为固体,B 、C 、D 、E 为气体,F 是液体,它们之间如下关系:A+B →C 、C+A →D 、E+B →C+F 。
据此写出它们的化学式:B 、C 、D 、E 、F 。
2.有一包白色粉末,可能由氯化银、氯化钡、碳酸钠、氯化钠中某几种组成。
为了鉴定其成分实验如下:⑴将少量粉末放入足量水中,搅拌,静置,过滤,得白色沉淀及无色滤液。
⑵向所得沉淀中加入足量稀硝酸,沉淀全部溶解,并有气体产生⑶向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,沉淀不溶解。
试根据以上现象推断该白色粉末中一定含有 ,一定没有 可能含有 。
(写化学式)3.一包白色粉末中可能含有无水硫酸铜、氯化钠、氯化钾、硫酸钠和碳酸钾中的一种或几种。
对其实验如下:将白色粉末放入足量水中,得无色溶液;⑴向所得溶液中加入氯化钡溶液,有白色沉淀生成;⑵向白色沉淀中加入足量稀硝酸,一部分沉淀溶解,并生成使澄清石灰水变浑浊的气体。
试根据以上实验判断该白色粉末中一定有 ,可能有 ,肯定没有 4.有A 、B 、C 、D 、E 五瓶失去标签的溶液,其中的溶质可能是Na 2CO 3、BaCl 2、Ca (NO 3)2、稀H 2SO 4、AgNO 3中的某一种。
现将瓶内溶液各取少许,进行部分两两混合的实验,实验结果见下表(表中“↑ ”表示有气体产生,“↓ ”表示有沉淀生成,“—”表示无明显现象或微溶化合物生成,空格表示实验没有做),根据实验结果写出各瓶溶液中溶质的化学式:A ,B ,C ,D ,E 。
5.有5 瓶失去标签的无色溶液,只知它们是硝酸钾、碳酸钠、硝酸银、硝酸钙和盐酸,将其任意编号为A 、B 、C 、D 、E ,并进行实验,其现象如下表:实验A+B A+E B+C B+E 现象 产生沉淀 产生沉淀 产生沉淀 产生气体 A  ̄ B ↓C  ̄  ̄ ↑D  ̄ ↓ ↓ ↓ E⑴试推断并写出五种溶液中溶质的化学式:A ,B ,C ,D ,E 。
初三化学物质推断题专题训练一、叙述式推断题1.有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、硫酸钠和硝酸钾中的某几种组成。
为了鉴定其成分,实验如下:(1)将少量粉末放入足量水中,搅拌、静置、过滤、得白色沉淀和无色滤液。
(2)向所得沉淀中加入足量稀硝酸,沉淀全部溶解,但无气体产生。
(3)向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,沉淀不溶解。
试根据以上现象推断该白色粉末中一定含有;一定没有;可能含有。
(填化学式)2.有一包粉末可能含有碳酸钙、碳酸钠、硫酸钠、硫酸铜、硝酸钠中的一种或几种,某学生为了确定其组成,做如下实验,请根据实验现象进行推断,把相应的物质的化学式填在表中的空格内。
3.某化工场排放的污水中,常溶有某些对人体有害的物质。
通过目测,初步认为可能含有Fe3+、Ba2+、Na+、OH-、CI-、CO32-、SO42-;为了进一步确认,进行实验检测(1)取污水仔细观察,呈无色、透明、均一状态。
(2)向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(3)用pH试纸测定污水的pH值,试纸显深蓝色。
由此可知,该污水中,肯定含有离子是。
肯定没有的离子是,可能含有的离子是。
(4)某学校化学课外活动小组,将一些可溶性化合物溶于水,配制成的甲、乙两溶液中,共含有H+、Ag+、K+、Ba2+、OH-、CI-、NO3-、CO32-8种离子,两种溶液里所含离子各不相同,已知向甲溶液里滴入石蕊试液,石蕊试液变成蓝色,则乙溶液里含有的4种离子应该是。
5.现有以下三组物质:(1)Fe(过量)、Cu(OH)2、H2SO4(2)Zn、AgNO3(过量)、Cu (3)Fe(过量)、Cu(NO3)2、AgNO3在各种物质里加水搅拌,待充分反应后,过滤,滤纸上有一种金属的是;有两种金属的是;有三种金属的是;(填序号)二、表格式推断题6.有失去标签的硝酸钾、碳酸钠、硝酸银、硝酸钙和稀盐酸五瓶溶液。
初中化学竞赛题流程图推断题(附加题)由于题中没有给出未溶解的10g固体是什么,所以我们需要分类讨论①如果KCl已经全部溶解,则10g全都是二氧化锰,那么原混合物中氯酸钾的质量就是15g,我们需要知道KCl生成的质量是多少,那么根据化学方程式计算可得KCl的质量为9.12g,再根据KCl的质量计算,那么开始加入12g水的时候溶解的KCl质量就是9.12-2=7.12g然后计算溶解度7.12g/12g×100%=59.3g大于表格中100℃的溶解度,所以明显不可能比水沸腾的温度还要高的情况下实验;所以就可以排除这种剩余固体全是二氧化锰的情况;②剩余固体是KCl和二氧化锰的混合物那么后来加入5g水,溶解了2g的KCl可以得出KCl的溶解度为40g,观察表格可以发现这也就是40℃以内的温度,所以算是符合实际情况那么刚开始的12g水中溶解的KCl质量可以计算出来4.8g则所有生成的KCl的质量为6.8g通过化学方程式计算可得氯酸钾的质量为20.9g所以最终只有这种情况是符合实际的;初中化学竞赛:流程图推断题X和白色沉淀I、II都是含有镁元素的化合物,Z是一种能使地球产生“温室效应”的气体,A是一种碱。
它们的有关变化如下图所示(微溶物以沉淀形式出现):(1)写出下列物质的化学式:A_________,B__________;白色沉淀I是____________,Z是______________;(2)X和C反应的化学方程式是_________________________;推断题一直都是初中化学当中比较难的部分,这道题是07年初中化学竞赛的一道题目,有同学可能看到竞赛题就以为特别难,其实只要基础学的扎实,竞赛题也就比大家平时做的基础题难上一些而已,更何况平时不也经常遇到一些难题吗?好,这道题的题干给出了三个信息,1、含有镁元素的化合物三种,而且有两个还是沉淀,首先含镁元素的沉淀很容易想到:Mg(OH)2、MgCO3;2、Z是制造温室效应的气体,那就是CO2了;3、A是一种碱,根据流程图,A和X反应后生成了沉淀,也就是说含镁元素的化合物和一种碱生成了含镁元素的化合物沉淀,那么就可以敲定沉淀I是Mg(OH)2了;生成Mg(OH)2的同时,还有NaCl生成,有Na元素和Cl元素,所以A 肯定是NaOH,而反应物中的X则含有Mg元素和Cl元素,所以为MgCl2;那么白色沉淀I和B反应后又生成了MgCl2,那么可以判断出B为HCl,那么Y就是H2O了,根据白色沉淀II与B反应生成X、Y、Z三种物质,所以很明显就是碳酸盐和盐酸发生的反应,那么不难猜出沉淀II为MgCO3,X与C反应生成MgCO3和NaCl,所以C就是Na2CO3;到这里所有的物质就全部敲定了,所以可以填空了;(1)A是NaOH,B是HCl,白色沉淀I是Mg(OH)2,Z是CO2;(2)X和C反应的化学方程式,也就是[氯化镁]和[碳酸钠]的反应方程式,相信学过的同学都知道,MgCl2+Na2CO3=Mg CO3+2NaCl;(1)根据反应前后质量总量的变化可知氧气为0.4g;通过化学方程式计算出参与反应的过氧化氢的质量,然后计算出双氧水溶液的溶质质量分数即可;(2)小林在锥形瓶上方加上了干燥剂,目的是为了防止氧气在跑出锥形瓶的时候带走部分水蒸气,从而影响结果的测量;(3)认真分析第(2)会发现,小林只是在锥形瓶上方加了干燥剂,但是实验装置没有变,也就是说还是用的天平,而总质量前后变化为0.4g,天平的精确度为0.1g,任你再牛逼你也没法更精确的去读数,所以对于氧气0.4g来说,这个精确度不行;通过计算0.4g的氧气体积为接近300mL,所以要用大点的量筒,那就用500mL的;。
元素及化合物练习之推断题1.将易溶于水的钠盐A与浓硫酸混合后微热得无色气体B。
将B通入酸性高锰酸钾溶液后有气体C生成。
将C通入另一钠盐的D的水溶液中则溶液变黄、变橙,最后变为棕色,说明有E生成,向E中加入氢氧化钠溶液得无色溶液F,当酸化该溶液时又有E出现。
请给出A,B,C,D,E,F的化学式。
2.将无色钠盐溶于水得无色溶液A,用pH试纸检验知A显酸性。
向A中滴加KMnO4溶液,则紫红色褪去,说明A被氧化为B,向B中加入BaCl2溶液得不溶于强酸的白色沉淀C。
向A中加入稀盐酸有无色气体D放出,将D通入KMnO4溶液则又得到无色的B。
向含有淀粉的KIO3溶液中滴加少许A则溶液立即变蓝,说明有E生成,A过量时蓝色消失得无色溶液F。
给出A,B,C,D,E,F的分子式或离子式。
3.向白色固体钾盐A中加入酸B有紫黑色固体C和无色气体D生成,C微溶于水,但易溶于A的溶液中得棕黄色溶液E,向E中加入NaOH溶液得无色溶液F。
将气体D 通入Pb(NO3)2溶液得黑色沉淀G。
若将D通入NaHSO3溶液则有乳白色沉淀H析出。
回答A,B,C,D,E,F,G,H各为何物质。
写出有关反应的方程。
4.向无色溶液A中加入HI溶液有无色气体B和黄色沉淀C生成,C在KCN溶液中部分溶液变成无色溶液D,向D中通入H2S时析出黑色沉淀E,E不溶于浓盐酸。
若向A中加入KI溶液有黄色沉淀F生成,将F投入KCN溶液则F全部溶解。
请给出A,B,C,D,E,F所代表的物质。
5.化合物A为白色固体,A在水中溶解度较小,但易溶于氢氧化钠溶液和浓盐酸。
A溶于浓盐酸得溶液B,向B中通人H2S得黄色沉淀C,C不溶于盐酸,易溶于氢氧化钠溶液。
C溶于硫化钠溶液得无色溶液D,若将C溶于Na2S2溶液则得无色溶液E。
向B中滴加溴水,则溴被还原,而B转为无色溶液F,向所得F的酸性溶液中加入淀粉碘化钾溶液,则溶液变蓝,给出A、B、C、D、E、F所代表的物质。
6.氯化物A为无色液体。
初三化学竞赛常见推断题题型1.右图是常见酸、碱、盐之间的相互转化关系。
(1) 写出图中相应物质的化学式:酸、碱。
(2)写出图中反应②和④的化学方程式:②④(3)总结化学反应的规律是我们学习化学的方法之一。
请根据上图总结出酸、碱、盐相互反应的规律(写2点) 、。
2. A~H都是初中化学中的常见物质,它们之间的转化关系如图14所示。
A是天然气的主要成分,E是一种常见的食品干燥剂。
请回答:(1)A的化学式为;(2)反应③的基本反应类型是;(3)反应②的化学方程式为;反应④的化学方程式为。
3.构建知识网络是一种重要的学习方法。
下图是关于盐酸化学性质的知识网络,“——”表示相连的两种物质能发生反应,“”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。
完善这个知识网络:(1) 写出A、B、C的化学式:A ;B ;C 。
(2) 根据自己得出的知识网络写出一个复分解反应化学方程式:4.已知,A、B、C、D四种物质之间存在以下转化关系。
其中C是单质,D是相对分子质量最小的氧化物。
试回答(1)写出A、C、D三种物质的化学式:A________、C_________、HClZnBA CD_________。
浅绿色溶液B中溶质的化学式_______________。
(2)写出C→D的化学方程式_________________________________。
5.今年年初,我国南方出现了大面积的冰雪灾害,在除雪过程中,融雪剂发挥了很大的作用。
某公司生产的融雪剂是由氯化钠、硝酸钠、氯化镁、硫酸铜中的两种或两种以上的物质组成的。
小佳同学为探究其成分,设计并完成了以下实验:请你根据以上设计过程,完成下列空白:(1)该融雪剂中一定含有(写化学式,下同),一定不含有,可能含有;(2)加入硝酸银溶液发生反应的化学方程式是。
6.右图表示某些物质间转化关系(反应条件和部分产物已省略)。
其中A、E为固体氧化物,且A为黑色粉末;B、D是由相同元素组成的无色液体,且B具有消毒杀菌作用;C、Y、Z为无色气体,其中Y有毒;X是最常见的金属。
请回答下列问题:(1)反应①中A物质的作用是;(2)反应③、④的化学方程式:③;④;(3)在日常生活中为防止反应②的发生,可采取的措施是(写一点即可);(4)在自然界中普遍存在反应⑤,其名称为。
7.实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。
于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。
实验过程如下:请回答:(1)滤液A和滤液B含有相同的溶质,其名称是;固体B 的化学式为。
(2)写出步骤①其中一个反应的化学方程废液过量锌粉13过滤滤液A蒸发至干2足量稀硫酸过滤Cu滤液B4固体A(Fe Cu Zn)磁铁固体C固体BZn SO4式;步骤④发生反应的化学方程式为。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是。
(4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和。
8. A、B、C、D、E五种物质均为初中化学中所涉及的常见物质,它们存在如右图的转化关系,“→”表示可以向箭头所指方向一步转化,弧线表示两种物质间可以发生反应,C是常见气体,D是常见单质,(反应条件与其他物质均已略去)。
请回答下列问题:(1)若A在常温下为液体,则C的化学式为;(2)若A在常温下为气体,则C的化学式为;(3)无论A在常温下为液体还是气体,B的化学式均为,D的化学式均为;(4)写出A→E的化学方程式:。
9.为了除去氯化钠样品中的碳酸钠杂质,某兴趣小组将样品溶解后进行如下实验:(1)A溶液中溶质可能为____________(只写一种);(2)将无色溶液与沉淀B分离的操作①的方法名称是_____________;(3)从无色溶液得到固体物质C的操作②的方法名称是____________;(4)因为A溶液过量,此方案得到的固体物质C中混有新的杂质,为了既能除去杂质碳酸钠,又能有效地防止新杂质的引入,可向样品溶液中加入过量的_____________后,直接进行操作②即可得到纯净的氯化钠固体。
10. A.、B、C、D、E、F、G、H、I都是初中化学学过的物质。
其中E、F、H均为黑色固体B为紫红色固体,D为混合物。
他们之间有下图的转化关系(部分生成物已省去)⑴用化学式表示D的组成、⑵F→G的反应类型⑶写出F→E 的化学方程式⑷指出B 的一种用途 11.物质A ~F 都是初中化学中的常 见物质,它们有如图所示的转化关系。
回答下列问题:(1)若A 为固体非金属单质, E 为红色固体单质, 则B 、D 的化学式为:B 、D写出下列反应化学方程式:A+B : 。
(2)若E 为一种盐,则A 、C 的化学式可能是 、 ;写出下列反应化学方程式:B+C : 。
12.有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。
某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。
方案流程如下:回答下列问题: (1)步骤②中:需加入的物质是 ,分离所得混合物的方法是 。
(2)步骤③中:需加入的物质是 ,发生反应的化学方程式是 。
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③, 你认为是否合理? ,理由是 . (4)步骤④的操作是 ,溶液2和溶液3为什么要混合? .13.右图表示的是物质A-H 相互间的关系(“→”表示物质间的转化关系,“——” 表示两端的物质能发生化学反应)。
A 、C 都是单质,气体C 常用于灭火,F 是一种蓝色溶液,可用于配制农药波尔多液。
请你回答:(1)C 的化学式 ,H 可能是 ; (2)写出标号①、②、③、④的化学方程式:① ② ③ ④ 14.在下面关系图中,A 、B 、C 、D 是初中化学中常见的单质,甲、乙分别是酒精燃烧时一定会产生的两种物质,丁是常用建筑材料的主要成分,G 为无色有刺激性气味的气体,能使紫色石蕊变蓝,J 是赤铁矿的主要成分。
④③①②工业废水 污泥溶液1固体 溶液2Ag 溶液3硫酸亚铁晶体(1)写出化学式:甲是 ,G 是 ;(2)写出H 与J 反应的化学方程式: ; (3)J 溶解于稀盐酸中,溶液呈黄色,反应完全后,再向溶液中加入纯净的D 的粉末,溶液逐渐变成浅绿色,写出有关变化的化学方程式:。
15.右图是初中化学中常见物质问的转化关系,其中甲、乙、丙均为非金属单质;A 、B 、E 和丁均为化合物;B 和E 为能产生温室效 应的气体。
(1)写出化学式:甲 ;乙(2)写出丙和正反应生成A 和B 的化学方程式 (3)D 和A 成A 和丙的化学方程式:16.右图中A 、B 、C 、D E 、F 、G 、H 分别 代表相关反应的一种物质。
已知:X 、H 为黑色固体单质,D 是大理石的主要成分,Y 为红棕色粉末。
常温下C 、E 、F 、G 均为无色气体,图中有部分生 成物未标出。
请填写以下空白: (1)写出下列两种物质的化学式:E_____________,X______________。
(2)写出下列反应的化学方程式:① D C 的反应:_________________________________。
②CD 的反应:_____________________________________________。
③ F 与H 的反应:________________________________________。
④ G 与Y 的反应:_______________________________________。
17、如图,A 、B 、C 、D 、E 各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。
常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B 的相对分子质量大于D 。
请填空:(1)写出下列物质的化学式:高温碱 B A CCDHG FB△ 通电+X 高温+Y高温 +Y 高温 +酸 +碱 高温A ,B ,D 。
(2)相连环物质间发生的反应,没有涉及的基本反应类型是______________________。
18、(1)“奥运在我心中”。
整理归纳物质性质之间的相互联系是学习化学的一种有效方法。
请你从学习过的单质、氧化物、酸、碱、盐中分别选一种代表物(不能重复选用),用化学式填写在下列的奥运标志五圆环中(两环相连表两种物质之间能相互发生反应)。
19、A、B、C、D四种物质在一定条件下有如下转化关系(反应条件已省去)。
请各写一例符合要求的化学方程式:①A是非金属单质,D是金属;②该反应类型是中和反应。
20.两种溶液混合,生成了一种沉淀。
用酸碱盐的知识回答下列问题。
(1) 若两种溶液均为无色,生成的白色沉淀不溶于稀硝酸,则两种溶液中的溶质可能是和;(2) 若两种溶液均为无色,生成的白色沉淀溶于稀硝酸且有气体产生,则两种溶液中的溶质可能是和;(3)若一种溶液有色,另一种无色,生成的沉淀溶于稀盐酸且无气体产生,沉淀可能是。
参考答案1.(10分)(1)(2分)H2SO4Ba(OH)2(2)(4分) ) H2SO4+BaCl2==BaSO4↓+2HCl (2分,其它合理答案都给分)Ba(OH)2+Na2CO3===BaCO3↓+2NaOH (2分,其它合理答案都给分) (3)(4分)酸与碱反应生成盐和水;酸与盐反应生成新酸和新盐;碱与盐反应生成新碱和新盐;盐与盐反应生成两新盐(写对一点给2分。
任意两点均可,其它合理答案都给分)2.(1)CH4(2)化合反应(3)2NaOH+CO2=Na2CO3+H2OCa(OH)2+Na2CO3=CaCO3↓+2NaOH3、 NaOH、CuCl2、Na2CO3NaOH、HNO3、Fe2O3【说明:B物质对得1分,A与B、HCl全对得1分,C与B、HCl全对得1分;若B物质错则不得分。
填物质名称不得分。
本题属开放性答案,其它合理答案也可】ADCB高温Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑[或NaOH+HCl==NaCl+H 2O或2NaOH+CuCl 2==Cu(OH)2↓+2NaCl 或Na 2CO 3+CuCl 2==CuCO 3↓+2NaCl 等] 【说明:所写化学方程式要与45、46、47三空对应,只有得分的物质,该化学方程式才能得分,否则不给分】 4.(1)Fe H 2 H 2O FeSO 4 (2)2 H 2+ O 22H 2O5.(3分)(1)MgCl 2 CuSO 4 NaCl 和NaNO 3 (2)AgNO 3+NaCl=AgCl ↓+NaNO 3(每空1分) 6.(共7分)(1)催化作用(写“催化剂”、“催化”、“催化性”也给分);(1分)(2)③Fe 2O 3+6HCl===2FeCl 3+3H 2O (2分) ④3CO +Fe 2O 3===2Fe+3CO 2(2分)(3)涂油(或刷漆、电镀等,其它合理答案均给分)(1分) (4)光合作用(1分) 7.(8分)(1)(2分)硫酸锌(1分) Fe (1分)(2)(2分)Zn+CuSO 4 =ZnSO 4 +Cu 或Zn+ FeSO 4== ZnSO 4+ Fe (1分) Zn+H 2SO 4 =ZnSO 4 +H 2↑(1分)(3)(2分)取步骤④的滤渣于试管中加入少量稀硫酸(1分),若有气泡产生则酸不足量(或若无气泡产生,则酸已足量,1分)(4)(2分)硫酸锌的质量(1分)、锌粉的质量(1分)[或硫酸锌、固体B 、固体C 、铜的质量,每说到2个给1分、全对给2分] 8.(6分)(1)H 2(1分) (2)CO (1分) (3)H 2CO 3(1分) O 2(1分)(4)6CO 2+6H 2O −−−−→−光照、叶绿素C 6H 12O 6+6O 2 (2分) 9.(1)氯化钙 (2)过滤 (3)结晶 (4)盐酸10、⑴Cu(OH)2 BaSO 4 ⑵ 化合反应 ⑶ ⑷作导线11.(共 6 分)(1)B: CuO (1分) D: CO 2 (1分); A+B: C+2CuO 高温===2Cu+CO 2↑ (1分) (2)A: H 2SO 4 (1分) C: CuSO 4 (1分) B+C: 2NaOH + CuSO 4 = Na 2SO 4 + Cu(OH)2↓ (1分) 12. (1).Fe 过滤(2).稀硫酸 Fe+H 2SO 4=FeSO 4+H 2 ↑(3).不合理 因为要使Ag + 完全置换出来,必须加入过量的铁 (4).两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用(其他合理答案也可)13.(6分)(1) CO 2 HCl 等(合理即可)(3)① 2C + 2CO ②2NaOH+CO 2=Na 2CO 3+H 2O③Na 2CO 3 + Ca(OH)2= CaCO 3 ↓+2NaOH ④Fe + CuSO 4 =Cu + FeSO 414.(5分)(1)H2O,NH3;(2)Fe2O3+3CO=2Fe+3CO2;(3)Fe2O3+6HCl=2FeCl3+3H2O;2FeCl3+Fe=3FeCl2。