电化学原理习题课说课讲解
- 格式:ppt
- 大小:1.55 MB
- 文档页数:55





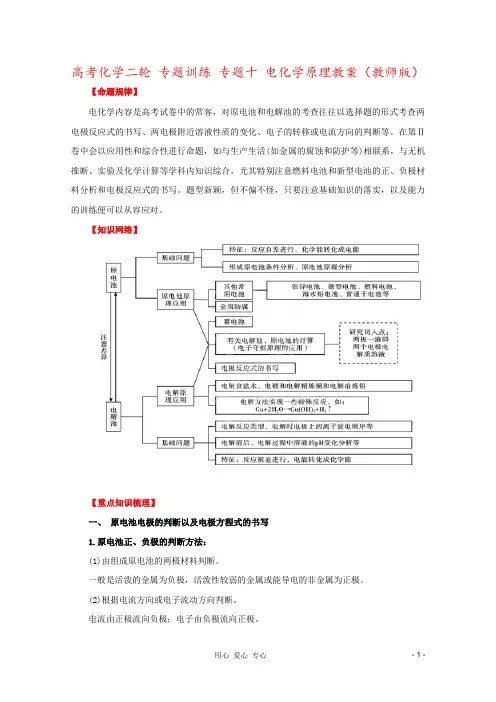
高考化学二轮专题训练专题十电化学原理教案(教师版)【命题规律】电化学内容是高考试卷中的常客,对原电池和电解池的考查往往以选择题的形式考查两电极反应式的书写、两电极附近溶液性质的变化、电子的转移或电流方向的判断等。
在第Ⅱ卷中会以应用性和综合性进行命题,如与生产生活(如金属的腐蚀和防护等)相联系,与无机推断、实验及化学计算等学科内知识综合,尤其特别注意燃料电池和新型电池的正、负极材料分析和电极反应式的书写。
题型新颖,但不偏不怪,只要注意基础知识的落实,以及能力的训练便可以从容应对。
【知识网络】【重点知识梳理】一、原电池电极的判断以及电极方程式的书写1.原电池正、负极的判断方法:(1)由组成原电池的两极材料判断。
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向判断。
电流由正极流向负极;电子由负极流向正极。
(3)根据原电池里电解质溶液内离子的流动方向判断。
在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断。
原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。
(5)电极增重或减轻。
工作后,电极质量增加,说明溶液中的阳离子在电极(正极)放电,电极活动性弱;反之,电极质量减小,说明电极金属溶解,电极为负极,活动性强。
(6)有气泡冒出。
电极上有气泡冒出,是因为发生了析出H2的电极反应,说明电极为正极,活动性弱。
2.原电池电极反应式和总反应式的书写(1)题目给定原电池的装置图,未给总反应式:①首先找出原电池的正、负极,即分别找出氧化剂和还原剂。
②结合介质判断出还原产物和氧化产物。
③写出电极反应式(注意两极得失电子数相等),将两电极反应式相加可得总反应式。
(2)题目中给出原电池的总反应式:①分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂参加的反应即为负极反应。




第四章第一节原电池教学目标知识与技能:进一步了解原电池的工作原理,了解设计原电池、选用正负极的原则,以及电极反应的概念。
过程与方法:1. 通过分组实验让学生体验化学能与电能相互转化的探究过程,培养学生观察能力与分析思维能力;2. 实验引导学生掌握以问题为中心的学习方法,学会发现问题、解决问题的方法 .情感态度与价值观:使学生进一步从能量的角度理解化学科学对人类生活的重要贡献。
教学重点:原电池的工作原理,写电极反应式和电池反应式。
教学难点:原电池的工作原理。
教学方法:实验探究法。
课时安排:1课时教学过程:[问题情境 ]1. 同学们在化学必修 2关于《化学能与电能》章节中,学习了原电池的基本原理和形成条件,那如果有下列两个装置能形成原电池吗?2.3. (依据学生的方案,肯定切实可行的方案,如在两烧杯间搭建盐桥。
[实验探究 ]在⑵装置中使用盐桥。
观察装置⑶的实验内容实验现象。
[学生 ]通过观察,记录并讲述实验现象。
[教师 ]归纳并板书实验现象: ①电流计指针偏转, 并指示电子是由锌片流向铜片;(1②锌片溶解质量减少;③铜片上有红色物质析出。
[结论 ]Cu-Zn-CuSO 4溶液构成了原电池, 发生了原电池反应, 并且锌为原电池的负极,铜为正极。
问题:1. 如何设法阻止溶液中的.......... Cu . . 2+. . 在负极锌表面还原以及能使⑶装置原 ................电池得到持续、稳定的电流呢?..............2. 若把装置⑶中左烧杯中的 CuSO 4溶液换成 ZnSO 4溶液可以吗? 实验 4-1观察,记录并讲述实验现象。
①盐桥存在时电流计指针偏转,且指针偏转角度随时间的延续几乎保持不变;②Zn 片溶解,无红色物质析出, Cu 片上有红色物质析出;③取出盐桥电流计指针回到零点。
[结论 ]Zn . . — . Cu . . — . ZnSO. . . . 4. 溶液.. — . CuSO. . . . 4. 溶液.. — . 盐桥构成了原电池,且能产生持 ..............续、稳定的电流....... ;取出盐桥时没有电流产生,不能形成原电池。