高考化学总复习考点题型专题讲解1---新型化学电源及其应用
- 格式:pdf
- 大小:186.78 KB
- 文档页数:9

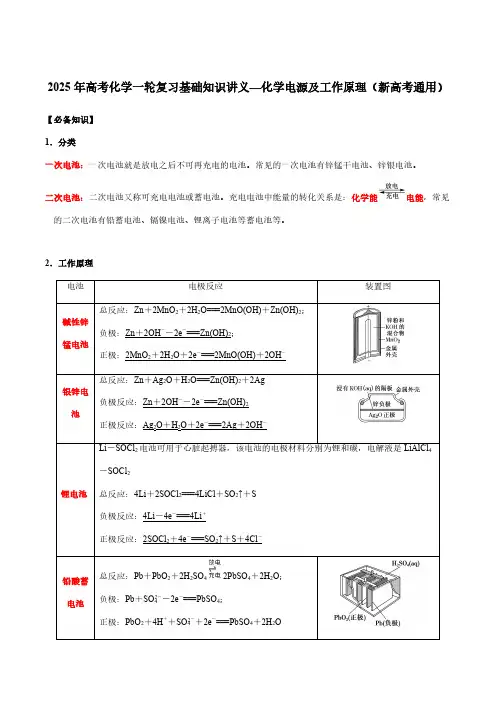
2025年高考化学一轮复习基础知识讲义—化学电源及工作原理(新高考通用)【必备知识】1.分类一次电池:一次电池就是放电之后不可再充电的电池。
常见的一次电池有锌锰干电池、锌银电池。
二次电池:二次电池又称可充电电池或蓄电池。
充电电池中能量的转化关系是:化学能电能,常见的二次电池有铅蓄电池、镉镍电池、锂离子电池等蓄电池等。
2.工作原理电池电极反应装置图碱性锌锰电池总反应:Zn +2MnO 2+2H 2O===2MnO(OH)+Zn(OH)2;负极:Zn +2OH --2e -===Zn(OH)2;正极:2MnO 2+2H 2O +2e -===2MnO(OH)+2OH -银锌电池总反应:Zn +Ag 2O +H 2O===Zn(OH)2+2Ag负极反应:Zn +2OH --2e -===Zn(OH)2正极反应:Ag 2O +H 2O +2e -===2Ag +2OH -锂电池Li -SOCl 2电池可用于心脏起搏器,该电池的电极材料分别为锂和碳,电解液是LiAlCl 4-SOCl 2总反应:4Li +2SOCl 2===4LiCl +SO 2↑+S负极反应:4Li -4e -===4Li +正极反应:2SOCl 2+4e -===SO 2↑+S +4Cl -铅酸蓄电池总反应:Pb +PbO 2+2H 2SO 42PbSO 4+2H 2O ;负极:Pb +SO 2-4-2e -===PbSO 4;正极:PbO 2+4H ++SO 2-4+2e -===PbSO 4+2H 2O【微点拨】①可逆电池的充、放电不是可逆反应。
②负接负后作阴极,正接正后作阳极。
【易错辨析】1.太阳能电池不属于原电池()2.可充电电池中的放电反应和充电反应互为可逆反应()3.铅酸蓄电池工作时,当电路中转移0.1mol电子时,负极增重4.8g()(SO42-:96)【答案】 1.√ 2.× 3.√【题型突破】1、(2019·浙江4月选考,12)化学电源在日常生活和高科技领域中都有广泛应用。
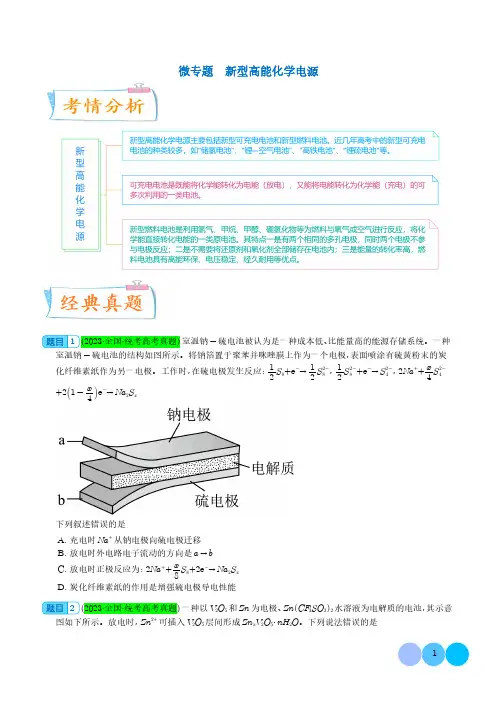
微专题新型高能化学电源1(2023·全国·统考高考真题)室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。
一种室温钠-硫电池的结构如图所示。
将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。
工作时,在硫电极发生反应:12S 8+e -→12S 2-8,12S 2-8+e -→S 2-4,2Na ++x 4S 2-4+21-x4e -→Na 2S x下列叙述错误的是A.充电时Na +从钠电极向硫电极迁移B.放电时外电路电子流动的方向是a →bC.放电时正极反应为:2Na ++x8S 8+2e -→Na 2S xD.炭化纤维素纸的作用是增强硫电极导电性能2(2023·全国·统考高考真题)一种以V 2O 5和Zn 为电极、Zn CF 3SO 3 2水溶液为电解质的电池,其示意图如下所示。
放电时,Zn 2+可插入V 2O 5层间形成Zn x V 2O 5⋅nH 2O 。
下列说法错误的是A.放电时V2O5为正极B.放电时Zn2+由负极向正极迁移C.充电总反应:xZn+V2O5+nH2O=Zn x V2O5⋅nH2OD.充电阳极反应:Zn x V2O5⋅nH2O-2xe-=xZn2++V2O5+nH2O1.电极反应式书写的一般步骤(类似氧化还原反应方程式的书写)2.突破二次电池的四个角度1.新型可充电电池(1)可充电电池有充电和放电两个过程,放电时是原电池反应,充电时是电解池反应。
(2)放电时的负极反应和充电时的阴极反应互为逆反应,放电时的正极反应和充电时的阳极反应互为逆反应。
将负(正)极反应式变换方向并将电子移项即可得出阴(阳)极反应式。
(3)充、放电时电解质溶液中离子移动方向的判断分析电池工作过程中电解质溶液的变化时,要结合电池总反应进行分析。
①首先应分清电池是放电还是充电。
②再判断出正、负极或阴、阳极。
放电:阳离子→正极,阴离子→负极;充电:阳离子→阴极,阴离子→阳极;总之:阳离子→发生还原反应的电极;阴离子→发生氧化反应的电极。


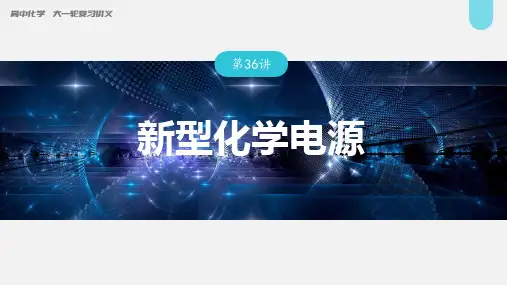

高考化学复习考点知识讲解与强化训练专题(9)新型化学电源1.我国成功研发一种新型铝-石墨双离子电池,这种新型电池采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。
电池总反应为C x(PF6)+LiAl 放电充电x C+PF-6+Li++Al。
该电池放电时的工作原理如图所示。
下列说法不正确的是( )A.放电时,B极的电极反应为LiAl-e-===Li++AlB.Li2SO4溶液可作该电池的电解质溶液C.充电时A极的电极反应式为x C+PF-6-e-===C x(PF6)D.该电池放电时,若电路中通过0.01 mol电子,B电极减重0.07 g解析:选B 电池总反应为C x(PF6)+LiAl放电充电x C+PF-6+Li++Al,放电时锂离子向A极移动,则A极为正极,B极为负极。
负极上LiAl失电子发生氧化反应,电极反应为LiAl-e-===Li++Al,故A正确;锂铝合金会与水反应生成氢氧化锂和氢气,所以该电池的电解质溶液不能使用任何水溶液,故B错误;充电时A极为阳极,电极反应式为x C+PF-6-e-===C x(PF6),故C正确;该电池放电时,若电路中通过0.01 mol电子,则B极有0.01 mol Li失去电子变成Li+,B电极减重0.07 g,故D正确。
2.[双选]利用微生物处理有机废水并脱盐的装置如图所示,下列说法不正确的是( )A.X、Y分别为阳离子交换膜、阴离子交换膜B.M极上发生的反应为O2+2H2O+4e-===4OH-C.微生物电极为负极D.处理后的废水的pH比有机废水的pH大解析:选AD HCOO-在微生物电极上发生氧化反应生成CO2,微生物电极为原电池的负极,原电池中阳离子向正极移动,阴离子向负极移动,要达到脱盐的目的,Cl-向负极(微生物电极)移动,Na+向正极(M极)移动,所以X为阴离子交换膜,Y为阳离子交换膜,A不正确,C正确;M极上发生的反应为O2+2H2O+4e-===4OH-,B正确;负极区反应后氢离子浓度增大,pH变小,D不正确。
高频考点51新型化学电源(二)
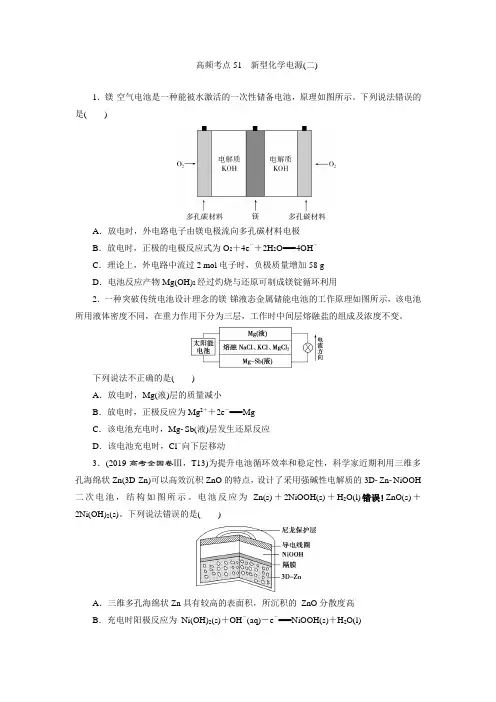
1.镁-空气电池是一种能被水激活的一次性储备电池,原理如图所示。
下列说法错误的是()
A.放电时,外电路电子由镁电极流向多孔碳材料电极
B.放电时,正极的电极反应式为O2+4e-+2H2O===4OH-
C.理论上,外电路中流过2 mol电子时,负极质量增加58 g
D.电池反应产物Mg(OH)2经过灼烧与还原可制成镁锭循环利用
2.一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。
下列说法不正确的是()
A.放电时,Mg(液)层的质量减小
B.放电时,正极反应为Mg2++2e-===Mg
C.该电池充电时,MgSb(液)层发生还原反应
D.该电池充电时,Cl-向下层移动
3.(2019·高考全国卷Ⅲ,T13)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZnNiOOH 二次电池,结构如图所示。
电池反应为Zn(s)+2NiOOH(s)+H2O(l)错误!ZnO(s)+2Ni(OH)2(s)。
下列说法错误的是()
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为Ni(OH)2(s)+OH-(aq)-e-===NiOOH(s)+H2O(l)。



高考化学总复习考点题型专题讲解高考化学总复习考点题型专题讲解新型化学电源及其应用新型化学电源及其应用以新型化学电源为载体,考查原电池、电解池的工作原理以及电极反应式的书写,是新课标全国卷的必考热点之一,命题设计主要是选择题,偶有非选择题出现。
该类试题常与工业生产,污水处理,能源开发相联系,题材广,信息新,陌生度大,主要考查考生阅读相关材料、提炼关键信息或结合图示等综合分析的能力、知识的迁移应用能力。
1.(2018·全国卷Ⅱ)我国科学家研发了一种室温下“可呼吸”的NaCO2二次电池。
将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na2Na2CO3+C。
下列说法错误的是( )A.放电时,ClO-4向负极移动B.充电时释放CO2,放电时吸收CO2C.放电时,正极反应为3CO2+4e-===2CO2-3+CD.充电时,正极反应为Na++e-===Na解析:根据电池的总反应知,放电时负极反应:4Na-4e-===4Na+;正极反应:3CO2+4e-===2CO2-3+C。
充电时,阴(负)极:4Na++4e-===4Na;阳(正)极:2CO2-3+C-4e-===3CO2↑。
放电时,ClO-4向负极移动。
根据充电和放电时的电极反应式知,充电时释放CO2,放电时吸收CO2。
答案:D2.(2017·全国卷Ⅲ)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为16Li+x S8===8Li2S x(2≤x≤8)。
下列说法错误的是( )A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提高电极a的导电性D.电池充电时间越长,电池中Li2S2的量越多解析:原电池工作时,正极发生一系列得电子的还原反应,即:Li2S8→Li2S6→Li2S4→Li2S2,其中可能有2Li2S6+2Li++2e-===3Li2S4,A项正确;该电池工作时,每转移0.02 mol电子,负极有0.02 mol Li(质量为0.14 g)被氧化为Li+,则负极质量减少0.14 g,B项正确;石墨烯能导电,用石墨烯作电极,可提高电极a的导电性,C项正确;充电过程中,Li2S2的量逐渐减少,当电池充满电时,相当于达到平衡状态,电池中Li2S2的量趋于不变,故不是电池充电时间越长,电池中Li2S2的量越多,D项错误。
答案:D1.解答新型化学电源题的步骤(1)根据总反应方程式分析元素化合价的变化,确定正、负极反应物。
(2)注意溶液酸碱性环境,书写正、负极反应式。
(3)依据原电池原理或正、负极反应式分析判断电子、离子的移向,电解质溶液的酸碱性变化。
(4)灵活应用守恒法、关系式法进行计算。
2.注意可充电电池的三事项(1)放电时是原电池反应,充电时是电解池反应。
(2)充电时,可充电电池的正极连接外接电源的正极,可充电电池的负极连接外接电源的负极。
(3)充、放电时电解质溶液中离子移动方向的判断:分析电池工作过程中电解质溶液的变化时,要结合电池总反应进行分析。
①首先应分清电池是放电还是充电。
②再判断出正、负极或阴、阳极。
放电:阳离子→正极,阴离子→负极;充电:阳离子→阴极,阴离子→阳极;总之:阳离子→发生还原反应的电极;阴离子→发生氧化反应的电极。
1.(2019·南平质检)有人设想以N2和H2为反应物,以溶有X的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示。
下列说法正确的是( )A.放电时H+向左移动,生成的物质X是N H4ClB.通入H2的一极为正极C.通入N2的电极反应为:N2+6H+-6e-===2N H3D.放电过程右边区域溶液pH逐渐增大解析:以N2、H2为原料,以溶有X的稀盐酸为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成N H+4,电极反应式为N2+6e-+8H+===2N H+4;负极是氢气失电子生成氢离子,电极方程式为H2-2e-===2H+,总反应为:N2+3H2+2H Cl===2N H4Cl。
A项,放电时H+向正极移动,即向左移动,生成的物质X是N H4Cl,正确;B项,通入H2的一极为负极,错误;C项,通入N2的电极为正极,发生还原反应,N2+6e-+8H+===2N H+4,错误;D项,放电过程右边区域为负极区,H2-2e-===2H+,溶液pH逐渐减小,错误;故选A。
答案:A2.(2019·嘉兴模拟)镁—空气电池的工作原理如图所示,电池反应方程式为:2M g+O2+2H2O===2M g(O H)2。
有关该电池的说法不正确的是( )A.通入氧气的电极为正极B.放电时,溶液中的O H-由正极移向负极C.负极的电极反应为M g-2e-+2O H-===M g(O H)2D.当电路中转移0.04 mol电子时,参加反应的O2为 0.02 mol解析:A项,镁—空气电池中,镁为负极,氧气为正极,正确;B项,原电池中阳离子移向正极,阴离子移向负极,所以溶液中的O H -由正极移向负极,正确;C 项,镁为负极,负极的电极反应为M g-2e -+2O H -===M g(O H )2,正确;D 项,氧气为正极,电极反应为O 2+2H 2O+4e -===4O H -,根据电极反应可知:当电路中转移0.04 mol 电子时,参加反应的O 2为0.01 mol,错误。
答案:D3.科学家设计出质子膜H 2S 燃料电池,实现了利用H 2S 废气资源回收能量并得到单质硫。
质子膜H 2S 燃料电池的结构示意图如下图所示。
下列说法不正确的是( )A.电极a 为电池的负极B.电极b 上发生的电极反应为O 2+4H ++4e -===2H 2OC.电路中每流过4 mol 电子,在正极消耗44.8 L H 2SD.每17 g H 2S 参与反应,有1 mol H +经质子膜进入正极区解析:根据图示,电极a 上H 2S 失去电子被氧化成S 2,电极a 为负极,A 项正确;电极b 上O 2发生得电子的还原反应,电极反应式为O 2+4H ++4e -===2H 2O,B 项正确;H 2S 在负极被消耗,负极电极反应式为2H 2S-4e -===S 2+4H +,电路中流过4 mol 电子,负极消耗2 mol H 2S,H 2S 所处温度和压强未知,无法计算消耗H 2S 的体积,C 项错误;n (H 2S)=17 g 34 g·mol-1=0.5 mol,根据正极和负极电极反应式,每17 g H 2S 参与反应有1 mol H +经质子膜进入正极区,D 项正确;答案选C。
答案:C4.(2019·乐山调研)据报道,用甲酸提供氢气的燃料电池由瑞士科技工作者开发成功。
燃料电池包括两个部分:甲(HYF O RM )中使用钌(Ru )基催化剂从甲酸中产生氢气;乙(PEMF C)是以NaO H 为电解质的氢氧燃料电池。
装置的原理示意图如图。
下列有关说法错误的是( )A.该燃料电池使用的甲酸比氢气更易储存和运输B.Y 室的电极反应式:O 2+4H ++4e -===2H 2OC.X 室为负极室,Y 室为正极室D.甲中消耗1 mol 甲酸,乙中转移2 mol 电子解析:甲酸为液态,氢气为气态,且易在空气中燃烧发生爆炸,因此该燃料电池使用的甲酸比氢气更易储存和运输,A 正确;Y 室为原电池的正极,发生还原反应,电极反应式O 2+4e -+2H 2O===4O H -,B 错误;通过装置图看出,X 室为负极室,Y 室为正极室,C 正确;甲酸分解产生二氧化碳和氢气,H COO H ===CO 2↑+H 2↑;反应转移2 mol 电子,因此甲中消耗1 mol 甲酸,乙中转移2 mol 电子,D 正确。
答案:B5.(2019·宜宾诊断)某锂离子电池工作原理如下图所示,电池反应为:Li 1-x CoO 2+Lix C放电充电LiCoO 2+C。
下列说法不正确的是( )A.放电时,电子从b极经用电器流向a极B.放电时,若转移1 mol e-,碳材料将增重7 g C.充电时,锂离子通过隔膜进入右室D.充电时,a极反应:LiCoO2-x e-===Li1-x CoO2+x Li+解析:电池反应为:Li1-x CoO2+Li x C 放电充电LiCoO2+C。
放电时,a极反应:Li1-x CoO2+x Li++x e-===LiCoO2,故为原电池的正极,b极为负极,电极反应:Li x C-x e-===x Li++C,A项,放电时,电子从负极b极经用电器流向正极a极,正确;B项,根据电极反应:Lix C-x e-===x Li++C,放电时,若转移1 mol e-,碳材料将增重12x g,不正确;C项,充电时,锂离子通过隔膜向阴极室进入右室,正确;D项,充电时,a极为阳极,电极反应:LiCoO2-x e-===Li1-x CoO2+x Li+,正确。
答案:B6.(2019·天津和平区模拟)氢氧熔融碳酸盐燃料电池是一种高温电池(600~700 ℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。
氢氧熔融碳酸盐燃料电池的工作原理如图所示。
下列有关该电池的说法正确的是( )A.电池工作时,熔融碳酸盐只起到导电的作用B.负极反应式为H2-2e-+CO2-3===CO2+H2OC.该电池可利用工厂中排出的CO2,减少温室气体的排放D.电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2解析:根据图示,在氢氧熔融碳酸盐燃料电池中,通入氢气的电极为负极,负极发生氧化反应,电极反应式为H2-2e-+CO2-3===CO2+H2O,通入氧气的电极为正极,正极发生还原反应,电极反应式为O2+2CO2+4e-===2CO2-3,总反应为2H2+O2===2H2O。
根据上述分析,电池工作时,熔融碳酸盐参与了电极反应,故A错误;负极发生氧化反应,电极反应式为H2-2e-+CO2-3===CO2+H2O,故B正确;根据总反应,该电池工作时没有消耗二氧化碳,不能减少温室气体的排放,故C错误;电池工作时,外电路中流过0.2 mol电子,消耗0.5 mol氧气,质量为16 g O2,故D错误。
答案:B7.某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(C H2)2N H2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。
下列分析正确的是( )A.电子流动方向为a→导线→bB.H+经质子交换膜由右向左移动C.放电一段时间b极附近pH不变D.a电极发生反应:H2N(C H2)2N H2+16e-+4H2O===2CO2↑+N2↑+16H+解析:H2N(C H2)2N H2在a电极上失电子发生氧化反应,生成氮气、二氧化碳和水,则a为负极,电极反应式为H2N(C H2)2N H2+4H2O-16e-+4H+===2CO2↑+N2↑+16H+,氧气在正极b上得电子发生还原反应,电子反应式为O2+4e++4H+===2H2O,电子由负极经导线流向正极,阳离子向正极移动。