高二化学:《盐类的水解》教案(新人教版必修1)2
- 格式:doc
- 大小:122.00 KB
- 文档页数:4

高二化学教案盐类水解(精选3篇)教案一:盐类水解的基本概念学习目标:1. 了解盐类水解的概念和常见的盐类水解反应;2. 掌握盐类水解反应的化学方程式和反应条件;3. 理解盐类水解的原理和影响因素。
教学重点:1. 盐类水解反应的常见类型和特点;2. 盐类水解反应的化学方程式和反应条件。
教学难点:1. 盐类水解反应的原理和影响因素。
教学准备:教学PPT、实验装置与试剂、教学模型等。
教学过程:Step 1:引入通过提问的方式问学生:在日常生活中,我们经常会遇到盐的水解现象。
举例并让学生回答,如:酸性盐和碱性盐在水中溶解会有什么现象?Step 2:概念讲解通过教学PPT的呈现,讲解盐类水解的概念:指的是盐在水中溶解时,与水分子发生反应产生酸、碱或氧化还原反应的过程。
并指出盐类水解反应是离子溶液中的一个重要类型。
Step 3:常见盐类水解反应通过示意图和实验现象的呈现,讲解常见盐类水解反应:酸性盐水解、碱性盐水解、氧化还原性盐水解等。
每种盐类水解反应都分别给出化学方程式,并说明反应条件。
Step 4:盐类水解原理和影响因素通过实验现象和示意图的呈现,讲解盐类水解的原理和影响因素。
强调影响盐类水解的因素有:盐的酸碱性质、水解度、温度等。
Step 5:实验演示进行盐类水解反应的实验演示,如:氯化铵水解反应,观察反应现象并记录数据。
Step 6:讨论与总结让学生进行讨论,总结盐类水解反应的特点,对比不同类型盐类水解反应的相同点与不同点。
Step 7:作业布置布置作业:要求学生找出身边的几种常见盐,并通过查阅资料,找出它们可能发生的水解反应,并写出对应的化学方程式。
教案二:酸性盐的水解实验学习目标:1. 了解酸性盐水解的概念和反应类型;2. 掌握酸性盐水解反应的化学方程式和反应条件;3. 通过实验演示,观察和记录酸性盐水解反应的现象与数据。
教学重点:1. 酸性盐水解的化学方程式和反应条件;2. 实验观察和数据记录。
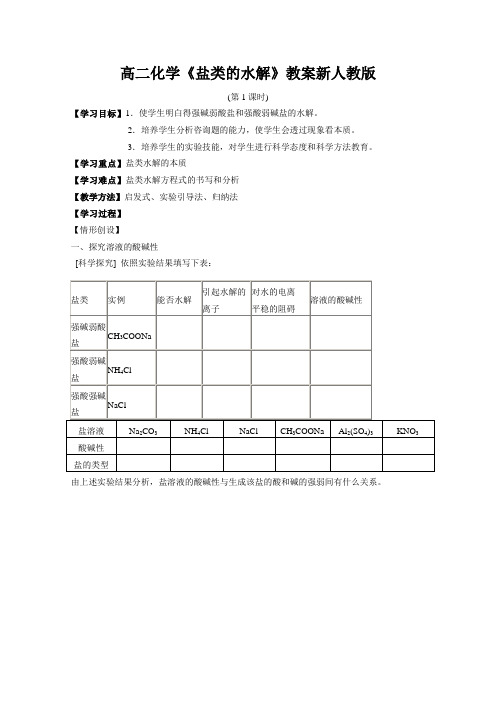
高二化学《盐类的水解》教案新人教版(第1课时)【学习目标】1.使学生明白得强碱弱酸盐和强酸弱碱盐的水解。
2.培养学生分析咨询题的能力,使学生会透过现象看本质。
3.培养学生的实验技能,对学生进行科学态度和科学方法教育。
【学习重点】盐类水解的本质【学习难点】盐类水解方程式的书写和分析【教学方法】启发式、实验引导法、归纳法【学习过程】【情形创设】一、探究溶液的酸碱性[科学探究] 依照实验结果填写下表:由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系。
盐的组成与盐溶液酸碱性的关系:盐的类型强酸强碱盐强酸弱碱盐强碱弱酸盐溶液的酸碱性二、查找盐溶液出现不同酸碱性的缘故1.强碱弱酸盐的水解[摸索与交流](1) CH3COONa溶液中存在着几种离子?写出电离方程式。
(2)溶液中哪些离子可能相互结合,对水的电离平稳有何阻碍?什么缘故CH3COONa溶液显碱性?(3)写出CH3COONa溶液水解的化学方程式和离子方程式。
2.强酸弱碱盐的水解[摸索与交流]应用盐类水解的原理,分析NH4Cl溶液显酸性的缘故,并写出有关的离子方程式。
归纳:〔1〕这种在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
〔2〕只有弱酸的阴离子或弱碱的阳离子才能与H+或OH-结合生成弱电解质。
〔3〕盐类水解使水的电离平稳发生了移动,并使溶液显酸性或碱性。
讨论:〔4〕盐类水解反应是酸碱中和反应的逆反应。
水解的规律是:有弱才水解,无弱不水解,越弱越水解,都弱双水解。
谁强显谁性,同强显中性。
三、盐类水解离子方程式的书写书写规那么:1.盐类水解是可逆反应,反应方程式中要写〝〞号。
如CH3COO-+H2OCH3COOH+OH-2.一样盐类水解的程度专门小,水解产物专门少。
通常不生成沉淀或气体,也不发生分解。
在书写离子方程式时一样不标〝↓〞或〝↑〞,也不把生成物〔如H2CO3、NH3·H2O等〕写成其分解产物的形式。

2023年高二化学教案盐类的水解(精选3篇)教案一:碳酸盐的水解一、教学目标:1. 理解碳酸盐的化学式及性质;2. 掌握碳酸盐的水解反应及其机理;3. 能够应用所学知识解决相关问题。
二、教学重难点:1. 碳酸盐的水解反应及机理;2. 碳酸盐溶解度的影响因素。
三、教学内容:1. 碳酸盐的化学式及性质;2. 碳酸盐的水解反应及其机理;3. 碳酸盐溶解度的影响因素。
四、教学方法:1. 讲授法:通过教师讲解,介绍碳酸盐的性质、水解反应及机理;2. 实验演示法:进行一些与水解反应相关的实验;3. 讨论法:让学生针对实验现象和结果进行讨论,提高学生的思维能力和分析问题的能力。
五、教学过程:1. 碳酸盐的性质介绍a. 碳酸盐的化学式及普遍性质;b. 碳酸盐的溶解度及其影响因素。
2. 碳酸盐的水解反应及机理a. 硝酸钙水解的实验演示;b. 碳酸盐水解的一般机理。
3. 实验演示:氢氧化钙和二氧化碳的反应(即石灰水的实验)。
4. 水解反应的应用a. 饮用水中碳酸盐的水解反应对人体的影响;b. 碳酸盐水解反应在环境保护中的应用。
六、课堂讨论:1. 碳酸盐水解反应的机理是什么?2. 碳酸盐溶解度为什么受环境因素的影响?3. 碳酸盐的水解反应与环境保护有什么关系?七、板书设计:碳酸盐的水解反应及其机理八、作业布置:1. 完成课后习题;2. 了解碳酸盐在日常生活中的应用。
教案二:氯化铵的水解一、教学目标:1. 理解氯化铵的化学式及性质;2. 掌握氯化铵的水解反应及相关实验操作;3. 能够应用所学知识解决相关问题。
二、教学重难点:1. 氯化铵的水解反应及机理;2. 掌握氯化铵水解反应的实验操作。
三、教学内容:1. 氯化铵的化学式及性质;2. 氯化铵的水解反应及机理;3. 氯化铵水解实验的操作方法。
四、教学方法:1. 讲授法:通过教师讲解,介绍氯化铵的性质、水解反应及机理;2. 实验演示法:进行氯化铵水解实验,让学生观察实验现象。


高二化学教案盐类的水解(精选3篇)教案一:盐类的水解教学目标:1.了解盐类的水解反应。
2.掌握盐类的水解方程式和产物。
3.通过实验观察盐类的水解过程,并总结规律。
教学重点:盐类的水解方程式和产物。
教学难点:盐类的水解规律。
教学准备:实验材料:NaCl,Na2SO4,CuSO4,BaCl2,试管,移液管,酚酞指示剂。
实验器材:烧杯,三角废旧瓷片,酒精灯,玻璃棒。
教学过程:Step 1 引入:通过与学生的互动提问,引导学生回忆有关酸碱和盐类的知识,并了解到盐类有时候也可以发生水解反应。
Step 2 实验观察:1.将NaCl溶解于一定量的水中,用酚酞指示剂滴定,观察颜色的变化。
2.重复步骤1,使用Na2SO4、CuSO4、BaCl2替代NaCl,观察颜色的变化。
Step 3 实验结果解释:让学生根据实验结果总结盐类的水解规律。
Step 4 归纳总结:让学生总结盐类的水解方程式和产物,并把实验结果归纳到盐类的水解规律中。
Step 5 拓展讨论:引导学生思考,在实际生活中有哪些常见的盐类是可以水解的,这些水解反应有什么特殊的应用。
Step 6 小结:对本节课所学内容进行小结,并检查学生的学习情况。
教学延伸:可以让学生自主设计实验,观察不同浓度的盐溶液的水解情况,进一步深入了解盐类的水解反应规律。
教案二:盐类的水解与溶液的酸碱性教学目标:1.了解盐类的种类和水解的基本反应方程式。
2.掌握溶液的酸碱性与盐的水解之间的关系。
3.能够通过实验判断盐溶液中酸、碱或中性的特点。
教学重点:溶液的酸碱性与盐的水解之间的关系。
教学难点:通过实验判断盐溶液中酸、碱或中性的特点。
教学准备:实验材料:NaCl,Na2SO4,CuSO4,BaCl2,酚酞指示剂,酚酞溶液。
实验器材:试管,玻璃棒,滴管。
教学过程:Step 1 引入:通过与学生的互动提问,引导学生回顾盐的定义和不同种类的盐,以及酸碱与盐的关系。
Step 2 实验观察:1.将NaCl溶解于一定量的水中,用酚酞指示剂滴定,观察颜色的变化。

《盐类的水解》说课材料指导思想:课堂教学的核心是对学生思维能力的培养和学习方法的指导,课堂上要充分发挥学生的主体作用,力求把研究性学习方式推广到课堂教学中。
一、教材分析:1 .教材内容《盐类的水解》是高中化学〔必修加选修〕第二册第三章第三节的内容。
2 .教材的地位和作用本节教材涉及的知识面较宽,综合性较强,具有很强的理论意义和实际意义,是前面已学过的电解质的电离,水的电离平衡和水的离子积,以及平衡移动原理等知识的综合利用。
本节教学是本章教学的重点和难点,通过本节的教学不仅可以加深对强弱电解质,离子反应和离子反应方程式等知识的理解,而且还可以进一步指导高三有关电解和物质的检测等知识的学习。
3 .教学大纲的要求盐类的水解〔强酸弱减盐和强碱弱酸盐〕4 .教学目标及确立依据根据学生已有的知识水平和认知能力,以及教学大纲和教材的要求确立本节的教学目标为:①知识:使学生理解强酸弱减盐和强碱弱酸盐的水解②能力:培养学生的实验技能和分析问题,解决问题的能力③德育:对学生进行科学态度和科学方法教育,使学生学会透过现象看本质④情感:创设宽松学习氛围,激发学生学习化学的兴趣5 .教学重点、难点及确立依据教学重点:盐类的水解的本质确立依据:根据教材的地位及教学大纲的要求,考虑学生已有的知识水平,盐类的水解是前面学过的许多知识的综合利用。
教学难点:盐类的水解方程式的书写和分析确立依据:与高一时所学的离子方程式书写有所不同,同时需考路盐类的水解的实质,对学生有一定的难度。
6.教材处理〔1〕将演示实验改为学生分组实验,并改为微观实验,现象明显,操作简单,同时增加学生检测纯水的pH的实验,与其他比较,更能说明问题。
〔2〕将盐类的水解的实质用多媒体模拟,微观过程宏观化促进学生对这一过程的理解。
二、学生情况分析:1.学生情况:已学过离子方程式书写、化学平衡、电离平衡以及溶液的pH,这几部分知识对学生来说均有一定的难度,而盐类的水解又是这几部分的综合利用,就更有难度。
高二化学教案:《盐类的水解》教学设计(学习版)编制人:__________________审核人:__________________审批人:__________________编制学校:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的学习资料,如语文资料、数学资料、英语资料、历史资料、地理资料、化学资料、生物资料、物理资料、政治资料、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides various types of learning materials for everyone, such as language materials, mathematics materials, English materials, historical materials, geographic materials, chemical materials, biological materials, physical materials, political materials, other materials, etc. Please pay attention to the data format and writing method!高二化学教案:《盐类的水解》教学设计教学目标1.使学生理解强碱弱酸盐和强酸弱碱盐的水解。
一、教学目标1. 让学生理解盐类水解的概念和实质。
2. 使学生掌握盐类水解的规律和影响因素。
3. 培养学生运用盐类水解知识解决实际问题的能力。
二、教学内容1. 盐类水解的概念:盐类在水中溶解时,阳离子与阴离子分别与水分子发生作用,产生酸碱性质的过程。
2. 盐类水解的实质:盐类在水中溶解时,离子与水分子发生相互作用,导致溶液中H+和OH-的浓度发生变化,从而使溶液呈现酸碱性。
3. 盐类水解的规律:根据盐类离子的酸碱性质,分为强酸强碱盐、弱酸强碱盐、强酸弱碱盐和弱酸弱碱盐,它们的水解程度不同。
4. 影响盐类水解的因素:离子浓度、温度、溶剂等。
5. 盐类水解在实际中的应用:如调节土壤pH值、制备缓冲溶液等。
三、教学重点与难点1. 重点:盐类水解的概念、实质、规律及影响因素。
2. 难点:盐类水解的规律和影响因素的理解与应用。
四、教学方法1. 采用问题驱动法,引导学生思考和探讨盐类水解的相关问题。
2. 利用实例分析,让学生了解盐类水解在实际中的应用。
3. 采用小组讨论法,培养学生团队合作精神和口头表达能力。
4. 利用多媒体手段,形象地展示盐类水解的过程。
五、教学安排1. 第1-2课时:讲解盐类水解的概念和实质。
2. 第3-4课时:分析盐类水解的规律和影响因素。
3. 第5-6课时:实例分析,了解盐类水解在实际中的应用。
4. 第7-8课时:小组讨论,培养学生运用盐类水解知识解决实际问题的能力。
5. 第9-10课时:总结与复习,进行课堂测试。
六、教学评估1. 课堂问答:通过提问的方式,了解学生对盐类水解概念和实质的理解程度。
2. 小组讨论:观察学生在小组讨论中的表现,了解他们对于盐类水解规律和影响因素的掌握情况。
3. 实例分析报告:评估学生对盐类水解在实际应用中的理解,通过报告的形式进行。
4. 课堂测试:设计相关的测试题目,测试学生对盐类水解知识的掌握和应用能力。
七、教学资源1. 教材:盐类水解的相关章节。
2. 多媒体课件:用于展示盐类水解的过程和实例。
高中化学盐类的水解教案【教学目标】1. 了解盐类的水解反应的基本概念和规律;2. 掌握盐类的水解方程式的写法;3. 能够根据盐类的离子成分预测其水解的可能性和产物;4. 能够应用盐类水解的知识解决相关问题。
【教学重点】1. 盐类水解的反应特点;2. 盐类水解方程式的写法;3. 盐类水解产物的判断。
【教学难点】1. 包含多种离子的盐类的水解反应;2. 盐类水解产物的理解和推算。
【教学准备】1. 教师准备好盐类水解实验器材和试剂;2. 准备教具、图表、实验记录表等相关资料。
【教学过程】一、导入(5分钟)1. 利用实验现象或日常生活中的例子引入盐类水解的概念,引起学生的兴趣和好奇心;2. 引导学生思考盐类的水解反应是否存在以及可能的产物。
二、讲解盐类水解的基本概念(15分钟)1. 介绍盐类水解的概念和一般规律;2. 分析盐类水解的产物是酸、碱还是中性物质的判断方法;3. 举例说明不同类型盐类的水解反应。
三、实验操作(20分钟)1. 进行盐类水解实验,观察反应现象,记录实验结果;2. 根据实验结果判断盐类水解的产物;3. 写出反应方程式,判断反应性质。
四、总结与拓展(10分钟)1. 请学生总结盐类水解的一般规律和常见情况;2. 引导学生思考其他可能的盐类水解反应以及产物;3. 解答学生关于盐类水解的问题。
五、作业布置(5分钟)布置相关习题作业,让学生巩固所学知识,提高解决问题的能力。
以上教案为范本,具体实施时根据班级实际情况和学生的掌握程度进行调整,确保教学内容能够达到预期效果。
选修四第三章第三节
盐类的水解(第1课时)教案
教学目的:
1.认识盐类水解的原理,能初步根据盐的组成判断盐溶液的酸碱性。
2.归纳影响盐类水解程度的主要因素。
2.能举例说明盐类水解在生产生活中的应用。
教学重点:盐类水解的实质。
重点难点:盐类水解的实质;离子方程式书写。
教学过程:
第一课时
[学生分组实验]用pH试纸检验CH3COONa、Na2CO3、NH4CI、(NH4)2SO4、NaCI、Na2SO4、NaHCO3溶液的酸碱性。
①小组做NaHCO3、CH3COONa、Na2CO3实验②小组做NH4CI、(NH4)SO4实验③小组做NaCI、Na2SO4④小组做CH3COONa、NH4CI实验。
先看实验目的、步骤,2
明白后再做实验。
[板书]第三节盐类的水解
一、探究盐溶液的酸碱性
[投影]实验步骤:1各取少量试剂放入试管中,加入1―2ml 蒸馏水溶解。
2用干净的镊子夹取一小块pH试纸于表面皿中,用玻璃棒沾取一滴溶液于试纸上。
3观察试纸的颜色变化与标准比色卡对比,以确定溶液的酸碱性。
[回答] 学生汇报实验结果①溶液呈碱性②溶液呈酸性③溶液呈中性④CH3COONa呈碱性,NH4CI呈酸性。
[讨论探究]从实验结果分析,盐溶液分别呈中性、酸性、碱性都有,哪么,与生成盐的酸与碱的强、弱之间有什么关系?
[学生小结]盐的组成与盐溶液酸碱性的关系:
强碱弱酸盐的水溶液显碱性
强酸弱碱盐的水溶液显酸性
强酸强碱盐的水溶液显中性
[板书]二、寻找盐溶液呈现不同酸碱性的原因
[讲述]下面我们分别研究不同类盐的水溶液酸碱性不同的原因。
[讨论](1)CH3COONa溶液中存在着几种粒子?
(2)哪些离子可能相互结合,对水的电离平衡有何影响?
(3)为什么CH3COONa溶液显碱性?
[讲解]CH3COONa溶于水时,CH3COONa电离出的CH3COO-和水电离出的H+结合生成难电离的CH3COOH,消耗了溶液中的H+,使水的电离平衡向右移动,产生更多的OH-,建立新平衡时,c(OH-)>c(H+),从而使溶液显碱性。
[副板书]
CH3COONa+H2O CH3COOH+NaOH或CH3COO-+H2O CH3COOH+OH-
[讨论] NH4Cl溶液显酸性的原因,并写出有关的离子方程式。
[学生小结]NH4Cl溶于水时电离出的NH4+与水电离出的OH-结合成弱电解质NH3·H2O,消耗了溶液中的OH-,使水的电离平衡向右移动,产生更多的H+,建立新平衡时,c(H+)>c(OH-),从而使溶液显酸性。
[板书]1、CH3COO-+H2O CH3COOH+OH-NH4++ H2O NH3·H2O+H+
[小结](投影)
(1)这种在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
(2)只有弱酸的阴离子或弱碱的阳离子才能与H+或OH-结合生成弱电解质。
(3)盐类水解使水的电离平衡发生了移动,并使溶液显酸性或碱性。
(4)盐类水解反应是酸碱中和反应的逆反应。
(5)盐类水解是可逆反应,反应方程式中要写“”号。
[练习]写出NH4Cl及CH3COONa溶液中所有微粒的化学式,并按浓度大小排列顺序。
[板书]2、盐类的水解:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应。
实质:破坏了水的电离平衡,使水的电离平衡发生移动。
注意:
1.盐类水解使水的电离平衡发生了移动,并使溶液显酸性或碱性。
2.盐类水解反应是酸碱中和反应的逆反应。
3.盐类水解是可逆反应,反应方程式中要写“”号。
[讨论]以NaCl为例,说明强酸强碱盐能否水解。
[学生小结]由于NaCl电离出的Na+和Cl-都不能与水电离出的OH-或H+结合生成弱电解质,所以强酸强碱盐不能水解,不会破坏水的电离平衡,因此其溶液显中性。
[板书] 只有弱酸的阴离子或弱碱的阳离子才能与H+或OH-结合生成弱电解质。
[讨论]分析Na2CO3的水解过程,写出有关反应的离子方程式。
[板书]Na2CO3的水解
第一步:CO32-+H2O HCO3-+OH-(主要)
第二步:HCO3-+H2O H2CO3+OH-(次要)
[板书]多元弱酸的盐分步水解,以第一步为主。
一般盐类水解的程度很小,水解产物很少。
通常不生成沉淀或气体,也不发生分解。
在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成其分解产物的形式。
(投影显示空表,具体内容由学生填)
[课堂练习]
1.在水中加入下列物质,可使水的电离平衡向电离方向移动的是
A、硫酸
B、氢氧化钾
C、氯化铁
D、硝酸钡
2.在一定浓度的FeCl3溶液中,存在如下水解平衡:
Fe3++ 3H2O Fe(OH)3+3H+
在此溶液中滴入饱和的FeCl3溶液,下列哪个变化的说法正确
A、水解平衡向正反应方向移动
B、水解平衡向逆反应方向
C、溶液中H+离子浓度增大
D、Fe3+的水解程度增大
3.常温下,将0.1mol的下列物质置于0.5L水中,充分搅拌后,溶液中阴离子数目从大到小的排列顺序正确的是
①Na2O2②Ba3(PO4)2③Na2S ④NaAlO2⑤AlCl3
A、⑤①③④②
B、⑤②①③④
C、⑤①④③②
D、②⑤①③④
4.(1)碳酸钾的水溶液蒸干得到的固体物质是________,原因是________________。
(2)KAl(SO4)2溶液蒸干得到的固体物质是________,原因是____________________。
(3)碳酸氢钡溶液蒸干得到的固体物质是________,原因是____________________。
(4)亚硫酸钠溶液蒸干得到的固体物质是________,原因是____________________。
(5)氯化铝溶液蒸干得到的固体物质是________,原因是______________________。
参考答案:
1、C
2、AC
3、A 4.(1)碳酸钾。
尽管加热过程能促进碳酸钾水解,但生成的碳酸氢钾和氢氧化钾反应后仍为碳酸钾。
(2)明矾。
尽管Al3+水解,由于硫酸是高沸点酸,不能挥发,最后仍然会留下明矾。
(3)碳酸钡。
碳酸氢钡在溶液中受热分解。
(4)硫酸钠。
亚硫酸钠在蒸干的过程中不断被空气氧化而变成硫酸钠。
(5)氢氧化铝和氧化铝。
Al3+水解,HCl挥发,得氢氧化铝,氢氧化铝部分分解为氧化铝。
[作业]P57~58 1、2、3、4、5、6
[板书计划] 第三节盐类的水解
一、探究盐溶液的酸碱性
强碱弱酸盐的水溶液水解显碱性
强酸弱碱盐的水溶液水解显酸性
强酸强碱盐的水溶液不水解显中性
二、寻找盐溶液呈现不同酸碱性的原因
1、CH3COO-+H2O CH3COOH+OH-NH4++ H2O NH3·H2O+H+
2、盐类的水解:在溶液中盐电离出来的离子跟水所电离出来的H +或OH-结合生成弱电解质的反应。
实质:破坏了水的电离平衡,使
水的电离平衡发生移动。
注意:
1.盐类水解使水的电离平衡发生了移动,并使溶液显酸性或碱性。
2.盐类水解反应是酸碱中和反应的逆反应。
3.盐类水解是可逆反应,反应方程式中要写“”号。
Na2CO3的水解
第一步:CO32-+H2O HCO3-+OH-(主要)
第二步:HCO3-+H2O H2CO3+OH-(次要)
多元弱酸的盐分步水解,以第一步为主。
一般盐类水解的程度很小,水解产物很少。
通常不生成沉淀或气体,也不发生分解。
在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成其分解产物的形式。