家兔的麻醉气管插管颈总动脉插管 ppt课件
- 格式:ppt
- 大小:1.71 MB
- 文档页数:14




兔的固定方法之阿布丰王创作背位固定用棉绳拉住兔的上门牙齿固定于手术台柱上.也可用兔头架,先将兔颈嵌入半圆形铁圈,再将兔嘴套入可调节铁环内.拧紧固定螺丝,再将长柄固定于手术台的定柱上(四)经常使用手术的基本把持1.备皮(1)剪毛法:经常使用于急性实验.用一般弯剪刀贴皮肤依次将手术范围内的皮毛剪去.勿用手提起毛剪之,以免剪破皮肤.(2)拔毛法:适用于年夜、小白鼠和家兔耳缘静脉,以及后肢皮下静脉的注射、取血等.(3)剃毛法:用于年夜植物的慢性实验,用电剃刀顺着毛方向剃毛.(4)脱毛法:用于无菌手术野备皮.小植物脱毛,脱毛剂配方:硫化钠8g,淀粉7g,糖4g,甘油5g,硼酸1g,水75g,调成糊状.用法:先将手术野的毛剪短,后用棉球涂一薄层脱毛剂,2~3分钟后用温水洗净,擦干,涂一薄层油脂.鼠类亦可不用剪毛,直接涂脱毛剂.狗等年夜植物脱毛,配方:硫化碱10g,生石灰15g,加水至100ml拌匀.用法:术者戴耐酸手套,用纱布涂之,使狗毛浸透,等2~3分钟后洗净擦干,涂一薄层油脂.注意切不成在脱毛前用水弄湿脱毛部位,以免脱毛剂渗入毛根造成炎症.2.消毒经常使用于慢性实验,一般用3%碘酊和75%乙醇惯例法消毒.(五)经常使用植物的给药方法及采血方法1.经常使用植物的给药方法(1)淋巴囊内注射法经常使用于蟾蜍.注入药物易于吸收.方法为左手取植物,右手持注射器以150角斜挑刺入尾骨两侧皮下淋巴囊,缓慢推入,量宜小于0.5ml,因植物皮薄,弹性差,拔针后应用棉球按压针孔片刻.(2)皮下注射法经常使用于鼠类、兔、猫、狗等.鼠类注射法为左手提起其头部皮肤,右手握注射器,以约15º角刺入皮下,缓缓注入药液,拔针后轻压针孔.小白鼠注入量应小于0.4ml药液.年夜白鼠、豚鼠要用年夜号针头.鼠类亦可从背部皮下注射,但需两个人合作完成.兔、狗、猫常在背部或年夜腿内侧等皮下脂肪少的部位进行皮下注射,禽类常选翼下注射.(3)肌肉注射法鼠类常选后肢外侧肌肉.兔、猫、狗多选臀部肌肉,鸟类选胸肌和腓肠肌.方法为左手固定植物,右手持注射器,垂直刺入肌肉,缓慢注射,注射完毕用手轻轻推拿注射部位,以利药物吸收.(4)腹腔注射法除蛙类外,几乎所有植物都可使用此法给药.(5)静脉注射法1)鼠类:常选用尾静脉.先将鼠固定于特制的鼠筒内或颠倒的玻璃罩下,使鼠尾外露,用75%乙醇擦之使血管扩张.左手拉住尾端,右手持注射器(4~4.5号针头),以约15º角刺入扩张最明显的血管内,轻推药液,阻力不年夜,血管变色,说明已注入静脉内,如果阻力年夜,局部变白,应重新刺入注射部位先从远端开始,以便失败后逐步上移注射部位.2)狗:常选用前肢内侧的皮下头静脉和后肢外侧的小隐静脉.剪毛消毒,在血管近心端先扎一条绷带,使血管充盈,左手握肢体,拇指向远端轻轻绷紧皮肤,右手持注射器,顺血管方向向心性刺入皮下,沿血管外平行走约0.5cm后,再刺入血管,有回血后即标明进入血管,放松近心端绷带,缓慢注入药液.3)兔:常选用耳缘静脉.先拔毛,左手食指和中指夹住耳缘静脉近心端,使血管充盈;拇指和无名指固定耳朵,并与食、中指绷紧注射部位,右手持注射器,顺血管方向刺入静0.5~1cm,左手固定针头,右手缓慢注射.如阻力年夜或局部肿胀苍白,说明针头在血管外,应重新注射.应从血管远心端开始,以便逐次向近心端重复注射. 2.经常使用的采血方法(1)剪尾采血经常使用于小白鼠和年夜白鼠.小量采血时用本法.固定植物并露出鼠尾,将尾部浸于45º的温水中数分钟(也可用二甲苯棉球擦拭或用灯光照射片刻),使尾部血管扩张,擦干后,用手术剪剪去尾尖0.3~0.6cm,,让血液滴入盛器或直接用吸管吸取.(2)耳缘静脉取血经常使用于家兔.将家兔放在固定箱内,拔毛或用二甲苯棉球擦拭耳廓,使耳部血管扩张,用粗针头刺破耳缘静脉,或用刀片在血管上切口(方向可与血管平行或垂直).血液自然流出.采血完毕,用干棉球压迫止血.(3)心脏取血常需两人合作.一人将植物背位固定,一人持配7号针头的10ml注射器,于胸壁心跳最明显处,将针头刺入心脏,直至取够血量,迅速拔出针头.实验 ABO血型的鉴定实验目的1.学会ABO血型的鉴定方法2.掌握ABO血型的分型依据实验原理根据抗原抗体反应来进行的.红细胞概况存在的特异性抗原决定了血型,而血清中存在着与红细胞自己相对应的抗体,如 A 型血的人其红细胞膜概况存在A 抗原,而血清中则存在B抗体,因此不会发生血液凝集现象.血型是由先天遗传决定的,因此血型的鉴定在鉴定血源关系中有着重要作用.如果同种抗原和抗体同时存在,就会发生抗原抗体的凝集反应,使血细胞凝集,进而呈现溶血反应,危机生命.因此,在临床上,输血前必需进行血型鉴定和交叉配血试验,以确保输血平安.应用标准血清鉴定未知者的血型.实验对象:人实验器材及药品:ABO标准血清、玻璃片、采血针、75%酒精等.实验方法:1.将抗A与抗B标准血清各一滴滴于玻璃片两侧,分别标明“抗A”与“抗B”字样.2.用75%酒精消毒左手无名指端,用一次性采血针刺破皮肤,用平玻璃片两对角分别取血分别放置“抗A”与“抗B”侧血清中并混合均匀.3.室温静止5~10分钟后观察结构.实验结果实验讨论与分析八、注意事项:抗A与抗B血清绝对不能混合;务必分辨清楚是否有凝集现象影响血液凝固的因素目的和原理通过测定分歧条件下的血液凝固时间,了解血液凝固的一些影响因素.血液凝固是一种发生在血浆中有许多因子介入的复杂的生物化学连锁反应过程.其最终结果是血浆中的纤维卵白原酿成纤维卵白,即血浆由流体状态酿成胶冻状态.根据激发凝血反应的原因和凝血酶原复合物形成途径的分歧,可将血液凝固分为内源性凝血系统和外源性凝血系统.内源性凝血系统是指介入凝血过程的全部因子存在于血浆中,而外源性凝血系统是指在组织因子的介入下的血凝过程,凝血时间较前者短.本实验采纳颈动脉放血取血,血液几乎未与组织因子接触,其发生的凝血过程基本上可以看作是由血浆中凝血因子启动的内源性凝血.肺组织浸液含有丰富的组织因子,在血液中加入肺组织浸液时,可以观察外源性凝血系统的作用.血液凝固过程受许多因素的影响,除凝血因子可直接介入血凝过程外,还受温度、接触面光滑度等得影响.器材与药品兔手术台,哺乳植物手术器械1套,动脉夹,动脉插管,20毫升注射器,试管8支,50毫升小烧杯2个,滴管,竹签1支,冰块,棉花.石蜡油,肝素,草酸钾,生理盐水,0.025mol/L CaCL2,20%氨基甲酸乙酯,肺组织浸液.实验对象家兔步伐与方法1.麻醉和固定:用20%氨基甲酸乙酯按每公斤体重1克耳缘静脉麻醉,待植物麻醉后,仰卧固定在兔台上.2.手术:减去颈前部兔毛,颈部正中切口,分离出一侧颈总动脉,头端用线结扎阻断血流,近心端勇动脉夹夹闭动脉,在结扎线下方剪一斜行切口,向心方向拔出动脉插管,予以结扎固定,准备取血之用.3.观察纤维卵白原在凝血过程中的作用:取动脉血10毫升分别注入两小烧杯内,一杯放置,另一杯用竹签或小试管刷不竭搅拌,2-3分钟后,用谁洗净竹签上的血,观察有无纤维蛋鹤发生,经过这样处置的血液是否再会发生凝固?4.将8支试管按下表准备好后,每管加入血液2毫升,即刻开始计时.每个15秒,将试管倾斜一次,观察血液是否凝固,至血液成为凝胶状,试管倒立时血液不流出为止.记下所经历的全程时间,即为凝血时间(见下表)内源性凝血与外源性凝血观察以及理化因素对血凝的影响实验仪器试管编号实验条件凝血时间10毫升试管,每管加血2毫升1 对比管2 粗拙面放棉花少许3 石蜡油润滑内概况4 温度至于370C水浴槽中5 至于成有碎冰块的烧杯中6 加肝素8U(加血后摇匀)7加1%草酸钾2毫升(加血后摇匀)8 肺组织浸液1毫升(加血后摇匀)比力2管和3管,4管和5管,1管和8管得凝血时间,分析发生差另外原因.如果加入肝素及草酸钾管不呈现血凝,两管各加0.025mol/L CaCL2溶液2~3滴,观察血液是否发生凝固?本实验注意事项1.记录凝血时间应力求准确.2.判断凝血的标准要力求一致.一般以倾斜试管达450时,试管内血液不见流动为准.3.合理分工,比较试验的采血时间要紧接着进行.4.每支试管口径年夜小及采血量要相对一致,不成相差太年夜.附:肺组织浸液制备取新鲜兔肺,剪成小块,洗净血液,磨成糊状.加入3-~4倍量的生理盐水,摇匀,放冰箱中过夜,过滤后即可获得肺组织浸液.保管冰箱备用.。




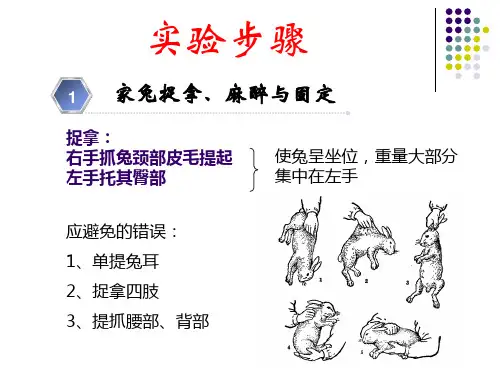
兔的固定方法背位固定用棉绳拉住兔的上门牙齿固定于手术台柱上。
也可用兔头架,先将兔颈嵌入半圆形铁圈,再将兔嘴套入可调节铁环内。
拧紧固定螺丝,再将长柄固定于手术台的定柱上(四)常用手术的基本操作1.备皮(1)剪毛法:常用于急性实验。
用一般弯剪刀贴皮肤依次将手术范围内的皮毛剪去。
勿用手提起毛剪之,以免剪破皮肤。
(2)拔毛法:适用于大、小白鼠和家兔耳缘静脉,以及后肢皮下静脉的注射、取血等。
(3)剃毛法:用于大动物的慢性实验,用电剃刀顺着毛方向剃毛。
(4)脱毛法:用于无菌手术野备皮。
小动物脱毛,脱毛剂配方:硫化钠8g,淀粉7g,糖4g,甘油5g,硼酸1g,水75g,调成糊状。
用法:先将手术野的毛剪短,后用棉球涂一薄层脱毛剂,2~3分钟后用温水洗净,擦干,涂一薄层油脂。
鼠类亦可不用剪毛,直接涂脱毛剂。
狗等大动物脱毛,配方:硫化碱10g,生石灰15g,加水至100ml 拌匀。
用法:术者戴耐酸手套,用纱布涂之,使狗毛浸透,等2~3分钟后洗净擦干,涂一薄层油脂。
注意切不可在脱毛前用水弄湿脱毛部位,以免脱毛剂渗入毛根造成炎症。
2.消毒常用于慢性实验,一般用3%碘酊和75%乙醇常规法消毒。
(五)常用动物的给药方法及采血方法1.常用动物的给药方法(1)淋巴囊内注射法常用于蟾蜍。
注入药物易于吸收。
方法为左手取动物,右手持注射器以150角斜挑刺入尾骨两侧皮下淋巴囊,缓慢推入,量宜小于0.5ml,因动物皮薄,弹性差,拔针后应用棉球按压针孔片刻。
(2)皮下注射法常用于鼠类、兔、猫、狗等。
鼠类注射法为左手提起其头部皮肤,右手握注射器,以约15º角刺入皮下,缓缓注入药液,拔针后轻压针孔。
小白鼠注入量应小于0.4ml药液。
大白鼠、豚鼠要用大号针头。
鼠类亦可从背部皮下注射,但需两个人合作完成。
兔、狗、猫常在背部或大腿内侧等皮下脂肪少的部位进行皮下注射,禽类常选翼下注射。
(3)肌肉注射法鼠类常选后肢外侧肌肉。
兔、猫、狗多选臀部肌肉,鸟类选胸肌和腓肠肌。

药物对家兔血压的影响步骤1、麻醉:称重,耳缘静脉注射2%戊巴比妥钠1.5ml/kg,(注意尽量保留注射部位)眼睑反射消失,四肢无力。
注意事项:p982、固定家兔于手术台:打活结p85(实验结束请把绳子解下来,勿剪断)3、剪毛,暴露手术视野:弯剪4、手术:分离颈总动脉(先完全分离出气管,然后寻找颈动脉)5、动脉插管p295,远心端一定结扎死结,扎牢固,防止动脉剪开时喷血,将换能器中充满肝素钠生理盐水(注意防凝)连接仪器装置(实验结束请将动脉夹保存好)6、实验仪器校准,保存设置文件7、记录一段正常血压曲线(记录收缩压/舒张压/心率)8、兔耳缘静脉给药(用此法给药应保护耳缘静脉,防止之后无静脉注射部位)8、按顺序给药,观察实验现象(注:给药后推注生理盐水1ml使药物全部进入体内;血压恢复稳定后再给下一个药物)造成实验失败的原因主要有以下几个方面:(1)麻醉过深致兔子死亡或不能将兔子麻醉;(2)无从下手或弄得手术区域血肉模糊,使实验无法进行下去;(3)找不到颈总动(静)脉;(4)无法成功进行动脉插管(5)成功插入后脱出。
建议注意内容:1家兔颈部手术实验步骤和相关注意事项1.1手术总原则:思路清晰,有条不紊,小心翼翼。
1.2手术前准备:家兔的麻醉麻醉方式:静脉注射。
注射位置:家兔耳缘静脉(耳朵背面较薄一侧),注射剂量:5ml/k g,多取5ml(不同体质的家兔对麻药的敏感性不同),麻醉程度:浅反射(角膜反射消失);深反射消失(止血钳用力夹后脚趾尖无反应)。
1.3注意事项①注射器的安装和持针方式:针头斜面和注射器刻度面在一个方向上(持针方式见实验指导)。
②耳缘静脉的准备:进针前要使静脉充分充盈。
剪去或拔去静脉处兔毛以暴露之,用大拇指和食指捏住或用适宜的夹子夹住耳根部,另用手指轻轻敲打血管或用温热纱布擦拭。
进针:从血管远心端开始,将针头小心推进1/2长度,正常应无明显阻力且能感觉到针头在一狭小管道中行进,有时有回血。

兔的固定方法背位固定用棉绳拉住兔的上门牙齿固定于手术台柱上。
也可用兔头架,先将兔颈嵌入半圆形铁圈,再将兔嘴套入可调节铁环内。
拧紧固定螺丝,再将长柄固定于手术台的定柱上(四)常用手术的基本操作1.备皮(1)剪毛法:常用于急性实验。
用一般弯剪刀贴皮肤依次将手术范围内的皮毛剪去。
勿用手提起毛剪之,以免剪破皮肤。
(2)拔毛法:适用于大、小白鼠和家兔耳缘静脉,以及后肢皮下静脉的注射、取血等。
(3)剃毛法:用于大动物的慢性实验,用电剃刀顺着毛方向剃毛。
(4)脱毛法:用于无菌手术野备皮。
小动物脱毛,脱毛剂配方:硫化钠8g,淀粉7g,糖4g,甘油5g,硼酸1g,水75g,调成糊状。
用法:先将手术野的毛剪短,后用棉球涂一薄层脱毛剂,2~3分钟后用温水洗净,擦干,涂一薄层油脂。
鼠类亦可不用剪毛,直接涂脱毛剂。
狗等大动物脱毛,配方:硫化碱10g,生石灰15g,加水至100ml 拌匀。
用法:术者戴耐酸手套,用纱布涂之,使狗毛浸透,等2~3分钟后洗净擦干,涂一薄层油脂。
注意切不可在脱毛前用水弄湿脱毛部位,以免脱毛剂渗入毛根造成炎症。
2.消毒常用于慢性实验,一般用3%碘酊和75%乙醇常规法消毒。
(五)常用动物的给药方法及采血方法1.常用动物的给药方法(1)淋巴囊内注射法常用于蟾蜍。
注入药物易于吸收。
方法为左手取动物,右手持注射器以150角斜挑刺入尾骨两侧皮下淋巴囊,缓慢推入,量宜小于0.5ml,因动物皮薄,弹性差,拔针后应用棉球按压针孔片刻。
(2)皮下注射法常用于鼠类、兔、猫、狗等。
鼠类注射法为左手提起其头部皮肤,右手握注射器,以约15º角刺入皮下,缓缓注入药液,拔针后轻压针孔。
小白鼠注入量应小于0.4ml药液。
大白鼠、豚鼠要用大号针头。
鼠类亦可从背部皮下注射,但需两个人合作完成。
兔、狗、猫常在背部或大腿内侧等皮下脂肪少的部位进行皮下注射,禽类常选翼下注射。
(3)肌肉注射法鼠类常选后肢外侧肌肉。
兔、猫、狗多选臀部肌肉,鸟类选胸肌和腓肠肌。
家兔气管插管实验原理家兔气管插管实验是一种常用的实验方法,用于研究家兔气管插管技术和相关疾病的治疗方法。
本实验旨在通过插入气管插管,模拟气管插管手术过程,探究插管对家兔的影响,并验证插管技术的可行性和安全性。
实验前准备:1.选择健康的家兔,体重适中,免疫系统良好。
2.准备麻醉剂和镇痛剂,确保家兔处于无痛苦和镇静状态。
3.准备气管插管器具,包括气管插管管、导丝、插管固定带等。
实验步骤:1.将家兔置于手术台上,进行全身消毒,确保手术场所无菌。
2.使用注射器将麻醉剂和镇痛剂混合后,通过皮下注射给家兔麻醉。
3.等待麻醉剂起效后,将家兔固定在手术台上,保持舒适的体位。
4.使用无菌手套和器具,进行局部消毒,特别是颈部和喉咙区域。
5.用手指按压家兔的气管,找到气管的位置。
6.将气管插管器的导丝插入家兔的气管中,确保导丝顺利通过气管。
7.将气管插管管沿着导丝缓慢插入家兔的气管,直到插管的一端位于气管末端。
8.固定插管,使用插管固定带将插管与家兔的颈部固定,防止插管脱落。
9.观察家兔的呼吸情况和身体反应,确保插管过程没有引起异常情况。
10.实验结束后,将家兔从麻醉状态中唤醒,观察其恢复情况。
实验原理:1.气管插管可以通过人工方式将插管管插入气管,建立起人工通气通道。
这个通道可以用于给家兔提供氧气和麻醉药物,同时也可以用于清除气道分泌物,预防肺部感染等。
2.插管过程中要注意插管管的长度和位置,确保插管的一端位于气管末端,而不是误插入食道或其他部位。
插管的固定带也要正确使用,保证插管不会松脱。
3.气管插管需要经过严格的消毒和无菌处理,以避免引入细菌或其他病原体,导致感染和并发症。
4.实验中的麻醉剂和镇痛剂的使用,可以减轻家兔的痛苦和不适感,同时也使实验操作更加顺利和安全。
实验结果和意义:1.通过家兔气管插管实验,可以验证气管插管技术的可行性和安全性,为临床操作提供依据。
2.实验结果可以帮助研究人员了解插管对家兔的影响,探究插管对气道和呼吸功能的影响,进一步研究相关疾病的治疗方法。
兔的固定方法背位固定用棉绳拉住兔的上门牙齿固定于手术台柱上。
也可用兔头架,先将兔颈嵌入半圆形铁圈,再将兔嘴套入可调节铁环内。
拧紧固定螺丝,再将长柄固定于手术台的定柱上(四)常用手术的基本操作1.备皮(1)剪毛法:常用于急性实验。
用一般弯剪刀贴皮肤依次将手术范围内的皮毛剪去。
勿用手提起毛剪之,以免剪破皮肤。
(2)拔毛法:适用于大、小白鼠和家兔耳缘静脉,以及后肢皮下静脉的注射、取血等。
(3)剃毛法:用于大动物的慢性实验,用电剃刀顺着毛方向剃毛。
(4)脱毛法:用于无菌手术野备皮。
小动物脱毛,脱毛剂配方:硫化钠8g,淀粉7g,糖4g,甘油5g,硼酸1g,水75g,调成糊状。
用法:先将手术野的毛剪短,后用棉球涂一薄层脱毛剂,2~3分钟后用温水洗净,擦干,涂一薄层油脂。
鼠类亦可不用剪毛,直接涂脱毛剂。
狗等大动物脱毛,配方:硫化碱10g,生石灰15g,加水至100ml 拌匀。
用法:术者戴耐酸手套,用纱布涂之,使狗毛浸透,等2~3分钟后洗净擦干,涂一薄层油脂。
注意切不可在脱毛前用水弄湿脱毛部位,以免脱毛剂渗入毛根造成炎症。
2.消毒常用于慢性实验,一般用3%碘酊和75%乙醇常规法消毒。
(五)常用动物的给药方法及采血方法1.常用动物的给药方法(1)淋巴囊内注射法常用于蟾蜍。
注入药物易于吸收。
方法为左手取动物,右手持注射器以150角斜挑刺入尾骨两侧皮下淋巴囊,缓慢推入,量宜小于0.5ml,因动物皮薄,弹性差,拔针后应用棉球按压针孔片刻。
(2)皮下注射法常用于鼠类、兔、猫、狗等。
鼠类注射法为左手提起其头部皮肤,右手握注射器,以约15º角刺入皮下,缓缓注入药液,拔针后轻压针孔。
小白鼠注入量应小于0.4ml药液。
大白鼠、豚鼠要用大号针头。
鼠类亦可从背部皮下注射,但需两个人合作完成。
兔、狗、猫常在背部或大腿内侧等皮下脂肪少的部位进行皮下注射,禽类常选翼下注射。
(3)肌肉注射法鼠类常选后肢外侧肌肉。
兔、猫、狗多选臀部肌肉,鸟类选胸肌和腓肠肌。