氮的氧化物
- 格式:ppt
- 大小:1.07 MB
- 文档页数:38

氮氧化物的来源存在于大气中的氮氧化物有N2O、NO及NO2。
对流层中NO和NO2是污染气体,统称为NOx(氮氧化物)。
氮氧化物的天然源主要是生物源,包括下列来源:1.生物死亡以后机体腐烂形成的硝酸盐,经细菌作用生成的NO及水随后缓慢氧化产生的NO2。
2.生物源产生的NxO氧化形成的NO X。
3.有机体中氨基酸分解产生的氨经OH自由基氧化形成的NO X。
氢氧化物的人为源主要来自矿物燃料在工业窑炉和汽车内燃机中的高温燃烧过程,一般产生的NO X中99%是NO,NO2仅占1%左右。
NO与NO2毒性都很大,NOx能由呼吸侵入人体肺部,对肺组织产生强烈的刺激及腐蚀作用,引起支气管炎、肺炎、肺气肿等疾病,NOX还能和碳氢化物生成光化学烟雾,NO2又是引起酸雨的原因之一。
此外NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
大气中的NOX除被土壤和植被吸收外,一般经气相或液相化学反应,最终转化成HNO3和硝酸盐而除去。
1.N2O的产生N2O(氧化亚氮,俗名笑气)利是自然界微生物活动的产物,大气中含量极微。
它的活性差,在低层大气中被认为是非污染气体。
N2O能吸收地面热辐射,成为对全球气候变暖起重要作用的温室气体。
N2O扩散至平流层后.则发生光解作用N2O+hv→N2+ON2O也可与存在平流层中的氧原子反应而被清除N2O+O→N2+O2N2O+O→NO+NO它对平流层中的臭氧层会发生破坏作用。
后一反应也是存在于平流层中的污染物NO的天然发生源。
2.NO的产生全球NO的总发生量每年约为4.78亿吨。
其中90%来自天然源,主要是大气中NH3的氧化和土壤中含氮物的动生物分解等。
人类活动排放的NO仅占10%。
NO2主要由NO氧化而来,每年产生量约5.68亿吨。
人类活动排入大气中的NO x,一部分来自硝酸厂、氮肥厂、金属冶炼厂等排出的废气,而更主要的来源则是燃料高温燃烧过程。
由于汽油中实际上是不含氮的,因此汽车内燃机内发生的化学反应是空气中氮和氧在高温条件下的直接化会,少量NO进一步氧化成NO2。

氮氧化物的性质氮氧化物,是指由氮和氧元素组成的化合物。
常见的氮氧化物有氮氧化物(NO)、二氧化氮(NO2)和氮氧化氮(N2O)等。
氮氧化物在环境中存在并且对人类健康和大气质量产生严重影响。
首先,氮氧化物是大气中的主要污染物之一。
来源于工业排放、交通尾气和农业活动等。
这些氮氧化物进入大气后,会与其他大气成分发生复杂的化学反应,形成二次污染物,如臭氧和细颗粒物。
这些污染物对人体健康造成很大威胁,特别是对儿童、老年人和患有呼吸系统疾病的人群。
此外,氮氧化物还会造成酸雨的生成,对土壤、水体等生态系统产生负面影响。
其次,氮氧化物对大气环境也产生很大的影响。
二氧化氮是一种有害的大气污染物,容易被光解为一氧化氮和氧气。
一氧化氮参与了大气中的光化学反应,会进一步参与臭氧的形成,造成大气中臭氧层的破坏。
臭氧层的破坏会导致紫外线辐射的增加,对人类的健康和生态系统的平衡产生不利影响。
因此,控制氮氧化物的排放是保护大气环境和臭氧层的重要举措之一。
此外,氮氧化物还会对植物和农作物产生负面影响。
氮氧化物作为氮元素的一种形式,能够为植物提供养分,但过量的氮氧化物会对植物的生长和发育产生抑制作用。
一方面,氮氧化物会破坏植物叶片的叶绿素,导致光合作用受到抑制;另一方面,氮氧化物会与植物体内的其他养分发生反应,影响植物的营养吸收。
这些都会导致农作物的产量下降和质量降低,给农业生产带来一定的损失。
然而,虽然氮氧化物对环境和健康造成不良影响,我们仍然可以采取一些措施来减少氮氧化物的排放。
首先,政府应加强对工业企业和交通尾气的排放标准和监管。
通过强制执行严格的排放标准,可以减少大气中氮氧化物的排放量。
其次,需要加强环保意识的宣传和教育,提高公众对氮氧化物污染的认识,倡导低碳、环保的生活方式。
此外,农业生产中可以采用科学合理的施肥措施,减少氮肥的使用量,从而减少氮氧化物的排放。
总之,氮氧化物作为一种常见的大气污染物,对环境和人类健康产生重要影响。

正五价氮的氧化物
氮氧化物是指氮在氧气或其他氧化剂作用下发生的氧化产物,主要包括一氧化氮(NO)、二氧化氮(NO2)、亚硝酸(HNO2)、亚硝酸盐(NO2-)、硝酸(HNO3)和硝酸盐(NO3-)等化合物。
其中,正五价氮的氧化物主要是硝酸和硝酸盐。
硝酸(HNO3)是一种无色、有刺激性的强酸,它可以由氮气和氧气在高温、高压下反
应生成。
硝酸在工业生产中是一种重要的化工原料,主要用于制造硝酸盐、硫酸硝酸混酸、爆炸药和染料等。
硝酸的化学式为HNO3,分子量为63.01 g/mol。
它可以与水混合,生成
硝酸溶液,其浓度通常用质量分数表示。
硝酸盐(NO3-)是硝酸的盐类,其主要来源是硝酸和硝酸盐还原微生物在土壤中的活动,以及工业废水和污染气体的排放等。
硝酸盐广泛存在于土壤、水体和空气中,对环境
和人类健康有一定的影响。
硝酸盐的化学式为NO3-,分子量为62.00 g/mol,是一种不稳
定的离子。
硝酸和硝酸盐的形成及其在环境中的循环通常被称为氮素循环。
氮素循环是地球上生
物体利用氮元素的过程,包括氮的吸收、固氮、硝化和反硝化等反应。
这些过程中,硝酸
和硝酸盐在生物体内和外扮演着重要的角色,它们可以作为植物和微生物的氮源,并在水
体和土壤中发挥化学和生态作用。
总之,正五价氮的氧化物主要包括硝酸和硝酸盐。
这些化合物在工业和农业生产中广
泛应用,与环境和人类健康密切相关。
为了保护环境和生态系统,我们需要加强硝酸和硝
酸盐排放的控制和管理,推进氮素循环的科学研究和实践应用。



考点1 氮的氧化物1.氮元素有+1、+2、+3、+4、+5等五种正价态,五种正价对应六种氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5。
其中N2O3和N2O5分别是HNO2和HNO3的酸酐。
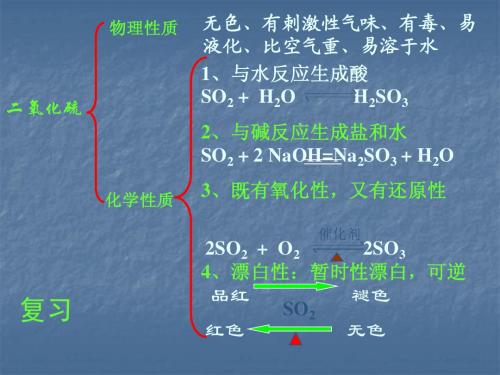
NO是一种无色还原性较强的气体,易被O2氧化生成NO2,NO2是一种红棕色的易溶于水且与水反应的气体,氧化性强,能氧化SO2,能使湿润的KI-淀粉试纸变蓝。
2.NO、NO2都是大气污染物,空气中NO、NO2主要来自石油产品和煤燃烧、汽车尾气以及制硝酸工厂的废气。
其中空气中的NO2是造成光化学烟雾的主要因素。
3.NO、NO2的制法(1)NO的实验室制法①原理:3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O②装置:铁架台、铁夹、铁圈、烧瓶、分液漏斗、胶塞、导管、酒精灯等③收集:排水集气法④检验:无色气体和空气接触立即变红棕色(2)NO2的实验室制法①原理:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O②装置:锥形瓶(或烧瓶)、分液漏斗、带导管胶塞221.氨的物理性质氨气为无色、有刺激性气味的气体,比空气轻,易液化,极易溶于水,氨水的密度小于水的密度,氨水的浓度越大,密度越小。
2.氨的化学性质;(1)与水反应,溶液呈碱性:NH3+H2O NH3·H2O NH4++OH-氨水中所含有微粒:NH3、H2O、NH3·H2O、NH4+、OH-、H+,氨水中溶质通常看作为NH3,而不是NH3·H2O。
(2)与酸反应NH3+HNO3NH4NO3HCl+NH3NH4ClH2SO4+2NH3(NH4)2SO4氨气与氯化氢相遇便产生白烟,可用于NH3与HCl的相互检验。
(3)还原性NH3分子中氮元素呈-3价,具有还原性,能在一定条件下与O2、Cl2、CuO等反应,被它们氧化:2NH3+3Cl2N2+6HCl2NH3+3CuO3Cu+N2+3H2O3.氨气的实验室制法(1)原理:固态铵盐与碱加热反应:2NH4Cl+Ca(OH) 2CaCl2+2NH3↑+2H2O (2)发生装置:固+固+加热型,与制备O2气体相似;(3)收集:向下排空气法。


氮氧化物的化学式氮氧化物的化学式氮氧化物,简称为NOx,是由氮氧化物和氧气在高温和高压下反应而成。
这些化合物包括一氧化氮(NO)、二氧化氮(NO2)以及一些较轻微的亚氮酸和亚氮酸盐等物质。
在化学上,NOx产生的过程相当复杂,它涉及到多个化学反应,其中包括氧化、还原和酸化等过程。
下面我们将按照类别来看看氮氧化物在不同环境中的形成和影响。
1. 空气污染氮氧化物是导致空气污染的主要化学物质之一。
在城市中,汽车尾气是主要的来源之一。
随着人们的生活水平的提高,汽车数量的增加导致了NOx的排放量的急剧上升。
NOx会与其他空气污染物质(如挥发性有机化合物和颗粒物)混合在一起,形成臭氧和其他化学物质,对人体健康造成危害。
2. 农业氮氧化物在农业中也占有重要地位,它主要来自化肥和畜牧业的排放。
当大量的化肥被农作物土壤吸收后,其中的氨气等物质会转化为NOx。
对于畜牧业,大量放牧和排污是NOx的主要来源之一。
这些化合物对农作物的生长和土壤的质量产生很大的影响。
3. 工业氮氧化物在工业生产中也极为普遍。
燃烧煤炭、石油和天然气等化石燃料时也会产生大量的NOx。
此外,某些化学工业中也会大量排放NOx。
这些化合物的排放会对大气、土壤和水体产生不同程度的影响。
虽然氮氧化物对环境有着不小的危害,但我们可以采取一些措施来减少其排放量。
在交通运输方面,政府可以制定更为严格的排放标准,以减少车辆尾气的含量。
在农业方面,化肥和畜牧业排放的管理和监管需要加强。
在工业制造中,可以使用更加清洁的能源,如太阳能和风能。
这些措施虽然在操作上可能会带来一定的成本,但这些成本却远远低于环境污染和健康问题的代价。
总之,氮氧化物虽然是一种普遍存在于我们生活中的化合物,但我们需要认识到它产生的过程和影响。
在实际操作上,我们需要采取一些功效明显,同时造价合理的措施来降低其排放,保护我们的环境和健康。

氮氧化物自分解
氮氧化物是一类由氮和氧元素组成的化合物,常见的有一氧化氮(NO)、二氧化氮(NO2)和氮氧化物(N2O)。
在大气中,氮氧化物是一种重要的污染物,对环境和人类健康产生负面影响。
氮氧化物的自分解是指它们在特定条件下分解为氮气和氧气的过程。
这个过程主要发生在大气中,但也可以在其他环境中发生。
在大气中,光照、温度和存在其他化合物的存在会影响氮氧化物的自分解速率。
当太阳光照射到大气中的氮氧化物时,它们会吸收光能并发生分解反应。
一氧化氮可以通过以下反应自分解为氮气和氧气:
2NO → N2 + O2
而二氧化氮可以通过以下反应自分解为一氧化氮和氧气:
2NO2 → 2NO + O2
这些反应是通过光解来实现的,即光照提供了所需的能量来打破氮氧化物分子中的化学键。
分解过程中产生的氮气和氧气是大气中的常见成分,对环境没有负面影响。
值得注意的是,氮氧化物的自分解速率受到温度的影响。
在较高的温度下,氮氧化物的自分解速率更快。
因此,在暖季节或温暖地区,氮氧化物的自分解速率可能更高。
氮氧化物的自分解也受到其他化合物的影响。
一氧化氮和二氧化氮可以与其他化合物发生反应,形成新的化合物。
这些反应可能会影响氮氧化物的自分解速率和路径。
氮氧化物的自分解是一个重要的过程,有助于维持大气中的氮气和氧气平衡。
了解氮氧化物的自分解过程对于研究大气污染和环境保护具有重要意义。
我们需要采取措施减少氮氧化物的排放,以保护环境和人类健康。

氮氧化物成分一、前言氮氧化物是大气中的一种污染物,对环境和人类健康都有很大的危害。
因此,研究氮氧化物的成分和来源对于减少空气污染具有重要意义。
本文将详细介绍氮氧化物的成分。
二、什么是氮氧化物1. 概念氮氧化物(NOx)是指由氮和氧元素组成的一类化合物,包括一氧化氮(NO)、二氧化氮(NO2)、亚硝酸盐(NOx-)和硝酸盐(NO3-)等。
2. 物理性质一般情况下,NOx呈无色或淡黄色的有刺激性臭味的烟雾状气体。
在常温下,NOx具有较高的反应活性,易于与其他物质发生反应。
三、主要成分及来源1. 一氧化氮(NO)一氧化氮是最简单的一种NOx,也是最常见的一种。
它主要来自于燃料燃烧过程中空气中的N2与O2反应生成。
此外,在闪电过程中也会产生少量的NO。
2. 二氧化氮(NO2)二氧化氮是一种有毒的红棕色烟雾状气体。
它主要来源于一氧化氮和空气中的O3反应生成。
此外,在高温燃烧过程中也会产生少量的NO2。
3. 亚硝酸盐(NOx-)亚硝酸盐是指一些含有亚硝基(-NO)的化合物,如亚硝酸、亚硝酸钠等。
它们主要来自于工业废水、农业污染和大气沉降等。
4. 硝酸盐(NO3-)硝酸盐是指一些含有硝基(-NO2)的化合物,如硝酸、硝酸钠等。
它们主要来自于工业排放、汽车尾气和农业污染等。
四、影响因素1. 温度在高温下,燃料燃烧反应速率加快,生成的NOx也会增加。
2. 空气比空气比越高,生成的NOx就越多。
3. 氧浓度在充足的O2存在下,生成的NOx也会增加。
4. 燃料类型不同的燃料生成NOx的量也不同。
例如,石油和天然气中的NOx含量较低,而煤中的NOx含量较高。
五、总结通过以上介绍,我们可以了解到氮氧化物是由多种化合物组成的一类污染物。
它们主要来自于工业排放、汽车尾气和农业污染等。
此外,温度、空气比、氧浓度和燃料类型等因素也会影响NOx的生成量。
为了减少空气污染,我们需要采取相应措施来降低NOx的排放量。

氮气及其氧化物1.氮气2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成NO和NO2的比较表:NO NO 2物理性质颜色无色红棕色毒性有毒有毒溶解性不溶能溶化学性质与O2反应2NO+O2===2NO2与H2O反应3NO2+H2O===2HNO3+NO与人体、环境的关系①与血红蛋白结合使人中毒②转化成NO2形成酸雨、光化学烟雾形成酸雨、光化学烟雾(2)空气中NO2是造成光化学烟雾的主要因素。
(3)空气中NO、NO2主要来源于煤和石油的燃烧、汽车尾气、硝酸工厂等。
(4)NO2:既有氧化性又有还原性,以氧化性为主。
NO2能使湿润的淀粉-KI试纸变蓝。
深度思考1.根据氮在元素周期表中的位置可知氮元素是一种活泼的非金属,为什么氮气很稳定?答案氮气的性质不仅与原子结构有关,还与氮分子的构成有关;氮气分子中的N≡N键,键能很大,分子结构稳定,故氮气很稳定。
2.俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮,请同学们写出三个有关的化学方程式:(1)________________________________________________________________________;(2)________________________________________________________________________; (3)________________________________________________________________________。
答案 (1)N 2+O 2=====放电或高温2NO (2)2NO +O 2===2NO 2(3)3NO 2+H 2O===2HNO 3+NO 3.如何鉴别NO 2与溴蒸气?答案 由于NO 2和Br 2在性质上有不少相似性:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。



三氧化二氮三氧化二氮分子模型三氧化二氮,氮的氧化物,一种酸性氧化物,有毒,环境污染物之一,是亚硝酸的酸酐,可溶于苯、乙醚、氯仿(三氯甲烷)、四氯化碳(四氯甲烷)、酸碱不稳定,常压下即可分解为一氧化氮和二氧化氮。
三氧化二氮助燃,有毒。
对环境有危害,对水体、土壤和大气可造成污染。
分子式:N₂O₃摩尔质量:76.01 g mol-1三氧化二氮的生成外观:红棕色气体,低温时为深蓝色挥发性液体或蓝色固体。
密度:1.4 g/mL (液) 熔点:−100.1°C (173.05 K) 沸点:3°C (276 K) CAS No:10544-73-7结构两个氮原子通过σ共价键相连,在整个分子中存在着一个五中心六电子的离域大π键。
氮的氧化数为+3。
亚硝酸的酸酐是三氧化二氮其实就是N2O3先和水反应:N2O3+H2O=2HNO2Na2O2和水反应:2Na2O2+2H2O=4NaOH+O2然后以上生成的酸HNO3和碱NaOH反应中和反应所以。
总方程式是:2Na2O2+2N2O3 = 4NaNO2 +O2制取将等物质的量的一氧化氮和二氧化氮在低温(-21°C)混合可以得到三氧化二氮:实验室制取三氧化二氮的试验NO + NO₂==可逆==N₂O₃化学产品信息第一部分:化学品名称化学品中文名称:三氧化二氮化学品英文名称:nitrogen trioxide 中文名称2:亚硝酸酐分子结构:N原子以sp2杂化轨道成键,分子为平面形分子。
英文名称2:nitrous anhydride 技术说明书编码:73 CAS No.:分子式:N₂O₃分子量:76.02第二部分:成分/组成信息有害物成分CAS No. 三氧化二氮第三部分:危险性概述危险性类别:侵入途径:健康危害:氮氧化物主要损害呼吸道。
吸入初期仅有轻微的眼及呼吸道刺激症状,如咽部不适、干咳等。
常经数小时至十几小时或更长时间潜伏期后发生迟发性肺水肿、成人呼吸窘迫综合征,出现胸闷、呼吸窘迫、咳嗽、咯泡沫痰、紫绀等。
