高中化学推断题复习专题(经典)
- 格式:doc
- 大小:2.17 MB
- 文档页数:28
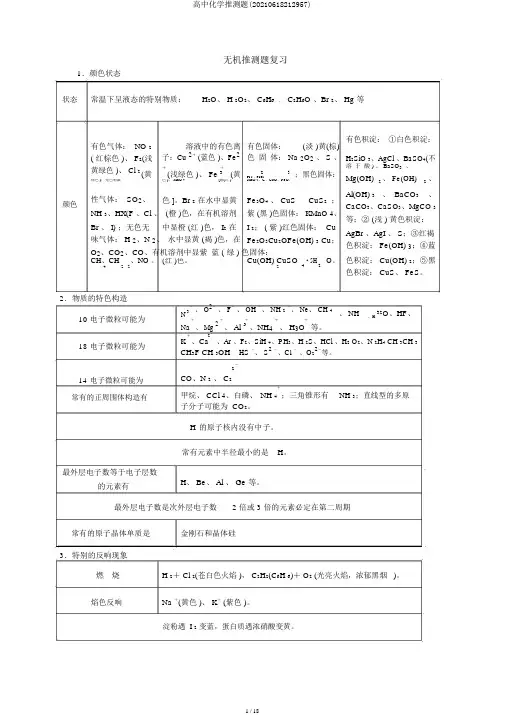
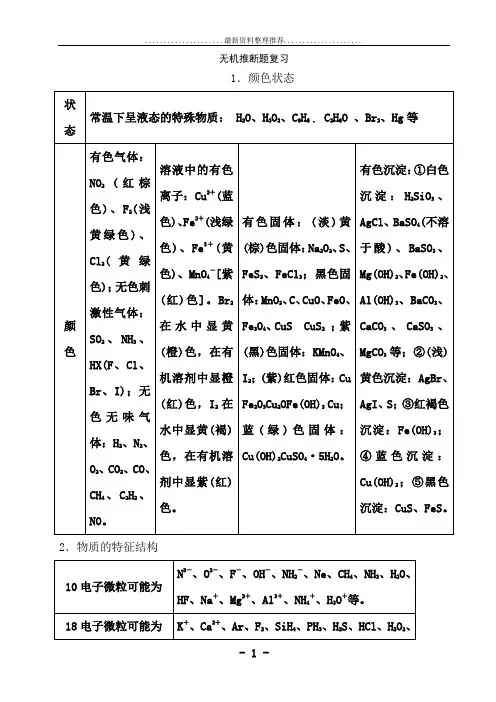
无机推测题复习1.颜色状态状态颜色常温下呈液态的特别物质:H2O、 H 2O2、 C6H6、 C2H6O 、Br 2、 Hg 等有色气体: NO 2溶液中的有色离有色固体:(淡 )黄(棕)有色积淀:①白色积淀:H2SiO 3、AgCl 、BaSO4(不( 红棕色 )、 F2(浅子:Cu 2+ (蓝色 )、Fe2色固体: Na 2O2、 S 、黄绿色 )、 Cl 2++溶于酸 ) 、 BaSO3、(黄(浅绿色 )、 Fe3(黄23;黑色固体:FeS 、FeCl Mg(OH)2、 Fe(OH)2、绿色 );无色刺激色 )、 MnO 4-[紫(红 )MnO 2、C、CuO、FeO、性气体: SO2、色 ]。
Br 2在水中显黄Fe3O4、 CuS CuS2;Al(OH) 3、 BaCO3、CaCO3、CaSO3、MgCO 3 NH 3、HX(F 、Cl 、 (橙 )色,在有机溶剂紫 (黑 )色固体: KMnO 4、等;② (浅 ) 黄色积淀:Br 、 I) ;无色无中显橙 (红 )色, I2在I 2; ( 紫 )红色固体: CuAgBr 、AgI 、 S;③红褐味气体: H 2、N 2、水中显黄 (褐 )色,在Fe2O3Cu2OFe(OH) 3 Cu;色积淀: Fe(OH) 3;④蓝O2、CO2、CO、有机溶剂中显紫蓝 ( 绿 ) 色固体:色积淀: Cu(OH) 2;⑤黑CH、CH、NO 。
(红 )色。
Cu(OH) CuSO4·5H2O。
4222色积淀: CuS、 FeS。
2.物质的特色构造10电子微粒可能为18电子微粒可能为14电子微粒可能为常有的正周围体构造有N3-、 O2-、 F-、 OH -、 NH 2-、 Ne、 CH 4、 NH32O、HF、、 H +、 Mg 2++++等。
Na、 Al 3、NH4、 H3OK+2+、Ar 、F2、SiH 4、PH3、H 2S、HCl 、H2 O2、N 2H4 CH 3CH 3、CaCH3F CH 3OH HS -、 S2-、Cl -、O22-等。
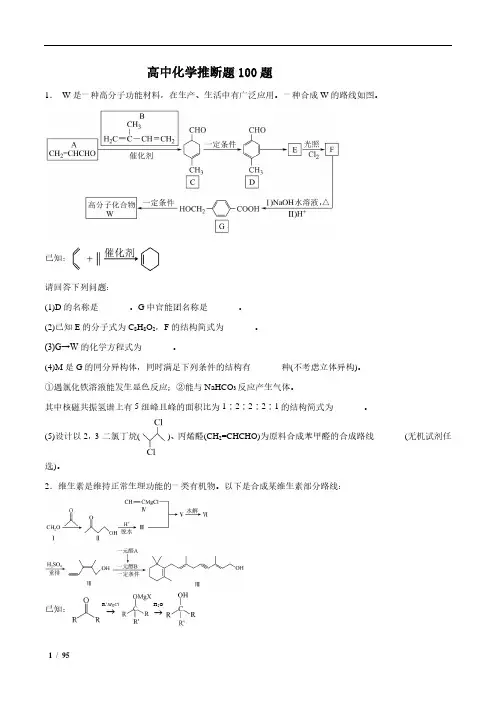
高中化学推断题100题1. W 是一种高分子功能材料,在生产、生活中有广泛应用。
一种合成W 的路线如图。
已知:请回答下列问题:(1)D 的名称是_______。
G 中官能团名称是_______。
(2)已知E 的分子式为C 8H 8O 2,F 的结构简式为_______。
(3)G→W 的化学方程式为_______。
(4)M 是G 的同分异构体,同时满足下列条件的结构有_______种(不考虑立体异构)。
①遇氯化铁溶液能发生显色反应;②能与NaHCO 3反应产生气体。
其中核磁共振氢谱上有5组峰且峰的面积比为1∶2∶2∶2∶1的结构简式为_______。
(5)设计以2,3-二氯丁烷()、丙烯醛(CH 2=CHCHO)为原料合成苯甲醛的合成路线_______(无机试剂任选)。
2.维生素是维持正常生理功能的一类有机物。
以下是合成某维生素部分路线:已知:R MgCl'→2H O→(1)化合物Ⅶ的分子式为________,该分子中处在同一平面的碳原子数为________。
(2)分析一元醛A 的结构特征,预测其可能的化学性质,完成下表 序号 结构特征 反应的试剂 反应形成的新结构 反应类型① -CHO Ag(NH 3)2OH _____ _____ ②_____________________(3)写出由化合物Ⅲ和Ⅳ反应生成化合物V 的方程式:________。
(4)化合物Ⅱ的同分异构体中能发生银镜反应但不能发生水解反应的共________种,其中核磁共振氢谱有3组峰,且峰面积比为6:1:1的同分异构结构简式为________。
(5)聚苯乙烯树脂是一种良好的保温材料,请以苯甲醛为原料,设计路线合成其单体苯乙烯____,其他试剂任选。
3.化合物H 是用于合成某种镇痛药的医药中间体,利用烃A 合成H 的某路线如下图所示:已知:Fe/HCl22R NO R NH ⎯−−⎯⎯→ 回答下列问题:(1)A 的化学名称为___________;D 中的官能团名称为___________。

高考化(Hua)学有机推断题,含答案一、有机推(Tui)断题题型分析1、出(Chu)题的一般形式是推导有机物的结(Jie)构,写同分异构体、化学方程式、反应(Ying)类型及判断物质的性质。
2、经常围绕乙烯、苯及其同系物、乙醇等这些常见物质为中心的转化和性质来考察。
【经典习题】请观察下列化合物A —H 的转换反应的关系图(图中副产物均未写出),请填写:(1)写出反应类型:反应① ;反应⑦ 。
(2)写出结构简式:B ;H 。
(3)写出化学方程式:反应③ ;反应⑥ 。
解析:本题的突破口有这样几点:一是E 到G 连续两步氧化,根据直线型转化关系,E 为醇;二是反应条件的特征,A 能在强碱的水溶液和醇溶液中都发生反应,A 为卤代烃;再由A 到D 的一系列变化中碳的个数并未发生变化,所以A 应是含有苯环且侧链上含2个碳原子的卤代烃,再综合分析可得出结果。
二、有机推断题的解题思路解有机推断题,主要是确定官能团的种类和数目,从而得出是什么物质。
首先必须全面地掌握有机物的性质以及有机物间相互转化的网络,在熟练掌握基础知识的前提下,要把握以下三个推断的关键:1、审清题意 (分析题意、弄清题目的来龙去脉,掌握意图)2、用足信息 (准确获取信息,并迁移应用)3、积极思考 (判断合理,综合推断)①浓NaOH 醇溶液△BA CDEFGH (化学式为C H O )C 6H 5-C 2H 5②Br 2 CCl 4③浓NaOH 醇溶液△④足量H 2 催化剂⑤稀NaOH 溶液△⑥ O 2 Cu △⑦ O 2 催化剂⑧乙二醇 浓硫酸△根据以上的思维判断,从中抓住问题的突破(Po)口,即(Ji)抓住特征(Zheng)条件(特殊性质或(Huo)特征反应 。
但有机物的特征条件并非都有,因此(Ci)还应抓住题给的关系条件和类别条件。
关系条件能告诉有机物间的联系,类别条件可给出物质的范围和类别。
关系条件和类别条件不但为解题缩小了推断的物质范围,形成了解题的知识结构,而且几个关系条件和类别条件的组合就相当于特征条件。

(一)元素推断题1、周期表前20号元素中,它们形成离子化合物时,原子数之比为1﹕2,且阴阳离子的电子层结构相同。
写出这些化合物的化学式__________________________________________ 。
2、A 、B 两元素,A 的原子序数为X,A 、B 所在周期的元素种类分别为m 和n ,若A 和B 同主族,当B 在A 的上一周期时,B的原子序数为__________________。
B 在A 的下一周期时,B 的原子序数为_____________。
3、A 、B 、C 、D 为短周期元素,A 和B 同周期相邻,A 和C 同主族相邻,ABC 三种元素的原子序数之和为31,D 元素与ABC 既不同周期又不同主族,请回答:(1)元素符号 A ________B _________C_________D____________ . (2)A 、B 、D 组成为D 4B 2A 3的离子化合物,其水溶液的PH 值小于7的原因是(3)比较B 、D 形成的化合物与A 、D 形成的阴离子结合质子能力强弱_______. 请用方程式表示_____________________________________________________________(4)用电子式表示D 2A 形成过程___________________________________________。
4.有A 、B 、C 、D 四种短周期的非金属元素(其单质也可分别用A 、B 、C 、D 表示),四种元素的原子序数按B 、D 、C 、A 顺序增大,D 、C 元素在周期表中位置相邻。
在一定条件下,B 可以分别和A 、C 、D 化合生成甲、乙、丙化合物,C 和D 化合可得丁。
已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:请填写下列空格:(1)甲的浓溶液与一种黑色粉末共热可得A ,则甲为_______,乙为___________。

高考化学中的推断题知识点高考化学考试中,推断题是考查学生综合运用知识和推理能力的题型之一。
掌握推断题的解题方法和相关知识点对于提高化学成绩起到关键作用。
本文将介绍一些常见的高考化学中的推断题知识点。
一、酸碱中和反应的推断题在酸碱中和反应中,通常会涉及到物质的酸碱性质、物质的中和反应以及酸碱指示剂的转变等内容。
对于推断题而言,考查学生对酸碱中和反应的认识和应用能力。
例如,一道典型的推断题如下:已知一种酸H₂A与一种碱M(OH)₂进行中和反应,产生的盐是M(HA)₂。
则可以推断的是:A. 酸H₂A的化学式为HA;B. 酸H₂A的酸性比碱M(OH)₂强;C. 碱M(OH)₂的化学式为M(OH)₂;D. 碱的酸性比酸强。
解题分析:根据题目中给出的已知条件,可以推断出酸的化学式为HA,碱的化学式为M(OH)₂。
因此,选项A和C是正确的。
选项B 和D与已知条件不符,因此是错误的。
二、氧化还原反应的推断题氧化还原反应是化学中的重要反应类型之一,在高考化学考试中也经常涉及到推断题。
对于氧化还原反应的推断题而言,考查学生对于反应的类型、物质的氧化还原状态等方面的理解和应用能力。
例如,一道典型的推断题如下:已知物质A经与氧气反应生成B,并且物质A是一种氧化剂。
则可以推断的是:A. 物质B的氧化数为正;B. 反应属于氧化还原反应;C. 物质A的氧化数增大;D. 反应是一个加热反应。
解题分析:根据题目中给出的已知条件,物质A是一种氧化剂,说明在反应中,物质A被还原,氧化数减小。
因此,选项C是正确的。
根据题目中给出的反应类型,物质A与氧气反应生成B,是氧化还原反应。
因此,选项B是正确的。
选项A是不正确的,因为根据已知条件无法推断物质B的氧化数。
选项D也是不正确的,因为已知条件中并没有提到反应需要加热。
三、物质性质的推断题物质的性质是化学考试中的重要内容,对于推断题而言,考查学生对于物质性质的认识和应用能力。
例如,一道典型的推断题如下:已知物质A与物质B反应生成物质C,物质C能与物质D反应生成沉淀。
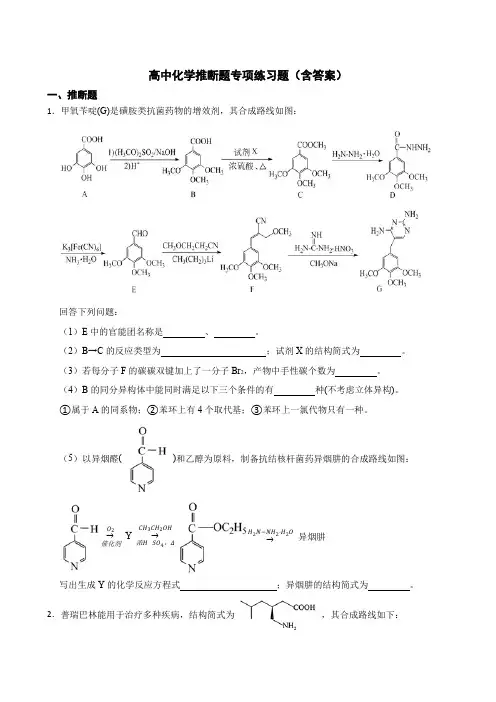
高中化学推断题专项练习题(含答案)一、推断题1.甲氧苄啶(G)是磺胺类抗菌药物的增效剂,其合成路线如图:回答下列问题:(1)E 中的官能团名称是 、 。
(2)B→C 的反应类型为 ;试剂X 的结构简式为 。
(3)若每分子F 的碳碳双键加上了一分子Br 2,产物中手性碳个数为 。
(4)B 的同分异构体中能同时满足以下三个条件的有 种(不考虑立体异构)。
①属于A 的同系物;②苯环上有4个取代基;③苯环上一氯代物只有一种。
(5)以异烟醛( )和乙醇为原料,制备抗结核杆菌药异烟肼的合成路线如图:→催化剂O 2Y →浓H SO 4,ΔCH 3CH 2OH →H 2N−NH 2·H 2O 异烟肼写出生成Y 的化学反应方程式 ;异烟肼的结构简式为 。
2.普瑞巴林能用于治疗多种疾病,结构简式为 ,其合成路线如下:(1)普瑞巴林分子所含官能团的名称为。
(2)化合物A的命名为。
(3)B→C的有机反应类型为。
(4)写出D→E的化学反应方程式。
(5)E~G中,含手性碳原子的化合物有(填字母)。
(6)E→F反应所用的化合物X的分子式为C5H10O,该化合物能发生银镜反应,写出其结构简式,化合物X的含有碳氧双键( )的同分异构体(不包括X、不考虑立体异构)数目为,其中核磁共振氢谱中有两组峰的为(写结构简式)。
(7)参考以上合成路线及反应条件,以和必要的无机试剂为原料,合成,在方框中写出路线流程图。
3.中华裸蒴中含有一种具有杀菌活性的化合物J,其合成路线如下:已知:回答下列问题:(1)D中含氧官能团的名称为;J的分子式为。
(2)A的两种同分异构体结构分别为和,其熔点M N(填“高于”或“低于”)。
(3)由A生成B的化学方程式为。
(4)由B生成C的反应类型为。
(5)G的结构简式为。
(6)F的同分异构体中,含有苯环、−NH2,且能发生银镜反应的有种;其中核磁共振氢谱峰面积之比为2∶2∶2∶2∶1的同分异构体的结构简式为。

元素推断题题目大全高中1. 推断该元素是碱金属还是碱土金属2. 推断该元素的周期3. 推断该元素在同一周期中的布居规律4. 推断该元素的电子亲和能力5. 推断该元素的电离能力6. 推断该元素的电负性7. 推断该元素的原子半径8. 推断该元素的离子半径9. 推断该元素是单质还是化合物10. 推断该元素在自然界中的存在形式11. 推断该元素的合成方法12. 推断该元素的物理性质13. 推断该元素的化学性质14. 推断该元素的氧化态范围15. 推断该元素的反应活性16. 推断该元素的应用领域17. 推断该元素对人体的影响18. 推断该元素的放射性质19. 推断该元素在核反应中的应用20. 推断该元素的稳定性。
1. 推断该元素是碱金属还是碱土金属这个推断可以根据该元素所在的周期表位置进行判断。
如果在第一和第二周期,这个元素很可能是碱金属;如果在第三到第八周期,这个元素可能是碱土金属或其他元素。
如果推断不出来,可以进一步查找该元素物理化学特征。
2. 推断该元素的周期这个推断可以根据该元素的原子序数进行判断。
每个元素原子序数都唯一,按顺序排列即为周期,可以通过周期表示或周期表来进行确认。
3. 推断该元素在同一周期中的布居规律元素在同一周期中的电子数相同,通常遵循A型布局规律,即元素的外层电子排布规律为$s^1$、$s^2p^1$、$s^2p^2$、$s^2p^3$、$s^2p^4$、$s^2p^5$和$s^2p^6$。
该元素的布局规律可以根据其所处的周期表序数来推断。
4. 推断该元素的电子亲和能力电子亲和能力指的是原子能够吸收电子形成阴离子的程度。
如果原子能够轻松地接受电子,那么它的电子亲和能力就会比较高。
可以通过该元素的电子结构、化学成分、原子数和元素周期来推断该元素的电子亲和能力。
5. 推断该元素的电离能力电离能力指的是从原子中脱离电子所需的能量。
如果原子的电离能力很高,说明它的化学反应比较不活泼;如果电离能力很低,说明它的化学反应比较活泼。

元素推断题题目大全(高中)1. 共价键的形成a)请解释以下现象:当非金属元素氧气与非金属元素氮气发生反应时,形成的化合物具有共价键。
b)钠和氯发生反应后形成氯化钠,请推断氯化钠中的键属于何种类型。
2. 化学键类型的区分请推断以下键属于何种类型:a)氧气分子中的键b)氢气分子中的键c)氯气分子中的键3. 键的极性推断请根据以下化学反应推断键的极性:a)氯气和氢气反应生成氢氯酸b)氮气和氢气反应生成氨c)氧气和氢气反应生成水4. 电子云的推断请推断以下分子的电子云构型:a)氯气分子b)甲烷分子c)水分子5. 化学键的强度推断请根据以下化合物的键类型和键的长度,推断它们的化学键强度:a)氢氧化钠(NaOH)b)硝酸(HNO3)c)硫酸(H2SO4)6. 键的解离能推断请根据以下化合物的键的解离能推断它们的稳定性:a)氯化钠(NaCl)b)硝酸(HNO3)c)亚硝酸(HNO2)7. 分子的几何形状推断请根据以下分子的电子云构型推断它们的几何形状:a)二氧化碳分子b)氨分子c)水分子8. 共振结构的推断请根据以下化合物的共振结构推断哪些分子存在共振:a)苯分子b)范甘环分子c)腺嘌呤分子9. 分子极性的推断请根据以下化合物的电子云构型推断它们是否是极性分子:a)二氯甲烷(CH2Cl2)b)三氟甲烷(CHF3)c)四氟化碳(CF4)10. 反应类型的推断请根据以下化学方程式推断反应的类型(酸碱反应、氧化还原反应或置换反应):a)铁与硫酸反应生成硫酸铁b)硝酸和氢氧化钠反应生成水和硝酸钠c)氯气和钠反应生成氯化钠以上是一些高中化学中常见的元素推断题目,希望能对你的学习有所帮助!。

_ 。
4.根据周期表对角线法则,金属Be和Al单质及化合物性质相似,又知AlCl3的熔沸点低,容易升华。
试回答下列问题:(1)写出Be和氢氧化钠反应生成Na2BeO2的离子方程式。
(2)Be(OH)2和Mg(OH)2可以用试剂鉴别,其离子方程式为。
(3)BeCl2是(填离子或共价)化合物,推测BeCl2水溶液在常温下的pH 5(填“大于“等于”“小于”)。
(4)Li和Mg根据对角线法则,性质也相似,Li在空气中燃烧,主要产物的化学式为,同时还有少量的生成。
5.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为。
(2)W与Y可形成化合物W2Y,用电子式表示该化合物的形成过程:。
(3)X的硝酸盐水溶液显性,用离子方程式解释原因:(4)Y与氢元素形成化合物H2Y,该化合物的电子式为。
(5)比较Y、Z气态氢化物的稳定性:> (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是> > > 。
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。
写出该反应的热化学方程式:。
(8)W与氧元素形成离子化合物W2O2,该化合物中阴离子与阳离子个数比为。
(9)某种金属元素与Y的单质化合生成+2价的硫化物,与Z的单质化合生成+3价的氯化物,则该金属在元素周期表处于周期族。
6.(14分)A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为。
(2)由A、B、W三种元素组成的18电子微粒的电子式为。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式。
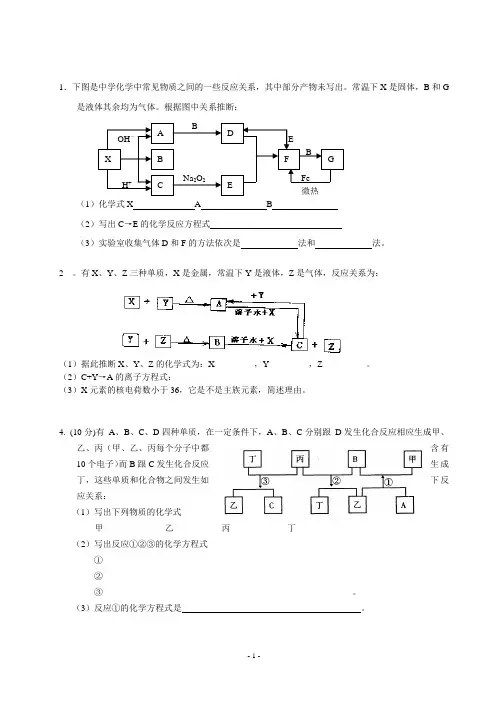
1.下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。
常温下X 是固体,B 和G是液体其余均为气体。
根据图中关系推断: (1)化学式X A B(2)写出C →E 的化学反应方程式(3)实验室收集气体D 和F 的方法依次是 法和 法。
2 。
有X 、Y 、Z 三种单质,X 是金属,常温下Y 是液体,Z 是气体,反应关系为:(1)据此推断X 、Y 、Z 的化学式为:X_________,Y_________,Z__________。
(2)C+Y →A 的离子方程式:___________________________________________ (3)X 元素的核电荷数小于36,它是不是主族元素,简述理由。
___________________________________________________________________________ ________________________________4. (10分)有 A 、B 、C 、D 四种单质,在一定条件下,A 、B 、C 分别跟 D 发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B 跟C 发生化合反应生成丁,这些单质和化合物之间发生如下反应关系:(1)写出下列物质的化学式甲______________乙___________丙_____________丁_____________ (2)写出反应①②③的化学方程式①____________________________________ ②_________________________________________③_________________________________________________________。
(3)反应①的化学方程式是 。
XOH-H + A B CBNa 2O 2DEFGFe 微热BE5.(14分)A、B、C、是单质,X、Y、Z、H、J、L是化合物,组成B的元素是绿色植物生活所必需的微量元素之一,且B在空气中燃烧可以得到X和J,X和J均为固体,X水解可生成两种碱性物质。
无机推断题复习1.颜色状态2.物质的特征结构3.特殊的反应现象4.特征反应(中学)5.置换反应的类型6.分步氧化的几种情况7.特殊的反应条件8 (1)与碱反应产生气体⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质铵盐:O H NH NH 234+↑−→−+碱 (2)与酸反应产生气体①⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓 ②()()()⎪⎪⎩⎪⎪⎨⎧↑−→−↑−→−↑−→−+++------2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物9.物质组成的特殊配比能形成原子个数比为2:1或1:1的特殊化合物有:Na2O、Na2O2类,H2O、H2O2类,CaC2、C2H4、C2H2、C6H6类。
10.物质间的一些特殊转化关系物质间的转化关系是解无机推断题的精髓,除了熟记一般的转化网络如“铝三角”、“铁三角”等外,还要了解一些特殊的转化关系,例如:11.与工业生产相关的主要反应工业制玻璃Na2CO3+SiO2Na2SiO3+CO2↑;CaCO3+SiO2CaSiO3+CO2↑工业制硫酸4FeS2+11O22Fe2O3+8SO2(或S+O2SO2);2SO2+O22SO3;SO3+H2O H2SO4工业制粗硅SiO2+2C Si+2CO↑一、卤素二、碳族元素高温高温高温点燃催化剂△高温①Cl2+H2O=HCl+HClO②Cl2+2NaOH=NaCl+NaClO+H2O①2Fe2++Cl2=2Fe3++2Cl-②2I-+Cl2=I2+2Cl-③S2-+Cl=S↓+2Cl-HClHClOH+ZnOH-NH3CaCO3HH ONH+COCl-Ag+MnO2AgCCC2H5OHC2H5C取代CH=CHC加成CH CHAgNO3Ca(OH)2光H+、CO2电解NaAgNO3Cl2Ca(Cl氧化性KMnO4、电解H2S、HBr、HI还原性化合物金属①2Fe+3Cl2=2FeCl3非金①自身氧化NaCAgC【知识网络】三、氮族元素【知识网络】易错指津1.氨水显弱碱性的理解不全面。
高中化学推断题试题及答案试题:在一次化学实验中,我们有五种无色溶液:A. 硫酸铜溶液,B. 氢氧化钠溶液,C. 碳酸钠溶液,D. 硫酸溶液,E. 氯化钡溶液。
实验中观察到以下现象:1. 溶液A与溶液B混合时,产生蓝色沉淀。
2. 溶液A与溶液C混合时,也产生蓝色沉淀。
3. 溶液B与溶液D混合时,没有明显现象。
4. 溶液C与溶液D混合时,产生气泡。
5. 溶液D与溶液E混合时,产生白色沉淀。
请根据以上现象推断出五种溶液的化学成分。
答案:根据实验现象,我们可以逐一推断出每种溶液的成分:1. 溶液A与溶液B混合产生蓝色沉淀,这是典型的硫酸铜与氢氧化钠反应生成氢氧化铜蓝色沉淀的现象。
因此,我们可以推断溶液A是硫酸铜溶液,溶液B是氢氧化钠溶液。
2. 溶液A与溶液C混合同样产生蓝色沉淀,这进一步验证了溶液A是硫酸铜溶液,同时表明溶液C也是氢氧化钠溶液。
但根据题目,我们知道溶液B和C是不同的,所以这里存在一个矛盾。
但考虑到实验现象的描述,我们可以假设溶液C实际上是碳酸钠溶液,因为碳酸钠与硫酸铜也能生成蓝色沉淀的碳酸铜。
3. 溶液B与溶液D混合没有明显现象,这表明溶液D不是硫酸铜,因为硫酸铜与氢氧化钠混合会有沉淀。
因此,我们可以推断溶液D是硫酸溶液。
4. 溶液C与溶液D混合产生气泡,这是碳酸盐与酸反应生成二氧化碳气体的典型现象。
这进一步验证了溶液C是碳酸钠溶液,溶液D是硫酸溶液。
5. 溶液D与溶液E混合产生白色沉淀,这是硫酸与可溶性钡盐反应生成硫酸钡白色沉淀的现象。
因此,我们可以推断溶液E是氯化钡溶液。
综上所述,五种溶液的化学成分分别为:A. 硫酸铜溶液B. 氢氧化钠溶液C. 碳酸钠溶液D. 硫酸溶液E. 氯化钡溶液结束语:通过仔细分析实验现象和化学知识,我们可以成功推断出每种溶液的成分。
这类推断题不仅考察了学生对化学知识的掌握,还锻炼了他们的逻辑推理能力。
希望同学们在解答此类题目时,能够细心观察,合理推断,不断提高自己的化学素养。
挑战18推断题(共30题)训练内容是单选题共30题分布如下:1、金属和金属材料11题;2、酸和碱7题;3、盐化肥9题;4、化学与生活3题;1.(2022•云南)金属及金属材料广泛应用于生产、生活及科学实验,其应用推动了社会的发展。
(1)下列实验中,铜片上的白磷燃烧,说明铜具有导热性;黄铜片和纯铜片相互刻画,纯铜片上留下刻痕,说明黄铜的硬度比纯铜的硬度大(填“大”或“小”)。
(2)铁在潮湿的空气中容易生锈,写出一种防止铁制品生锈的具体方法铁制品表面涂油或刷油漆(合理即可)。
(3)春秋战国时期,我国就开始生产和使用铁器。
工业上用赤铁矿(主要成分Fe2O3)和一氧化碳反应炼铁的化学方程式为Fe2O3+3CO2Fe+3CO2。
(4)某同学对含Cu(NO3)2、AgNO3、M(NO3)2的混合溶液进行探究,流程如下(M 表示一种金属元素):根据实验探究流程,回答下列问题:①气体X的化学式为H2;②金属Fe、Cu、Ag、M的活动性由强到弱的顺序是M>Fe>Cu>Ag。
③滤液D中所含溶质的成分可能有3种情况。
【答案】(1)导热;大;(2)铁制品表面涂油或刷油漆(合理即可);(3)Fe2O3+3CO2Fe+3CO2;(4)①H2;②M>Fe>Cu>Ag;③3。
【解答】解:(1)铜片上的白磷燃烧,说明温度达到白磷的着火点,说明铜具有导热性,黄铜片和纯铜片相互刻画,纯铜片上留下刻痕,说明黄铜的硬度比纯铜的硬度大。
(2)铁生锈是铁与水和氧气接触发生的反应,防止铁制品生锈的具体方法铁制品表面涂油或刷油漆(合理即可),隔绝氧气和水。
(3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:Fe2O3+3CO2Fe+3CO2。
(4)①对含Cu(NO3)2、AgNO3、M(NO3)2的混合溶液加入一定量的铁,铁与硝酸银反应生成银和硝酸亚铁,铁硝酸铜反应生成铜和硝酸亚铁,固体甲加入过量稀盐酸有气体生成,说明加入的铁过量,固体甲中含铁,铁与盐酸反应生成氢气,故气体X为氢气;②滤液A中含硝酸亚铁,硝酸亚铁溶液是浅绿色,加入过量的M得到无色滤液B,说明M置换出铁,M活动性大于铁,固体乙中含铁和M,故金属Fe、Cu、Ag、M的活动性由强到弱的顺序是M>Fe>Cu>Ag;③固体乙中含铁和M,M活动性大于铁,加入硝酸银溶液,M先与硝酸银反应生成M(NO3)2和银;如果M足量,滤液D中所含溶质为M(NO3)2;如果M与硝酸银恰好完全反应,滤液D中所含溶质为M(NO3)2;当M完全反应,硝酸银有剩余,铁与硝酸银反应,铁有剩余,滤液D中所含溶质为M(NO3)2和Fe(NO3)2;当M完全反应,硝酸银有剩余,铁与硝酸银反应,铁与硝酸银恰好完全反应,滤液D中所含溶质为M(NO3)2和Fe(NO3)2;当M、铁完全反应,硝酸银有剩余,滤液D中所含溶质为M(NO3)2、Fe(NO3)2和AgNO3。
考点39 有机推断1.(2023·辽宁省锦州市高三调研)吲哚布芬为抗血栓形成药,用于治疗动脉硬化引起的缺血性心血管、脑血管病变。
其合成路线如图所示。
已知:R -X NaCN→R -CN 2H ,H O+−−−→R -COOH+NH 4+回答下列问题:(1)反应②的反应条件及试剂为______。
(2)J 中含有官能团的名称为______。
(3)反应⑥的离子方程式为______。
(4)反应⑦中Na 2S 2O 4的作用是_____。
(5)已知M 的核磁共振氢谱有两组峰,N 的结构简式为______。
(6)符合下列条件的J 的同分异构体共有_____种(不考虑立体异构)。
①含有苯环②与J 含有相同官能团③官能团直接与苯环相连且处于对位(7)仿照上述合成路线设计由丙醇(CH 3CH 2CH 2OH)合成2-甲基丙酸( )的合成路线_____(其他试剂任选)。
2.(2023·广东省梅州市二模)乙肝新药的中间体化合物J 的一种合成路线如下:已知:2230%H O RCOOH −−−−→ ,回答下列问题:(1)A 的化学名称为_________,D 中含氧官能团的名称为_________。
(2)M 的结构简式为。
①M 与相比,M 的水溶性更_______(填“大”或“小”)。
②SH —与OH —性质相似,写出M 与NaOH 溶液反应的化学方程式_________________。
(3)由G 生成J 的过程中,设计反应④和反应⑤的目的是_________。
(4)化合物Q 是A 的同系物,相对分子质量比A 的多14;Q 的同分异构体中,同时满足下列条件(不考虑立体异构):a .能与详解溶液发生显色反应;b .能发生银镜反应;c .苯环上有2个取代基。
其中核磁共振氢谱有五组峰,且峰面积之比为2:2:1:1:1的结构简式为__________。
(5)根据上述信息,以和为原料,设计合成的路线________(无机试剂任选)。
高中化学经典推断题一1、常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示(1)分别写出A 、B 、C 、D 的化学式:A B C D (2) 试写出有关化学方程式:A →B D →A 。
2、沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答: ①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。
3、现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙 水 ②① 金属 B ③ 水 黄绿色气体乙 ④ ⑤请根据以上信息回答下列问题:⑴写出下列物质的化学式:A 、 丙 ⑵写出下列反应化学方程式:反应① 反应⑤4、A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出)(1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍,所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体生成,则A 的原子结构示意图为__________,反应④的化学方程式为____________________.(2)若A 为常见的金属单质,D 、F 是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写金属A (焰色为黄) 气体甲 气体丙 物质D 物质C 物质E 物质F 红褐色沉淀出反应的热化学方程式____________________.(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________,B固体属于__________晶体.5.短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能..与A、B两种物质中的某种相同)。
高中化学有机推断题集锦高考有机化学推断题集锦2.以石油产品乙烯为起始原料,合成高分子化合物F和G,其合成路线如下图所示:已知E的分子式为C4H6O2,F的分子式为(C4H6O2)n(俗名“乳胶”的主要成分),G的分子式为(C2H4O)n(可用于制化学浆糊)。
反应方程式为:2CH2=CH2+2CH3COOH+O2+2H2O→2C4H6O2(醋酸乙烯酯)。
问题:1)写出结构简式:E:CH3COOCH=CH2,F:(CH3COOCH=CH2)n。
2)反应①、②的反应类型分别为加成反应和缩合反应。
3)A→B的化学方程式为:2CH3COOCH=CH2+H2O→XXX;B→C的化学方程式为:2C4H6O2+H2O2→(C4H6O2)n+2H2O。
1.有一种名为菲那西汀的药物,其基本合成路线如下图所示:问题:1)反应②中生成的无机物化学式为NaCl,反应③中生成的无机物化学式为CaSO4.2)反应⑤的化学方程式为:C10H15NO+H2O2+HCl→C10H14ClNO2+H2O。
3.已知有机物A和C互为同分异构体且均为芳香族化合物,相互转化关系如下图所示:问题:1)有机物F的两种结构简式为:F1:C6H5CH=CHCH3,F2:C6H5CH2CH=CH2.2)指出①②的反应类型:①为加成反应,②为消除反应。
3)与E互为同分异构体且属于芳香族化合物所有有机物的结构简式为C和D。
4)发生下列转化的化学方程式为:C→D:C6H5CH=CHCH3+HBr→C6H5CHBrCH3,D→E:C6H5CHBrCH3+NaOH→C6H5CH=CH2+NaBr+H2O。
4.已知卤代烃在与强碱的水溶液共热时,卤原子能被带负电荷的原子团OH所取代。
现有一种烃A,它能发生下图所示的变化。
又知两分子的E相互反应,可以生成环状化合物C6H8O4.问题:1)A的结构简式为:CH3CH2CH2Br,C的结构简式为:HOOCCH=CHCOOH,D的结构简式为:HOOCCH2CH2COOH,E的结构简式为:XXX。
无机推断题复习无机推断题是在化学学科的历次高考改革中始终保留的一种基本题型,是高考的热点题型。
它以无机物的结构、性质和相互转化为载体,不仅能全面检查学生对元素及其化合物、物质结构、元素周期律等基础知识的掌握情况,检查学生灵活运用知识的能力,而且能考查学生抽象、求异、发散、收敛,逻辑推理,知识迁移,信息处理等方面的能力,也能很好地与化学实验、计算、基本化学用语,化学基础理论、元素及化合物,有机知识等学科内综合考查,对考生有很好的区分度,预计在今后的理科综合能力考查中,它将依然是化学学科的一种重要题型。
一、无机推断题复习方法和策略。
推断题融元素化合物、基本概念和理论于一体,侧重考查学生思维能力和综合应用能力。
在解无机推断题时,读题、审题相当重要,在读题审题过程中,要认真辩析题干中有关信息,抓住突破口,分析无机推断中的转化关系,仔细推敲,挖掘出隐含条件。
(一)基本思路读题(了解大意)→审题(寻找明显条件、挖掘隐含条件与所求)→解题(抓突破口)→推断(紧扣特征与特殊)→得出结论→正向求证检验读题:读题的主要任务是先了解题目大意,寻找关键词、句,获取表象信息。
切勿看到一点熟悉的背景资料就匆匆答题,轻易下结论,这样很容易落入高考试题中所设的陷阱。
审题:对读题所获信息提炼、加工,寻找明显的或潜在的突破口,更要注意挖掘隐含信息-“题眼”。
“题眼”常是一些特殊的结构、状态、颜色,特殊的反应、反应现象、反应条件和用途等等。
审题最关键的就是找出”题眼” 。
解题:找到“题眼” 后,就是选择合适的解题方法。
解无机推断题常用的方法有:顺推法、逆推法、综合推理法、假设法、计算法、实验法等。
通常的思维模式是根据信息,大胆猜想,然后通过试探,验证猜想;试探受阻,重新阔整思路,作出新的假设,进行验证。
一般来说,先考虑常见的规律性的知识,再考虑不常见的特殊性的知识,二者缺一不可。
验证:不论用哪种方法推出结论,都应把推出的物质代入验证。
无机推断题复习无机推断题是在化学学科的历次高考改革中始终保留的一种基本题型,是高考的热点题型。
它以无机物的结构、性质和相互转化为载体,不仅能全面检查学生对元素及其化合物、物质结构、元素周期律等基础知识的掌握情况,检查学生灵活运用知识的能力,而且能考查学生抽象、求异、发散、收敛,逻辑推理,知识迁移,信息处理等方面的能力,也能很好地与化学实验、计算、基本化学用语,化学基础理论、元素及化合物,有机知识等学科内综合考查,对考生有很好的区分度,预计在今后的理科综合能力考查中,它将依然是化学学科的一种重要题型。
一、无机推断题复习方法和策略。
推断题融元素化合物、基本概念和理论于一体,侧重考查学生思维能力和综合应用能力。
在解无机推断题时,读题、审题相当重要,在读题审题过程中,要认真辩析题干中有关信息,抓住突破口,分析无机推断中的转化关系,仔细推敲,挖掘出隐含条件。
(一)基本思路读题(了解大意)→审题(寻找明显条件、挖掘隐含条件与所求)→解题(抓突破口)→推断(紧扣特征与特殊)→得出结论→正向求证检验读题:读题的主要任务是先了解题目大意,寻找关键词、句,获取表象信息。
切勿看到一点熟悉的背景资料就匆匆答题,轻易下结论,这样很容易落入高考试题中所设的陷阱。
审题:对读题所获信息提炼、加工,寻找明显的或潜在的突破口,更要注意挖掘隐含信息-“题眼”。
“题眼”常是一些特殊的结构、状态、颜色,特殊的反应、反应现象、反应条件和用途等等。
审题最关键的就是找出”题眼”。
解题:找到“题眼”后,就是选择合适的解题方法。
解无机推断题常用的方法有:顺推法、逆推法、综合推理法、假设法、计算法、实验法等。
通常的思维模式是根据信息,大胆猜想,然后通过试探,验证猜想;试探受阻,重新阔整思路,作出新的假设,进行验证。
一般来说,先考虑常见的规律性的知识,再考虑不常见的特殊性的知识,二者缺一不可。
验证:不论用哪种方法推出结论,都应把推出的物质代入验证。
如果与题设完全吻合,则说明我们的结论是正确的。
最后得到正确结论时还要注意按题目要求规范书写,如要求写名称就不要写化学式。
(二)相关知识储备解答无机推断题需要一定的背景知识为基础。
下面以“考纲”为核心,以教材出发,结合对近几年高考试题的分析和对未来的预测,对常考的热点知识作如下归纳:4.特征反应(中学)O2O2⑴⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⑵铵盐:O H NH NH 234+↑−→−+碱 8.化合价变化变价元素结合氧化还原反应是推断题的命题角度之一,常考到的元素有:Cl 、S 、N 、C 、Fe 等。
9.物质组成的特殊配比能形成原子个数比为2:1或1:1的特殊化合物有:Na 2O 、Na 2O 2类,H 2O 、H 2O 2类,CaC 2、C 2H 4、C 2H 2、C 6H 6类。
10.物质间的一些特殊转化关系物质间的转化关系是解无机推断题的精髓,除了熟记一般的转化网络如“铝三角”、“铁三角”等外,还要了解一些特殊的转化关系,例如:二、常见的突破口:抓住题目的突破口,是解决无机推断题的关键。
题目中的突破口可能是显性的,也可能是隐性的。
显性的突破口通常是指物质特殊的物理、化学性质、用途以及一些特征的反应现象;而隐性的突破口则往往是一些特殊的反应类型或者物质之间的转化关系。
2、物质状态液态单质:Br 2、Hg ; 液态化合物:H 2O 、H 2O 2、H 2SO 4、HNO 3等; 气态单质:H 2、N 2、O 2、F 2、Cl 2等; 气态化合物:氧化物:CO CO 2 NO NO 2 SO 2 氢化物:C 2H 2 NH 3 H 2S HX(并从特殊颜色﹑气味﹑相互反应等方面总结) 3、反应现象或化学性质(1)焰色反应:黄色-Na ;紫色(钴玻璃)-K 。
(2)与燃烧有关的现象:火焰颜色:苍白色:H 2在Cl 2中燃烧; (淡)蓝色:H 2、CH 4、CO 等在空气中燃烧;黄色:Na 在Cl 2或空气中燃烧; 烟、雾现象:棕(黄)色的烟:Cu 或Fe 在Cl 2中燃烧; 白烟:Na 在Cl 2或P 在空气中燃烧; 白雾:有HX 等极易溶于水的气体产生; 白色烟雾:P 在Cl 2中燃烧。
(3)沉淀特殊的颜色变化:白色沉淀变灰绿色再变红褐色:Fe(OH)2→Fe(OH)3; 白色沉淀迅速变棕褐色:AgOH →Ag 2O 。
(4)使湿润的红色石蕊试纸变蓝的气体:NH 3; (5)能使品红溶液褪色加热后又复原的气体:SO 2; (6)在空气中迅速由无色变成红棕色的气体:NO ; (7)使淀粉溶液变蓝的物质:I 2;(8)能漂白有色物质的淡黄色固体:Na 2O 2; (9)在空气中能自燃的固体:P 4;(10)遇SCN -变红色、OH -产生红褐色沉淀、苯酚显紫色的离子:Fe 3+; (11)不溶于强酸和强碱的白色沉淀:AgCl 、BaSO 4;(12)遇Ag +生成不溶于硝酸的白色、浅黄色、黄色沉淀的离子分别是:Cl -、Br -、I -。
(13)可溶于NaOH 的白色沉淀:Al(OH)3、H 2SiO 3;金属氧化物:Al 2O 3; (14)可溶于HF 的酸性氧化物:SiO 2;(15)能与NaOH 溶液反应产生气体的单质:Al 、Si 、;化合物:铵盐; (16)能与浓硫酸、铜片共热产生红棕色气体的是:硝酸盐;(17)通入二氧化碳产生白色胶状沉淀且不溶于任何强酸的离子:SiO 32-;(18)溶液中加酸产生的气体可能是:CO 2、SO 2、H 2S ; 溶液中存在的离子可能是:CO 32-、HCO 3-;SO 32-、HSO 3-;S 2-、HS -;(19)同一元素的气态氢化物和最高价氧化物对应水化物能反应生成盐的元素:N ;(20)与酸、碱都能反应的无机物:Al 、Al 2O 3、Al(OH)3、弱酸酸式盐、弱酸弱碱盐等; (21)能与水反应生成气体的物质:K 、Na 、NaH ;Na 2O 2、CaC 2及Mg 3N 2、Al 2S 3等; (22)既有气体又有沉淀生成的反应:Ba(OH)2、Ca(OH)2与NH 4HCO 3、(NH 4)2SO 4等;(23)先沉淀后溶解的反应:Ca(OH)2+CO 2、AgNO 3+氨水、Al 3++OH -、AlO 2-+OH -、Ba(OH)2+H 3PO 4 等; (24)见光易分解的物质:HClO 、HNO 3、AgCl 、AgBr 、AgI ;(25)使用催化剂的反应:合成氨、三氧化硫的生成、氨的催化氧化、制氧气等。
一.金属部分:[题眼归纳] 1.特征现象:(1)焰色反应:Na +(黄色)、K +(紫色) (2)浅黄色固体:S 或Na 2O 2或AgBr(3)有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO 4-(紫色)有色固体:红色(Cu 、Cu 2O 、Fe 2O 3)、红褐色[Fe(OH)3]蓝色[Cu(OH)2] 黑色(CuO 、FeO 、FeS 、CuS 、Ag 2S 、PbS )黄色(AgI 、Ag 3PO 4) 白色[Fe(0H)2、CaCO 3、BaSO 4、AgCl 、BaSO 3]有色气体:Cl 2(黄绿色)、NO 2(红棕色) (4)特征反应现象:])([])([32OH Fe OH Fe 红褐色白色沉淀空气−−→−(5)既产生淡黄色沉淀又产生刺激性气味的气体:S 2O 32-+2H +=S ↓+SO 2↑+H 2O (Na 2S 2O 3 + H 2SO 4) (6)溶液颜色变为浅绿色,并产生淡黄色沉淀: 2FeCl 3+H 2S=2FeCl 2+S ↓+2HCl (7) 通CO 2变白色浑浊:石灰水(过量变清)、Na 2SiO 3、饱和Na 2CO 3、浓苯酚钠、NaAlO 22.基本反应:(1)与水反应产生气体或沉淀: ○1单质⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na○2化合物()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na ○3双水解: ()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+32322323233222OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H O H O H 与(2) 既能酸反应,又能与碱反应 ①单质:Al 、Si②化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
如: Al 3+ Al(OH)3 AlO 2-③A —⎪⎩⎪⎨⎧−−→−−−→−C B 气体气体强碱强酸(3) 置换反应:①金属→金属⎩⎨⎧+→+铝热反应盐金属盐金属.2.1②金属→非金属⎪⎩⎪⎨⎧+−−→−+↑−−−→−+C MgO CO Mg H Fe Mg Na O H H 22222点燃或)、、活泼金属((4)分解反应:①↑+−−−→−∆233222O KCl KClO MnO , ②硝酸盐⎪⎩⎪⎨⎧↑+↑+−→−↑+↑+−→−∆∆223222322242)(2O NO Ag AgNO O NO CuO NO Cu (3)电解反应:电解()⎪⎪⎩⎪⎪⎨⎧↑+↑+−−→−↑+−−→−↑+↑−−→−22232222H Cl NaOH NaCl O Al O Al (O H O H 电解电解电解溶液熔融钠溶液)如电解硫酸钠、氢氧化二.非金属部分:[题眼归纳]1.非金属单质或化合物的反应中常用到催化剂的反应:322223322222223645422222NH H N OH NO O NH SO O SO O O H O H MnO −−−→−++−−−→−+−−−→−+↑+−−→−∆∆∆催化剂,催化剂,催化剂,2.置换反应:(1)非金属→非金属⎪⎪⎩⎪⎪⎨⎧+=++−−→−++−−→−+↑+=+)、(、高温高温HI HBr HCl S S H I Br Cl H CO O H C CO Si SiO C O HF O H F 2)(224222222222222(2)非金属→金属⎪⎩⎪⎨⎧+−−→−++−−→−+222CO C O H H 金属金属氧化物金属金属氧化物高温高温3.归中反应:2H 2S+SO 2=3S+2H 2O4NH 3+6NO −−→−催化剂4N 2+6H 2O 4.分解反应:受热分解产生2种或3种气体的反应:铵盐⎪⎩⎪⎨⎧↑+↑−→−+↑+↑−→−+↑+↑−→−∆∆∆S H NH S NH HS NH O H SO NH SO NH HSO NH O H CO NH CO NH HCO NH 232442233243422332434])[(])[(])[(5.特征网络:通式: )(222酸或碱D C B A OH O O −−→−−→−−→−①323222HNO NO NO NH OH O O −−→−−→−−→−(气体) ②42322222SO H SO SO S H OH O O −−→−−→−−→−(气体)③322222CO H CO CO C OH O O −−→−−→−−→−(固体)④NaOH O Na O Na Na OH O O −−→−−→−−→−222222(固体)6.特征反应⑴与碱反应产生气体①⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质②铵盐:O H NH NH 234+↑−→−+碱(2)与酸反应产生气体①⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓 ②()()()⎪⎪⎩⎪⎪⎨⎧↑−→−↑−→−↑−→−+++------2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物7.三角转化关系:【考纲要求】2.卤族元素——典型的非金属(氯元素的知识网络)一、卤素 【知识网络】 【易错指津】1.分清氯水、溴水的成分,反应时的作用和褪色的原理。