原子结构
- 格式:doc
- 大小:48.00 KB
- 文档页数:5

原子的基本结构原子是构成物质的最基本单位,是化学反应和物质性质变化的基础。
本文将介绍原子的基本结构,主要涉及原子的组成和组织,以及科学家对原子结构的发现和研究。
一、原子组成原子由三种基本粒子组成:质子、中子和电子。
质子带正电荷,中子没有电荷,电子带负电荷。
在原子内部,质子和中子集中在原子核中,外部电子绕核旋转。
1. 原子核原子核是原子的中心部分,由质子和中子组成。
质子具有正电荷,并决定了原子的原子序数,中子没有电荷。
质子和中子的集合在原子核中形成了稳定的结构。
2. 电子壳层原子核外部的电子围绕核心在特定轨道上运动,形成电子壳层。
电子壳层的数量与原子的能级相关,决定了原子的化学性质。
第一电子壳层最多容纳2个电子,第二电子壳层最多容纳8个电子,第三电子壳层最多容纳18个电子。
二、原子的发现与研究1. 原子学说的提出古代的希腊哲学家认为物质是由最基本的单元构成的,但对于这个最基本的单元,他们没有确切的观点。
直到19世纪初,英国科学家道尔顿提出了原子学说,认为所有物质都是由不可分割的原子组成的。
2. 原子结构的实验证据为了验证原子学说,科学家进行了一系列的实验。
其中,汤姆逊的阴极射线实验和卢瑟福的金箔散射实验对原子结构的认识有着重大贡献。
汤姆逊通过研究阴极射线的偏转现象,发现存在带负电的粒子,即电子。
他提出了“杏仁布丁模型”,认为正电荷和负电荷均匀分布在整个原子中。
卢瑟福的金箔散射实验进一步揭示了原子内部的结构。
他发现,大部分的正电荷集中在一个非常小且带正电的核心中,并且核周围的电子密度很低。
这证明了原子中有一个小而密集的原子核。
3. 波尔的量子理论根据实验证据,丹麦科学家波尔提出了量子理论,进一步解释了原子结构。
他认为电子只能在特定的能级轨道上运动,并在这些轨道上具有固定的能量。
当电子从一高能级跃迁到另一低能级时,会释放出或吸收特定能量的光子。
三、小结原子的基本结构由质子、中子和电子组成。
质子和中子集中在原子核中,而电子围绕核心在不同的壳层上运动。


原子的结构知识点原子的结构是物质世界的基本组成单位,是构成所有物质的最基本粒子。
本文将从原子的组成和结构、原子的三个基本粒子以及原子的核外电子层结构等三个方面进行探讨。
一、原子的组成和结构原子由原子核和核外电子层组成。
原子核位于原子的中心,电子围绕在原子核的外部。
原子核是原子的重要组成部分,质量约占整个原子质量的99.9%。
而电子的质量很小,约为1/1836个质子的质量。
原子核由质子和中子组成,质子带正电,中子不带电。
原子的质量数等于质子数和中子数之和,原子的电荷数等于质子数减去电子数。
二、原子的三个基本粒子原子由三个基本粒子组成,分别是质子、中子和电子。
质子是带正电的基本粒子,质子数决定了原子的元素种类。
中子是不带电的基本粒子,中子的数量可以影响到原子的同位素。
质子和中子都位于原子核中,它们的质量几乎相同,质子的质量约为1.6726219×10^-27千克,中子的质量约为1.67492716×10^-27千克。
电子是带负电的基本粒子,电子围绕在原子核外部,电子的质量约为9.10938356×10^-31千克。
三、原子的核外电子层结构原子的核外电子层结构是由一系列能量不同的电子壳层组成。
以氢原子为例,氢原子只有一个质子和一个电子,电子围绕在原子核的外部,形成一个电子壳层。
电子壳层分为K壳、L壳、M壳等,每个壳层可以容纳一定数量的电子。
K壳最靠近原子核,能量最低,最多容纳2个电子;L壳次于K壳,能量较高,最多容纳8个电子;M壳以此类推。
原子的电子层结构决定了元素的化学性质,不同元素的电子层结构各不相同。
总结:原子的结构是由原子核和核外电子层组成,原子核由质子和中子组成,而电子围绕在原子核的外部。
原子的三个基本粒子分别是质子、中子和电子,它们的性质和数量决定了元素的特性。
原子的核外电子层结构由一系列能量不同的电子壳层组成,不同元素的电子层结构各不相同。
通过对原子的结构和组成的了解,我们可以更好地理解物质的性质和变化。

原子结构知识:原子结构中电子自旋和核自旋1.引言原子结构是指原子内部的组成和排列方式,包括核子和电子的结构。
在原子结构中,电子自旋和核自旋是两个重要的概念,它们对于原子的性质和行为起着重要作用。
2.电子自旋电子是原子中最轻的带电粒子,它的自旋是电子最重要的特性之一。
电子自旋是指电子围绕自身轴心旋转的现象,它的大小和方向可以用自旋量子数来描述。
根据量子力学理论,电子自旋量子数可以取两个值,分别为+1/2和-1/2。
这意味着电子自旋可以分为两种状态,即自旋向上和自旋向下。
3.核自旋与电子自旋类似,核自旋也是原子结构中非常重要的一个概念。
核自旋是指原子核内部核子(质子和中子)围绕自身轴心旋转的现象。
核子的自旋量子数也可以取两个值,分别为+1/2和-1/2。
不同于电子自旋,核自旋的大小和方向会受到核外电子的屏蔽效应的影响。
这意味着核自旋的取值范围和性质会受到核外电子的影响而发生改变。
4.电子自旋和核自旋的相互作用在原子结构中,电子自旋和核自旋之间存在着相互作用。
这种相互作用会对原子的性质和行为产生影响。
在原子内部,电子与核子之间会发生自旋-轨道耦合,这是因为电子不仅有自旋运动,还有轨道运动。
这种耦合会导致电子的自旋和轨道运动不再是完全独立的,而是相互影响的。
另外,电子自旋和核自旋之间还会发生磁相互作用,这种相互作用会导致原子具有磁性。
5.电子自旋和核自旋在原子物理中的应用电子自旋和核自旋在原子物理中具有广泛的应用。
其中,最重要的应用之一是核磁共振(NMR)技术。
核磁共振是利用原子核的自旋性质来获取物质结构和性质的一种分析方法。
通过NMR技术,可以研究原子核自旋和化学环境之间的相互作用,从而获取大量化学信息。
此外,电子自旋和核自旋还在磁共振成像(MRI)领域得到广泛应用,用于医学诊断和研究。
6.结论电子自旋和核自旋是原子结构中重要的概念,它们对于原子的性质和行为具有重要影响。
在原子内部,电子自旋和核自旋之间存在相互作用,这种相互作用会引发许多重要的物理现象。



原子结构的历史发展原子结构是现代物理学中的基本概念之一,指的是物质构成的最基本单元。
随着科学的进步,人们对原子结构的认识也在不断深化和演变。
本文将就原子结构的历史发展进行探讨,以了解人类对于原子结构的认识是如何逐步建立的。
1. 早期观念和哲学思考的影响在古代,人们对原子结构的认识主要依靠哲学思考和逻辑推理。
古希腊的哲学家德谟克利特提出了原子学说,认为物质是由不可再分的微小颗粒构成的,这些颗粒具有不同的形态和质量。
虽然他的学说并没有经受住时间的考验,但这是人类第一次对原子这一概念进行了系统的思考。
2. 化学实验的重要突破随着化学实验技术的发展,科学家们开始通过实验来探索原子结构。
英国化学家道尔顿在18世纪末提出了道尔顿原子模型,认为元素由不可再分的小颗粒组成,各种元素的原子在化学反应中会重新组合。
道尔顿的学说在化学界得到了广泛的认可,并且对后续的原子理论发展产生了深远的影响。
3. 雷利散射实验的发现20世纪初,英国物理学家雷利通过散射实验发现了原子的结构不是均匀的,而是由一个小而致密的核心和外围电子云组成。
这一实验为后来的量子力学奠定了基础,揭示了原子中存在不同的子粒子。
4. 量子力学的问世20世纪初,量子力学的诞生彻底改变了人们对于原子结构的认识。
物理学家们发现,原子结构的描述需要借助于量子力学的数学框架,原子中的电子存在于离散的能级中。
薛定谔方程的提出使得人们对于原子结构有了更深入的理解,并且能够解释许多先前无法解释的实验现象。
5. 粒子加速器的发展随着粒子加速器技术的进步,科学家们得以通过高能碰撞实验来研究原子的内部结构。
通过对粒子间相互作用的观察和测量,人们发现原子核内存在着质子和中子。
这一发现进一步完善了对于原子结构的认识,使原子结构模型更趋于完整。
总结:原子结构的历史发展经历了古代哲学思考、化学实验突破、雷利散射实验的发现、量子力学的问世以及粒子加速器的发展等多个阶段。
通过这些阶段的发展,人类对于原子结构的认识得到了不断深化和完善。


课题2 原子结构一、【知识梳理】(一)原子结构原子核(带正电)1、原子(不显电性)中子(不带电)核外电子(带负电)注:原子不显电性是因为质子和电子所带动电荷数相等,电性相反。
2、核电荷数:原子核所带电荷数。
3、在原子中,质子数=核外电子数=核电荷数(二)核外电子排布1、在多电子的原子中,核外电子的能量不同,能量高的离核远,能量低的离核近。
通常把电子在离核远近不同的区域运动称为电子的分层排布。
2、排布规律:(1)第一层最多2个电子;(2)第二层最多8个电子;(3)最外层最多8个电子。
3、结构示意图含义:圆圈(原子核);圆圈内数字(核内质子数);弧线(电子层);弧线上数字(该电子层上电子数)4、原子分类(最外层电子数决定化学性质)(三)离子1、定义:带电的原子或原子团。
2、分类:阳离子:(质子数大于核外电子数)带正电的离子。
阴离子:(质子数小于核外电子数)带负电的离子。
3、书写:在元素符号或原子团的右上角先写数字再写正负号,数值为1时省略不写。
4、离子是构成物质的基本微粒,例如:氯化钾、氯化钠等。
(五)相对原子质量1、定义:一个原子质量与一个碳12原子的质量的1/12的比值就是相对原子质量。
2、公式:相对原子质量=质子数+中子数3、理解:(1)相对原子质量不是个质量是个比值;(2)有单位,是“1”常省略不写;(3)相对原子质量之比等于原子实际质量之比;(4)引入相对原子质量是为了书写、记忆和运算方便。
二、【典例解析】例题1:中国科研团队首次证实了天然铀单质的存在.用于核电工业的一种铀原子中含有92个质子和143个中子.有关该原子的说法不正确的是()A.属于金属元素 B.电子数为92C.核电荷数为92 D.相对原子质量为143【答案】D【解析】A、由于铀的元素名称铀中含有偏旁“钅”故该元素属于金属元素;B、原子中质子数等于核外电子数,故铀核外含有92个电子;C、原子中质子数等于核电荷数,核电荷数为92;D、由于相对原子质量≈质子数+中子数,143是中子数,不是相对原子质量;故选D。

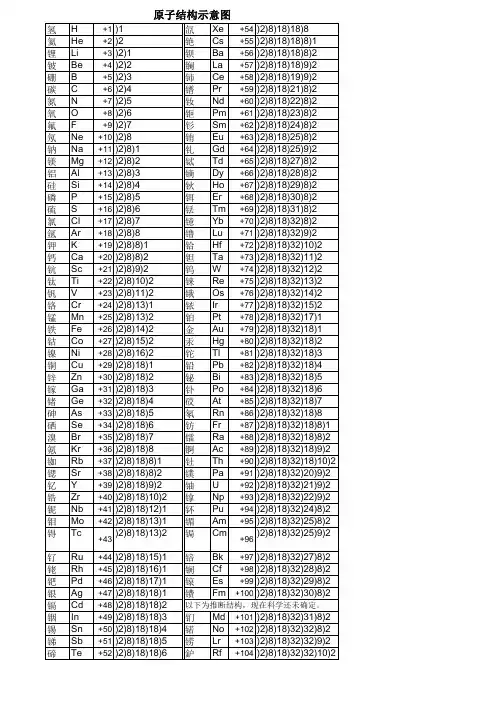
(完整版)原⼦结构⽰意图⼤全+19 2 8 8 1 钾K +20 2 8 8 2 钙Ca +21 2 8 9 2 钪Sc+22 2 8 10 2 钛Ti +23 2 8 11 2 钒V +24 2 8 13 1 铬Cr+25 2 8 13 2 锰Mn +26 2 8 14 2 铁Fe +27 2 8 15 2 钴Co+28 2 8 16 2 镍Ni +29 2 8 18 1 铜Cu +30 2 8 18 2 锌Zn+31 2 8 18 3 镓Ga +32 2 8 18 4 锗Ge +33 2 8 18 5 砷As+34 2 8 18 6 硒Se +35 2 8 18 7 溴Br +36 2 8 18 8 氪Kr+37 2 8 18 8 1 铷Rb +38 2 8 18 8 2 锶Sr +39 2 8 18 9 2 钇Y+40 2 8 18 10 2 锆Zr +41 2 8 18 12 1 铌Nb +42 2 8 18 13 1 钼Mo +43 2 8 18 13 2 锝Tc +44 2 8 18 15 1 钌Ru +45 2 8 18 16 1 铑Rh +46 2 8 18 18 钯Pd +47 2 8 18 18 1 银Ag +48 2 8 18 18 2 镉Cd +49 2 8 18 18 3 铟In +50 2 8 18 18 4 锡Sn +51 2 8 18 18 5 锑Sb +52 2 8 18 18 6 碲Te +53 2 8 18 18 7 碘I +54 2 8 18 18 8 氙Xe +55 2 8 18 18 8 1 铯Cs +56 2 8 18 18 8 2 钡Ba +57 2 8 18 18 9 2 镧La +58 2 8 18 19 9 2 铈Ce +59 2 8 18 21 8 2 镨Pr +60 2 8 18 22 8 2 钕Nd +61 2 8 18 23 8 2 钷Pm +62 2 8 18 24 8 2 钐Sm +63 2 8 18 25 8 2 铕Eu +64 2 8 18 25 9 2 钆Gd +65 2 8 18 27 8 2 铽Td +66 2 8 18 28 8 2 镝Dy +67 2 8 18 29 8 2 钬Ho +68 2 8 18 30 8 2 铒Er +69 2 8 18 31 8 2 铥Tm +70 2 8 18 32 8 2 镱Yb +71 2 8 18 32 9 2 镥Lu +72 2 8 18 32 10 2 铪Hf+73 2 8 18 32 11 2 钽Ta +74 2 8 18 32 12 2 钨W +75 2 8 18 32 13 2 铼Re +76 2 8 18 32 14 2 锇Os +77 2 8 18 32 15 2 铱Ir +78 2 8 18 32 17 1铂Pt +79 2 8 18 32 18 1 ⾦Au +80 2 8 18 32 18 2 汞Hg +81 2 8 18 32 18 3 铊Tl +82 2 8 18 32 18 4 铅Pb +83 2 8 18 32 18 5 铋Bi +84 2 8 18 32 18 6 钋Po +85 2 8 18 32 18 7 砹At +86 2 8 18 32 18 8 氡Rn +87 2 8 18 32 18 8 1 钫Fr +88 2 8 18 32 18 8 2 镭Ra +89 2 8 18 32 18 9 2 锕Ac +90 2 8 18 32 18 10 2 钍Th +91 2 8 18 32 20 9 2 镤Pa +92 2 8 18 32 21 9 2 铀U +93 2 8 18 32 22 9 2 镎Np +94 2 8 18 32 24 8 2 钚Pu +95 2 8 18 32 25 8 2 镅Am +96 2 8 18 32 25 9 2 锔Cm +97 2 8 18 32 27 8 2 锫Bk +98 2 8 18 32 28 8 2 锎Cf +99 2 8 18 32 29 8 2 锿Es +100 2 8 18 32 30 8 2镄Fm +101 2 8 18 32 31 8 2 钔Md(推断结构,现在科学还未确定,下同)+102 2 8 18 32 32 8 2 锘No +103 2 8 18 32 32 9 2 铹Lr +104 2 8 18 32 32 10 2 鈩Rf +105 2 8 18 32 32 11 2 钅杜Db初中常见的离⼦团NH4 铵根+1价SO3 亚硫酸根-2价SO4 硫酸根-2价CO3 碳酸根-2价Cl 盐酸根-1价OH 氢氧根-1价NO3 硝酸根-1价NO2 亚硝酸根-1价CIO3 氯酸根-1价ClO 次氯酸根-1价,ClO4 ⾼氯酸根-1价,H2PO4 磷酸⼆氢根-1价HPO42 磷酸氢根-1价MnO4 ⾼锰酸根-1价MnO4 锰酸根-2价SiO3 硅酸根-2价HCO3 碳酸氢根-1价HSO4 硫酸氢根-1价PO4 磷酸根-3价。
原子结构的演变历程原子结构是物质世界的基本单位,对人类认识物质的演变历程具有重要意义。
本文将从经典原子模型,至量子力学的发展,探讨原子结构的演变历程。
1. 经典原子模型19世纪末,由汤姆逊发现了电子,为原子研究提供了重要线索。
结合普朗克量子化假设和爱因斯坦光电效应的实验结果,卢瑟福构建了经典原子模型。
该模型认为原子核是带正电的,电子围绕原子核轨道运动。
然而,经典原子模型无法解释稳定原子的光谱现象,存在明显的缺陷。
2. 卢瑟福模型与玻尔理论为解决经典原子模型的缺陷,1913年,卢瑟福提出了卢瑟福模型。
该模型认为原子核带正电,电子绕核轨道运动,但轨道具有固定半径,并且只能处于特定能级。
玻尔进一步完善了卢瑟福模型,提出了著名的玻尔理论。
玻尔理论揭示了电子能级与光谱的关系,并成功解释了氢原子光谱实验结果。
然而,该模型仍未能解释更复杂的原子结构和光谱现象。
3. 波尔兹曼统计与玻尔-索末菲理论为解释原子内部以及热力学性质,波尔兹曼统计学家公式化描述了粒子分布的概率规律。
玻尔-索末菲理论进一步在波尔兹曼统计学基础上,成功解释了气体中原子的能级分布和热力学性质。
这些理论为后续量子力学的发展奠定了基础。
4. 波尔模型与量子力学的兴起20世纪20年代,量子力学的发展彻底改变了原子结构研究的道路。
波尔模型的出现,揭示了电子在能级间跃迁的规律,并提出了著名的不确定性原理。
后来,薛定谔方程与矩阵力学的发展,进一步建立了一种新的描述原子结构的理论框架——量子力学。
5. 量子力学的发展与应用量子力学丰富了我们对原子结构的认识,并拓展到了更深层次的物质世界。
研究人员通过量子力学的研究,成功解释了原子光谱、化学键、晶体结构以及原子核内部结构等现象。
量子力学的应用延伸到电子学、材料科学、核物理等领域,推动了科学技术的发展和进步。
总结起来,原子结构的演变历程经历了经典原子模型、卢瑟福模型、玻尔理论等多个阶段,最终发展为量子力学的框架。
原子结构和分子结构原子结构是指原子内部的组织和排列方式。
每个原子由一个中心核和围绕核运动的电子构成。
原子核由带正电荷的质子和不带电的中子组成,质子的数量决定了原子的元素性质。
电子带有负电荷,数量与质子相等,并且通过电子壳的方式环绕在原子核周围。
原子中的电子壳分为不同的能级,每个能级可以容纳一定数量的电子。
第一层能级最接近原子核,容纳最多2个电子;第二层能级可以容纳最多8个电子;第三层能级可以容纳最多18个电子,依此类推。
原子的化学性质主要由其电子层次和电子的组合方式决定。
分子结构是指原子之间的相互排列和连接方式。
当两个或多个原子通过化学键相互连接时,形成了分子。
分子组成物质的最小单位,不同的分子由不同的原子按照一定的方式组合而成,从而表现出不同的化学性质和物理性质。
分子可以是由相同元素的原子组成,也可以是由不同元素的原子组成。
当原子通过共用电子对形成共价键时,形成了共价分子。
共价键是通过电子的共享而形成的,可以是单键、双键或三键。
而当原子通过电子的捐赠和受体形成离子键时,形成了离子分子。
离子分子是由正离子和负离子通过静电力相互吸引而形成的。
此外,还有一种特殊的分子结构,即金属结构。
金属结构中,金属原子通过金属键相互连接,形成了金属晶格。
原子结构和分子结构的理解对于解释物质的性质和行为非常重要。
根据原子结构和分子结构的不同,物质会呈现出不同的化学性质和物理性质。
例如,不同原子围绕在一起形成不同的分子,导致了物质的不同相态(如气体、液体和固体),不同的熔点和沸点,以及不同的导电性和热导率等。
此外,分子结构的调整也可以改变物质的化学性质。
通过改变分子结构可以制备出不同的化合物,从而得到不同的性质和用途。
例如,通过改变原子的连接方式,可以改变分子的极性和非极性,从而影响溶解性和化学反应性。
总之,原子结构和分子结构是物质的基本组成单位,对于我们理解物质的性质和行为具有重要意义。
通过研究和理解原子结构和分子结构,我们可以更好地解释物质的化学性质和物理性质,并且可以通过调整分子结构来改变物质的性质和用途。
原子的结构知识点总结1.原子的概念:原子是构成物质的最小粒子,由带正电荷的质子、带负电荷的电子和电中性的中子组成。
原子的直径约为0.1纳米。
2. 原子核:原子核是原子的中心部分,由质子和中子组成。
质子的质量是中子的约2倍,且都是质子质量单位(amu)的单位。
原子核的直径约为10^-5纳米,直径与整个原子的直径比例为1:10,000。
3.电子云:电子云是电子在原子周围的空间分布,描述了电子的可能位置。
根据量子力学理论,电子云存在各种能量级别的轨道,电子不能在轨道之间连续移动,只能跃迁到具有合适能量的轨道上。
4.轨道:轨道是描述电子在原子中可能找到的位置的功能。
主量子数决定能量级别和轨道大小,主量子数n的平方是一个轨道所能容纳电子的最大数目。
每个轨道可以容纳不超过2个电子。
5.能级分布:在原子中,能级依次增加。
第一能级最低,以此类推。
能级间的差异是电子能量的差异。
电子填充能级时尽量填充低能级。
6.电子排布:按构建原子的原子序数排布,如H(氢)有1个电子,He(氦)有2个电子,Li(锂)有3个电子等。
按能级填充原子中的电子。
7.原子核结构:原子核由质子和中子组成,质子带正电荷,中子无电荷。
原子核的质量和电荷都集中在非常小的范围内。
8.原子量和原子序数:原子量是一个原子中质子和中子的总数。
原子序数是一个原子中质子数(也是电子数)的数目。
原子序数决定了元素的化学性质。
9.同位素:同位素是原子序数相同但质量数不同的原子,它们具有相同的化学特性。
10.质子数与电子数:一个元素的原子质子数与电子数相同,因为一个原子是电中性的。
11.电子的能级跃迁:电子可以从一个能级跃迁到另一个能级,吸收或释放能量,导致光的发射或吸收。
这解释了原子光谱和电子能级。
12.元素周期表:元素周期表按照原子序数(即质子数)的增加顺序排列。
元素周期表显示不仅每个元素的质子数,而且还显示了元素的原子量、符号和名称。
13.原子的量子力学模型:量子力学模型通过描述原子内部发生的量子力学过程,提供了对原子结构的更深入的理解。
原子结构知识:原子的壳层结构原子是构成物质的基本单位,其结构由带电的质子和不带电的中子组成的原子核,以及围绕原子核的带负电的电子组成。
电子在形成原子中具有极为重要的作用,特别是它们围绕原子核的运动方式和组成原子的化学性质密切相关。
电子栖息在特定的排列方式中,这些排列方式成为壳层结构。
本文将深入探讨原子的壳层结构。
一、原子的壳层结构原子的电子以不同的方式凝聚在不同的能级(壳层)上。
壳层通常用字母K、L、M、N、O、P、Q等来表示,其中K表示离原子核最近的能级。
K壳层最多容纳2个电子,L壳层最多容纳8个电子,M壳层最多容纳18个电子,N壳层最多容纳32个电子,O壳层最多容纳50个电子,P壳层最多容纳72个电子,Q壳层最多容纳98个电子。
电子的排列遵循一定的规律,可以通过原子序数来预测原子的壳层结构。
二、壳层结构的规律1.饱和壳层和开壳层当一个壳层的电子容量达到最大值时,称该壳层为饱和壳层。
例如,氢原子只有一个电子,其壳层结构为1s1,即K壳层只包含一个电子,K壳层是氢原子的饱和壳层。
对于氦原子,其原子结构为1s2,即包括两个电子的K壳层,也是饱和壳层。
当电子填满饱和壳层时,原子结构稳定且具有较强的化学稳定性。
相反,当一个壳层的电子数目未达到最大值时,称该壳层为开壳层。
电子填充在开壳层中时,其原子不稳定,容易发生化学反应。
2.电子填充顺序的规律电子填充壳层的顺序主要遵循以下规律:1)阿伦尼乌斯规则在填充电子的过程中,电子首先填充能量较低的、空间较小的K 壳层,其次是容量更大的L壳层,随后依次填充较高的M壳层、N壳层等。
阿伦尼乌斯规则描述了壳层电子填充的基本顺序及其重要性。
2)泡利排斥原理泡利排斥原理说明,在一个原子同一个壳层内的电子不可能完全相同。
例如,在L壳层中的8个电子必须全部具有不同的自旋方向,以有效地充满空间。
3)洪德规则洪德规则说明,在电子填充时,壳层能级中存在多个子能级时,先占有单态电子,后占有双态电子。
原子结构知识:原子的电荷分布原子是人类科学探索的一个重要领域,它是构成物质的基本单位。
在原子中,有电子围绕着原子核运动,电子运动状态的不同决定了原子的性质和行为。
了解原子的电荷分布对于理解原子基本结构和物理规律非常重要。
一、原子的基本结构原子有三个基本部分:质子、中子和电子。
质子和中子组成原子核,电子绕原子核运动。
质子带有正电荷,电子带有负电荷,中子没有电荷。
原子的质量主要集中在原子核中,电子的质量很小,约为原子核质量的1/1836。
原子的质子数(也叫原子序数)决定了原子的元素性质,质子数相等的原子具有相同的化学性质。
例如,氢原子只有一个质子,氧原子有8个质子,它们的化学性质是不同的。
二、原子的电荷分布原子中的电子和质子带有相等大小的但相反的电荷,因此静电吸引力使得电子绕原子核旋转。
但电荷是连续分布的,电子的位置和运动状态不断变化,因此原子中的电荷分布复杂且难以描述。
理论上,在原子中,电子的电荷分布应该是球对称的。
但实际上,由于电子运动的不确定性,电子可能存在于各种不同的位置和能级上,因此电荷分布是球对称的只是一种在平均意义下的近似表述。
在原子的轨道运动中,电子呈现波动性质。
根据电子波长和波幅的变化,可以推算出电子的运动状态和所处位置的概率分布。
这种概率分布被称作波函数,波函数的平方会给出电子在不同运动状态下的概率密度分布,即电子云的分布。
由于电子云不是球对称的,原子的电荷分布也不是球对称的。
实际上,电子的轨道形状和电子云的密度分布会因电子的不同能级而有所不同。
三、原子结构的测量技术为了研究原子结构和电荷分布,科学家们利用了许多高精度的实验技术。
其中最常用的方法是光谱学和散射实验。
光谱学是研究物体光谱和光性质的学科。
原子会发射或吸收特定波长的电磁辐射,这些波长可以用来识别原子的种类和确定能级。
通过对原子能级的分析,科学家可以确定电子的能量、位置和运动状态,从而研究原子的电荷分布。
散射实验是研究粒子碰撞和运动的方法。
《原子结构》教案
知识目标:
1、理解原子核的结构
2、理解质量数和AZX的含义,
3、掌握质量数、质子数、中子数、电子数间的关系。能实行质量数、质子数、
中子数、电子数间的简单计算
4、理解元素、核素、同位素的含义,会判断同位素
水平情感目标:
1、培养学生对数据的分析处理、概括总结水平
2、尝试使用比较、归纳等方法对信息实行加工
3、通过假说、模型等科学研究方法培养学生科学的学习方法和科学的学习态度
4、通过放射性同位素作用的自学和查阅,激发学生学习的热情
学习重点:
原子核的结构,构成原子的各微粒间的关系及同位素的判断
难点:原子核的结构及构成原子的各微粒间的关系
教法:
模型展示、多媒体动画模拟、问题推动、对比归纳
学法:
交流研讨、比较归纳、练习巩固
[引入]初中我们学习了原子结构的初步知识,原子由原子核和核外电子构成。那
么原子核和核外电子在原子中的相对关系是怎样的呢?下面我们重温一下著名
的卢瑟福实验。
[多媒体动画演示1]卢瑟福的α粒子散射实验及实验现象2·
[学生活动]学生观看实验,总结现象,分析现象并思考问题:
1、绝大部分粒子穿过金箔不偏转,说明了什么?
2、少数粒子被偏转,个别粒子被反射分别说明了什么?
3、试想象推测原子的结构模型
[多媒体演示2]展示卢瑟福的解释:原子:原子核(带正电);核外电子(带负电)
在此实验的基础上,卢瑟福提出了“核式原子模型”,较好的解释了原子核与核外
电子的关系,那么,原子核内部的结构又是怎样的?
【多媒体演示3】学习目标1·
一、原子核 核素
1、原子核的构成
[交流研讨]9·阅读P3表格,分析电子、质子、中子的基本数据表,思考讨论以下
问题
微粒 电子 质子 中子
质量
(Kg)
9.109×10-31 1.673×10-27 1.675×10
-27
相对质
量
0.000548 1.007 1.008
电量(C) 1.602×
10-19 1.602×10
-19
0
电荷
-1 +1 0
1、电子、质子各带何种电荷?中子带不带电?为什么原子呈电中性?
2、在原子中质子数、核电荷数和电子数之间存有怎样的关系?为什么?
3、原子的质量主要由哪些微粒决定的?
4、若忽略电子的质量,质子、中子的相对质量取近似值,试推测原子的相对质
量的数值与核内质子数和中子数的关系。
[学生总结]回答问题1、2
[多媒体演示4]
结论(1)核电荷数、质子数、核外电子数之间的关系:
核电荷数=质子数=核外电子数
[思考]以上关系式是否适合所有的微粒?(以Na
+、Cl-
为例实行分析)
核电荷数 质子数 核外电子数
Na
+
Cl
-
注意:以上关系式只适用于原子,不适用于阴阳离子。
[学生总结]回答问题3、4
结论(2):原子中各微粒之间的关系:质子数(Z)+中子数(N)=质量数(A)
[学生阅读P3-P4第一段]掌握质量数和AZX的意义:表示一个质量数为A、质子
数为Z的原子。
跟踪练习:2·
1、判断正误:
(1)原子核都是由质子和中子组成。
(2)氧元素的质量数是16
2、符号为baX
n-
的微粒,核电荷数是 ,中子数是 ,电子总数是
。
符号为baYm+的微粒,核电荷数是 ,中子数是 ,电子总数是
。
结论
:阴离子中:核电荷数 = 质子数是 = 电子数 电荷数
阳离子中:核电荷数 = 质子数是 = 电子数 电荷数
说明:
X为元素符号,AZX 为原子符号,baXn-和baYm+为离子符号。
[多媒体演示5]跟踪练习答案
[迁移应用P4]思考回答2·
1、在科学研究中,人们常用“3517Cl”来表示某种氯原子,说明其中符号和数字的
意义。
2、碳-14具有衰变性,可用于考古工作中推测遗物的年代,碳-12为计算原子相
对质量的标准,试用
A
Z
X表示这两种碳原子,分析二者在原子结构上有什么异
同?
结论:碳-12和碳-14都能够用元素符号C来表示,它们都是碳元素,二者质子
数相同而中子数不同。质子数相同而中子数不同的同一类原子总称为元素。同一
元素的不同原子之间互称为同位素。
2、核素
[交流.研讨]5·学生阅读课本P4-P5第一段,比较氢元素的三种原子的结构图,填
写下表,回答问题
原子
氕(H) 氘(D) 氚(T)
质子数
中子数
质量数
1、氕、氘、氚的原子结构有什么异同?
2、它们是不是同一种元素?是不是同一种原子?三者之间什么关系?
3、当前已发现了112种元素,是否就发现了112种原子?为什么?
4、哪些微粒决定了元素的种类?哪些微粒决定了核素的种类?
[多媒体演示6]
小结:
元 素:具有相同质子数(核电荷数)的同一类原子的总称。
核 素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一种元素的不同核素互为同位素。
质子数决定元素的种类,质子数和中子数决定核素的种类。
说明:①三者的研究对象都是原子②同一元素的不同核素之间互称为同位素③同
种元
素能够有多种核素(同位素)所以元素的种数远少于原子的种数。
回顾练习:比较同位素与同素异形体:1·
同位素 同素异形体
研究对象
概 念
当堂检测:
(4分完成前三题,标*号的为选做题)
1、32He能够作为核聚变的材料。下列关于32He的叙述准确的是( )
A、32He核31H互为同位素
B、32He原子核内中子数为2
C、32He原子核外电子数为2
D、32He代表原子核内有2个质子和3个中子的氦原子
2、已知核电荷数为118的一种原子的质量数为293,则该原子中中子数与电子数
之差为( )
A、0 B、57 C、118 D、175
3、下列八种化学符号:11H2、21H2、146C、63Li、2311Na、147N、73Li、 2412Mg
⑴表示核素的符号共 种
⑵互为同位素的是 和
⑶质量数相等,但不能互称同位素的是 和
⑷中子数相等,但质子数不相等的是 和 。
*4、某元素的一种原子R质量数为A,该原子形成的微粒Rn-共有x个电子,
该元素的原子R中的中子数为( )
A、A-x-n B、A+x+n C、A-x+n D、A+x-n
*5、元素A、B,A的核电荷数为n,A2+比B2-少8个电子,则B原子的核电荷
数为?