难溶电解质的溶解
- 格式:ppt
- 大小:649.00 KB
- 文档页数:31

溶解平衡20℃时,电解质在水中的溶解度与溶解性存在如下关系:(1)沉淀的生成①调节pH法②沉淀剂法(2)沉淀的溶解①酸溶解法②盐溶液溶解法③氧化还原溶解法(3)沉淀的转化溶度积和离子积(K sp Q c )A m B n(s) m A n+(aq)+n B m-(aq)判断:1.难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动2.K sp(AB2)小于K sp(CD),则AB2的溶解度小于CD的溶解度。
即K sp小的物质其溶解能力一定比K sp大的物质的溶解能力小3.不可能使要除去的离子全部通过沉淀除去。
一般认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时,沉淀已经完全4.在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀5.溶解平衡一般是吸热的,温度升高平衡右移,K sp增大。
1.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。
某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数K b=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。
请回答:(1)写出A与氢氧化钠溶液反应的化学方程式:________________________________________________________________________。
(2)上述流程中两次使用试剂①,推测试剂①应该是__________A.氢氧化钠B.氧化铝 C.氨水D.水(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________(任写一点)。
(4)H中溶质的化学式:______________。
(5)计算溶液F中c(Mg2+)=________(25 ℃时,氢氧化镁的K sp=5.6×10-12)。



一了解难溶电解质在水中的溶解情况难溶电解质是指在水中只能溶解出很少的电离质的化合物。
它们的溶解度较低,即使加入大量的水也无法完全溶解。
这些难溶电解质溶解时会发生一系列的化学反应,产生电离质和络合物。
第一部分:难溶电解质的溶解性质A.溶解度溶解度是指单位温度下单位溶剂中最多能溶解的物质的质量或体积。
对于难溶电解质而言,溶解度往往非常低。
溶解度的大小取决于电离度、晶格能和水合能等因素。
B.溶解过程难溶电解质溶解过程中,会发生一系列的化学反应。
通常,难溶电解质会与水发生化学反应生成水合电离质或络合物。
例如,对于AgCl来说,它的溶解过程可以表示为:AgCl(s) ⇌ Ag+(aq) + Cl-(aq)在溶解过程中,通过水分子的关系,Ag和Cl离子被水合包围形成水合离子。
这些水合离子可以保持在水溶液中稳定存在。
第二部分:难溶电解质的溶解平衡A.溶解平衡常数难溶电解质的溶解过程可以用溶解平衡常数来描述。
溶解平衡常数是指在固体与溶液之间建立平衡时,单位溶解物的摩尔数平方与单位电离离子摩尔数之积的比值。
以AgCl为例,它的溶解平衡常数Ksp可以表示为:Ksp = [Ag+][Cl-]Ksp表示在平衡条件下AgCl的最大溶解度。
B.影响溶解度的因素影响难溶电解质溶解度的因素有以下几点:1.温度:通常情况下,溶解度随温度的升高而增大。
2.动态平衡:难溶电解质的溶解过程是动态平衡的。
在溶解过程中,溶解出的离子会重新结合成固体,这两个过程达到平衡。
3.离子平衡:当溶液中已存在与溶质离子相同的离子时,会影响溶质的溶解度。
4.其他溶质:其他溶质的加入可能会改变难溶电解质的溶解度。
这是因为其他溶质会影响溶剂的物化性质,从而影响溶解过程。
第三部分:难溶电解质的应用A.催化作用难溶电解质在催化剂中起着重要作用。
催化剂通常是通过与反应物生成络合物,从而加速反应速度。
难溶电解质可以提供离子,增加反应物与催化剂的接触面积,从而提高催化剂的催化能力。





难溶电解质的溶度积与溶解度的关系1. 难溶电解质的概念难溶电解质是指在水中溶解度非常小的电解质,即使在饱和溶液中也很难溶解。
通常来说,难溶电解质的溶解度小于0.1mol/L。
这类物质在水中的溶解度十分有限,常常需要一定的条件或者较长的时间才能达到饱和。
2. 溶度积的概念溶度积是指在一定温度下,固体电解质在溶液中达到饱和时,其浓度乘积的值。
对于一般的电解质,其溶度积等于它的溶解度(mol/L)的n次方,其中n是电解质溶解时生成的离子数。
3. 难溶电解质的溶度积对于难溶电解质来说,由于它们在水中的溶解度极低,因此其溶度积也会非常小。
对于银氯化物(AgCl),其溶度积表达式为[K+] * [Cl-] = 1.8*10^-10,可以看出其溶度积的值非常小,说明了它在水中的溶解度很低。
4. 溶度积与溶解度的关系溶度积表示了固体电解质在溶液中达到饱和时的离子浓度乘积,而溶解度则是指在一定温度下,单位体积溶液中能溶解固体电解质的量。
二者是密切相关的,溶解度积的大小决定了电解质在水中的溶解度大小。
5. 个人观点和理解从溶度积和溶解度的关系来看,溶度积可以被看作是电解质在水溶液中溶解程度的衡量标准。
对于难溶电解质来说,其溶度积很小,导致其溶解度也非常低。
在化学实验和生产中,我们常常会根据溶度积的大小来判断一个物质在水中的溶解程度,这对于溶液的制备和纯度的控制都有着重要的意义。
总结回顾难溶电解质的溶度积与溶解度的关系,是化学中重要的概念之一。
通过对这一概念的深入理解,我们能更好地把握电解质在水溶液中的溶解特性,进而为化学实验和产业生产提供参考依据。
以上就是我对于难溶电解质的溶度积与溶解度的关系的见解和探讨,希望对您有所帮助。
难溶电解质是指在水中溶解度非常小的电解质,即使在饱和溶液中也很难溶解。
通常来说,难溶电解质的溶解度小于0.1mol/L。
这类物质在水中的溶解度十分有限,常常需要一定的条件或者较长的时间才能达到饱和。

难溶电解质的溶解平衡1.沉淀溶解平衡(1)概念在一定温度下,当难溶电解质溶于水形成饱和溶液时,沉淀溶解速率和沉淀生成速率相等的状态。
(2)溶解平衡的建立固体溶质溶解沉淀溶液中的溶质⎩⎪⎨⎪⎧v溶解大于v沉淀,固体溶解v溶解等于v沉淀,溶解平衡v溶解小于v沉淀,析出晶体(3)特点(4)表示AgCl在水溶液中的电离方程式为AgCl===Ag++Cl-。
AgCl的溶解平衡方程式为AgCl(s)Ag+(aq)+Cl-(aq)。
2.沉淀溶解平衡的影响因素(1)内因难溶电解质本身的性质。
溶度积(K sp)反映难溶电解质在水中的溶解能力。
对同类型的电解质而言,K sp数值越大,电解质在水中溶解度越大;K sp数值越小,难溶电解质的溶解度也越小。
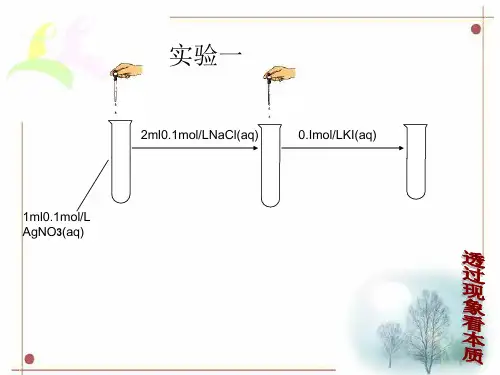
(2)外因①浓度(K sp不变)a.加水稀释,平衡向溶解的方向移动;b.向平衡体系中加入难溶物相应的离子,平衡逆向移动;c.向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向溶解的方向移动。
②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解的方向移动,K sp 增大。
(3)实例 以AgCl (s )Ag +(aq )+Cl -(aq ) ΔH >0为例20 ℃时电解质在水中的溶解度与溶解性存在如下关系: (1)沉淀的生成 ①调节pH 法如除去CuCl 2溶液中的杂质FeCl 3,可以向溶液中加入CuO ,调节溶液的pH ,使Fe 3+形成Fe(OH)3沉淀而除去。
离子方程式为Fe 3++3H 2OFe(OH)3+3H +,CuO +2H+===Cu 2++H 2O 。
②沉淀剂法如用H 2S 沉淀Hg 2+的离子方程式为Hg 2++H 2S===HgS ↓+2H +。
(2)沉淀的溶解①酸溶解法:如CaCO 3溶于盐酸,离子方程式为CaCO 3+2H +===Ca 2++CO 2↑+H 2O 。
②盐溶解法:如Mg(OH)2溶于NH 4Cl 溶液,离子方程式为Mg(OH)2+2NH +4===Mg 2++2NH 3·H 2O 。
第三十三讲难溶电解质的溶解平衡基础知识梳理一、沉淀溶解平衡1. 沉淀溶解平衡的概念:在一定温度下,当难溶电解质的溶液中,沉淀的速率等于沉淀速率时,即达到沉淀的溶解平衡状态。
2. 沉淀溶解平衡的建立固体溶质溶液中的溶质⑴V溶解V沉淀,固体溶解;⑵V溶解V沉淀,溶解平衡;⑶V溶解V沉淀,析出晶体。
3. 沉淀溶解平衡的影响因素⑴内因:难溶电解质本身的性质。
⑵外因:①浓度:加水,平衡向溶解方向移动。
但Ksp不变。
②温度:升温,多数平衡向溶解方向移动,多数难溶电解质的溶解度随温度的升高而增大,升高温度,平衡向溶解方向移动Ksp增大。
③其他:向平衡体系中加入可与体系中的某些离子反应的更难溶解或更难电离或气体的离子时,平衡向溶解方向移动,但Ksp不变。
二、溶度积常数及其应用1.表达式:难溶固体在溶液中达到状态时,离子浓度保持不变(或一定)。
各离子浓度是一个常数,这个常数称之为溶度积常数简称为溶度积,用符号Ksp表示。
即:M m A n(s)mM n+(aq)+nA m+(aq) Ksp=Ksp仅受温度影响。
2.溶度积规则:某难溶电解质的溶液中任一情况下离子积Qc和溶度积Ksp的关系:①Qc Ksp时,溶液过于饱和,析出沉淀。
②Qc Ksp时, 饱和溶液,沉淀溶解平衡状态。
③Qc Ksp时,溶液未饱和,无沉淀析出。
三、沉淀反应的应用及沉淀的转化1.沉淀的生成:⑴应用:可利用生产沉淀来达到分离或者除去某些离子的目的⑵条件①生成沉淀的反应能够发生②生成沉淀的反应进行的越完全越好⑶方法调节PH法,加沉淀剂法。
如:Cu2+(Fe3+、Fe2+)离子和除去方法2.沉淀的溶解:根据溶度积规则,当Q c<K sp时,沉淀就向溶解的方向进行。
因此,使沉淀溶解的总原则就是设法使构成晶体离子的浓度减小使之满足Q c<K sp。
化学方法溶解沉淀的原则是:使沉淀溶解平衡向着溶解的方向移动。
常用的方法有:⑴酸碱溶解法:借助某些可溶性弱电解质(水、弱酸或弱碱),使难溶物的离子浓度降低而溶解。
难溶电解质的溶解平衡一.固体物质的溶解度1.溶解度:在一定温度下,某固体物质在100g 溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
符号:S ,单位:g ,公式:S=(m 溶质/m 溶剂 )×100g2.3.绝大多数固体物质的溶解度随温度的升高而增大,少数物质的溶解度随温度变化不明显,个别物质的溶解度随温度的升高而减小。
二?沉淀溶解平衡 1.溶解平衡的建立讲固态物质溶于水中时,一方面,在水分子的作用下,分子或离子脱离固体表面进入水中,这一过程叫溶解过程;另一方面,溶液中的分子或离子又在未溶解的固体表面聚集成晶体,这一过程叫结晶过程。
当这两个相反过程速率相等时,物质的溶解达到最大限度,形成饱和溶液,达到溶解平衡状态。
溶质溶解的过程是一个可逆过程: 2.沉淀溶解平衡绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。
以AgCl 为例:在一定温度下,当沉淀溶解和生成的速率相等时,便得到饱和溶液,即建立下列动态平衡:AgCl(s)Ag +(aq)+Cl -(aq)3.溶解平衡的特征1)动:动态平衡2)等:溶解和沉淀速率相等3)定:达到平衡,溶液中离子浓度保持不变4)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
三.沉淀溶解平衡常数——溶度积1)定义:在一定温度下,难溶性物质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫溶度积常数。
2)表达式:即:AmBn(s)mA n+(aq)+nB m -(aq) Ksp =[A n+]m ·[B m -]n例如:常温下沉淀溶解平衡:AgCl(s)Ag +(aq)+Cl -(aq),Ksp(AgCl)=[Ag +][Cl -] =1.8×10-10常温下沉淀溶解平衡:Ag 2CrO 4(s)2Ag +(aq)+CrO 42-(aq),Ksp(Ag 2CrO 4)=[Ag +]2[CrO2- 4] =1.1×10-123)意义:反应了物质在水中的溶解能力。