在六方ZnS晶体中,S原子作六方最密堆积,Z原子填在 一半的四面体空隙中,形成六方点阵。
23
半径比(r+/r-)规则: 其中一层横截面: (4r)22(2r2r)2
令r 1
r/r 0.414
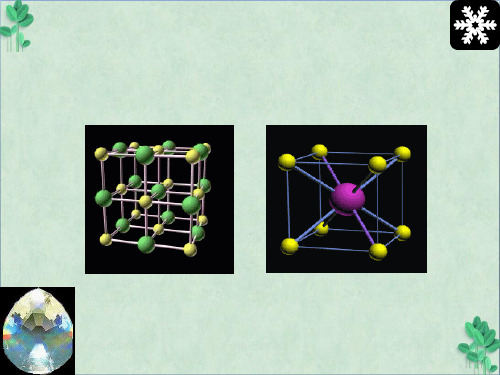
NaCl晶体
24
令 r_ =1, 则 ac =4 ab = bc = 2 + 2r+
因为abc为直角三角形, 所以 ac2 = ab2 + bc2 42 =2 (2 + 2r+ )2 r + =0.414
B.既无方向性又没有饱和性
5
3、影响离子键强度的因素
1) 离子电荷数的影响
2)
3) 2) 离子电子层结构
4)
2e, 8e, (9—17)e,
18e, (18+2)e
5) 3)离子半径的影响
离子半径:将离子晶体中的离子看成是相切 的球体, 正负离子的核间距 d 是r+ 和r- 之和
6) 半径大, 导致离子间距大, 所以 作用力小; 相反, 半径小, 则作用力大
6
离子半径的变化规律
①.同主族, 从上到下, 电子层增加, 具有相同电荷数的离子半径 增加.
②.同周期: 主族元素, 从左至右 离子电荷数升高, 最高价离子, 半径减小.
③.同一元素, 不同价态的离子, 正电荷高的半径小。
④.同一元素负离子半径较大; 正离子半径较小(H->H>H+)
⑤.周期表对角线上, 左上元素和右下元素的离子半径相似. 如: Li+ 和 Mg2+, Sc3+ 和 Zr4+ 的半径相似.
属于CsCl型晶体的化合物有: CsCl、CsBr、CsI、RbCl、TlCl、TlBr、 TlI、NH4Cl、NH4Br、NH4I等。