化学热力学基础(含基本概念与定律)
- 格式:ppt
- 大小:4.34 MB
- 文档页数:122


《化学热力学基础》PPT课件目录CONTENCT •引言•热力学基本概念与定律•热化学与化学反应的热效应•熵与熵增原理•自由能与化学平衡•相平衡与相图•结论与展望01引言化学热力学的定义与重要性定义化学热力学是研究化学变化过程中热量和功的相互转化以及有关热力学函数的科学。
重要性化学热力学是化学、化工、材料、能源等领域的重要基础,对于理解化学反应的本质、优化化学反应条件、开发新能源等具有重要意义。
化学热力学的发展历史早期发展19世纪初,随着工业革命的发展,热力学理论开始形成,并逐步应用于化学领域。
经典热力学建立19世纪中叶,经典热力学理论建立,包括热力学第一定律、热力学第二定律等基本定律被提出。
现代热力学发展20世纪以来,随着量子力学、统计力学等理论的发展,化学热力学在微观层面上的研究取得了重要进展。
课程目标与学习内容课程目标掌握化学热力学的基本概念、基本原理和基本方法,能够运用热力学知识分析和解决实际问题。
学习内容包括热力学基本概念、热力学第一定律、热力学第二定律、化学平衡、相平衡、化学反应热力学等。
通过学习,学生将了解热力学在化学领域的应用,培养分析和解决化学问题的能力。
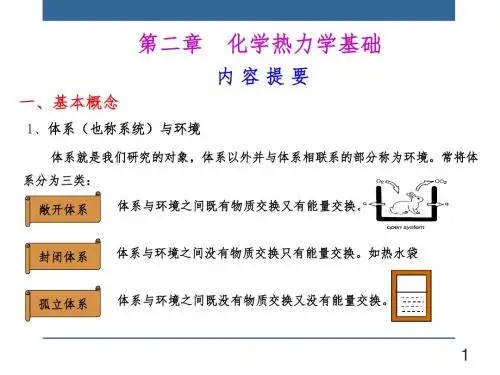
02热力学基本概念与定律80%80%100%系统与环境系统是指我们研究对象的那一部分物质或空间,具有明确的边界。
环境是指与系统发生相互作用的其他部分,是系统存在和发展的外部条件。
系统与环境之间通过物质和能量的交换而相互影响。
系统的定义环境的定义系统与环境的相互作用状态是系统中所有宏观物理性质的集合,用于描述系统的状况。
状态的概念状态函数的定义常见状态函数状态函数是描述系统状态的物理量,其值只取决于系统的始态和终态,与路径无关。
温度、压力、体积、内能等。
030201状态与状态函数热力学第一定律热力学第一定律的表述热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
热力学第一定律的数学表达式ΔU=Q+W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示外界对系统所做的功。


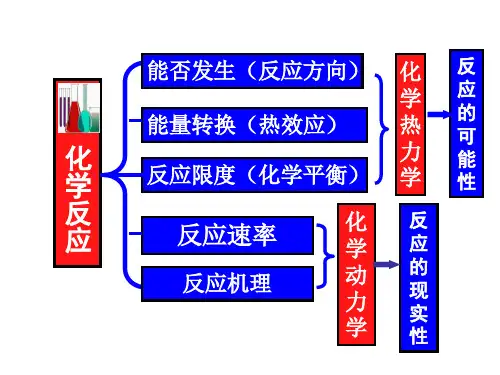
化学反应热力学的基本概念与定律热力学是研究物质热力学性质和热力学过程的学科,其中化学反应热力学就是涉及到化学反应的热力学方面。
化学反应热力学的研究涉及到热量、热能、焓、熵等概念,这些概念在热化学反应过程中起着重要的作用。
下面,我们将介绍化学反应热力学的基本概念与定律。
一、反应热反应热是指在恒压下,1 mol化学反应所放出或吸收的热量,其单位是焦耳/mol(J/mol)。
化学反应中,如果反应放出热量,则称为放热反应,反之,称为吸热反应。
放热反应的反应热为负值,吸热反应的反应热为正值。
例如,一个放热反应式为A+B→C,其反应热为ΔH,表示在恒压下,1 mol A和1 mol B反应得到1 mol C所放出的热量为ΔH J/mol,且ΔH为负值。
二、焓变焓变是化学反应所伴随的焓变化量,其单位是焦耳/mol(J/mol)。
在恒压下,化学反应中的焓变可以用反应热表示出来。
对于恒压下的化学反应,焓变(ΔH)等于反应物与生成物间的焓差。
例如,一个放热反应式为A+B→C,其反应热为ΔH,表示在恒压下,1 mol A和1 mol B反应得到1 mol C所放出的热量为ΔHJ/mol,且ΔH为负值。
因此,该反应的焓变ΔH也为负值。
三、熵变熵是衡量系统无序程度的物理量,其单位为焦耳/摄氏度(K)(J/K)。
对于化学反应,熵变(ΔS)通常用来描述反应过程中的混乱度以及产生或消耗热量的程度。
例如,一个化学反应A+B→C,其熵变为ΔS。
如果ΔS为正,则反应过程中熵增加,即反应的混乱度增加。
如果ΔS为负,则反应过程中熵减少,即反应的混乱度减少。
四、吉布斯自由能吉布斯自由能(G)是热力学中一个重要的物理量,它反映了化学系统的变化趋势。
吉布斯自由能的单位为焦耳/mol(J/mol),并常采用下式计算:G=H-TS。
其中,H是反应焓变,T是温度,S是反应熵变。
如果吉布斯自由能的变化量(ΔG)为负,则反应是自发的,热力学上存在趋势;如果ΔG为正,则反应是不自发的,不存在热力学趋势。

化学热力学基础概念化学热力学是研究化学反应中能量变化的学科,它是化学的一个重要分支。
在化学反应中,物质的能量会发生变化,热力学正是研究这种能量变化的规律和原理。
本文将介绍化学热力学的基础概念,包括能量、焓、熵和自由能等。
一、能量能量是物质存在的基本属性,是物质运动和相互作用的结果。
在化学反应中,能量的变化可以分为两类:热能和化学能。
热能是指物质的温度和热量的能量,而化学能是指物质分子之间的化学键能量。
二、焓焓是热力学中常用的一个物理量,表示系统的热能。
在化学反应中,焓的变化可以用来描述反应的放热或吸热过程。
焓的变化可以通过测量反应物和生成物的温度变化来确定。
三、熵熵是热力学中描述系统无序程度的物理量,也可以理解为系统的混乱程度。
在化学反应中,熵的变化可以用来描述反应的自发性和方向性。
熵的变化越大,反应越倾向于自发进行。
四、自由能自由能是热力学中描述系统能量状态的物理量,也是判断反应是否进行的重要指标。
自由能的变化可以用来判断反应的可逆性和方向性。
当自由能变化为负时,反应是可逆的;当自由能变化为正时,反应是不可逆的。
五、热力学第一定律热力学第一定律是热力学的基本定律之一,也被称为能量守恒定律。
它表明能量在物质转化过程中不会凭空消失或产生,只会从一种形式转化为另一种形式。
热力学第一定律可以用数学公式表示为ΔU = Q - W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
六、热力学第二定律热力学第二定律是热力学的另一个基本定律,也被称为熵增定律。
它表明在孤立系统中,熵总是增加的,即系统的无序程度总是增加的。
热力学第二定律还提出了熵增定律的两个等价表述:卡诺定理和熵不减原理。
七、热力学第三定律热力学第三定律是热力学的最后一个基本定律,也被称为绝对零度定律。
它表明在绝对零度下,系统的熵为零。
热力学第三定律还提出了绝对零度的概念,即绝对零度是温度的最低限度,为0K或-273.15℃。




第一章化学热力学基础第一节热力学第一定律一、基本概念和常用术语1、体系和环境体系:被选作研究对象的部分。
环境:体系之外并与体系密切相关的部分。
敞开体系:与环境有物质交换、有能量交换。
封闭体系:与环境无物质交换、有能量交换。
孤立体系:与环境无物质交换、无能量交换。
2、状态和状态函数状态:体系的宏观性质的综合表现。
状态函数:确定体系状态的物理量。
(p, V, T, U, H, S, G)状态函数特征:状态函数的改变量只与体系的始态、终态有关,而与变化途径无关。
分类:广度性质(具有加和性)强度性质(不具有加和性T, p )3、过程和途径过程:当体系的状态发生变化时,发生变化的经过。
途径:完成状态变化过程的具体步骤。
等容过程等温过程等压过程绝热过程二、热力学第一定律1、热和功(体系与环境能量交换的两种形式)规定:体系吸热:Q >0体系放热:Q <0环境对体系做功:W >0体系对环境做功:W <0特 点: 热和功不是状态函数其数值与具体途径有关2、热力学能U特 点: 是状态函数,广度性质,其绝对值未知。
3、热力学第一定律该定律的实质是能量守恒与转化定律。
第二节 化学反应的热效应一、反应热在封闭体系、非体积功=0的前提下,当反应物和生成物温度相同时,化学反应过程中吸收或放出的热量。
1. 恒容反应热(QV)W =0+(- p e x V )=0U= QV + W= QVQV 全部用于改变系统的热力学能2.恒压反应热 U Q V ∆=Vp Q U p ∆-=∆ex()12ex 12V V p Q U U p --=- 定义焓: ()111222)(V p U V p U Q p +-+=状态函数,广度性质焓变:Qp = H pV U H +=3. 反应进度ξ(读作“克赛”)a A + d D = g G + h H0= – a A – d D + g G + h H写成通式式中符号B 表示反应中的物质,而νB 为数字或简分数,称为物质B 的化学计量数。
化学热力学基础概念热力学是研究能量转化和能量传递规律的科学,而化学热力学则是热力学在化学领域的应用。
化学热力学基础概念是学习化学热力学的第一步,掌握这些基础概念对于深入理解化学反应过程和能量变化至关重要。
一、热力学系统在化学热力学中,我们首先要了解的概念是热力学系统。
热力学系统是指我们研究的对象,可以是封闭系统、开放系统或孤立系统。
封闭系统是与周围环境隔绝但能交换能量的系统,开放系统可以与周围环境交换能量和物质,而孤立系统则与外界完全隔绝,既不能交换能量也不能交换物质。
二、热力学过程热力学过程描述了系统从一个状态变化到另一个状态的过程。
常见的热力学过程包括等温过程、绝热过程、等压过程和等体过程。
在等温过程中,系统的温度保持不变;在绝热过程中,系统与外界没有热量交换;在等压过程中,系统的压强保持不变;在等体过程中,系统的体积保持不变。
三、热力学状态函数热力学状态函数是描述系统状态的函数,与系统的过程无关,只与系统的初末状态有关。
常见的热力学状态函数包括内能、焓、熵和自由能等。
内能是系统的热力学状态函数,表示系统的总能量;焓是在恒压条件下的状态函数,表示系统的热力学状态;熵是系统的无序程度的度量,是一个状态函数;自由能是系统能量的一种表达形式,包括吉布斯自由能和哈密顿量等。
四、热力学第一定律热力学第一定律是能量守恒定律在热力学中的表述,它指出能量可以从一种形式转化为另一种形式,但总能量守恒。
数学表达式为ΔU = q + w,即系统内能的变化等于系统吸收的热量与对外界做的功的和。
其中,ΔU表示内能的变化,q表示吸收的热量,w表示对外界做的功。
五、热力学第二定律热力学第二定律是热力学中最重要的定律之一,它规定了自然界中热现象发生的方向。
热力学第二定律有多种表述形式,其中最著名的是克劳修斯表述和开尔文表述。
克劳修斯表述指出热量不会自发地从低温物体传递到高温物体,而开尔文表述则指出不可能制造出一个只吸收热量而不做功的系统。