人教版高一化学必修一知识点:氧化还原反应
- 格式:docx
- 大小:18.80 KB
- 文档页数:7

第一章氧化还原反应一、化学反应类型(1)氧化还原反应的实质:发生电子转移(电子的得失或电子对的偏移)。
化合价降低 +ne-被还原氧化剂+还原剂=还原产物+氧化产物化合价升高-ne-被氧化(2)氧化剂:得电子(或电子对偏向)的物质;还原剂:失去电子(或电子对偏离)的物质;氧化性:氧化剂具有氧化性,指得电子的性质或能力;还原性:还原剂具有还原性,指失电子的性质或能力;被氧化:还原剂被氧化;被还原:氧化剂被还原;氧化产物:还原剂失电子被氧化后的产物;还原产物:氧化剂得电子被还原后的产物。
联系:氧化剂(具有氧化性)——得电子——化合价降低——被还原——发生还原反应——还原产物还原剂(具有还原性)——失去电子——化合价升高——被氧化——发生氧化反应——氧化产物2、氧化还原反应的一般规律同一反应中:①氧化反应与还原反应同时发生,相互依存。
②氧化剂得电子总数与还原剂失电子总数相等。
即氧化剂化合价降低总数与还原剂化合价升高总数相等。
3、氧化还原反应中电子转移的表示方法(双线桥法)书写要求:(1)连接反应前后不同价态的同一种元素;(2)线桥跨越等号;(3)一定要标出得、失电子的总数,并且数值相等。
二、离子反应1.强电解质和弱电解质融化状态下能否导电。
②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。
③能导电的物质并不全部是电解质:如铜、铝、石墨等。
④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
⑤电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数相等,股显电中性,称电荷守恒。
(2)强电解质和弱电解质(1)离子反应a.定义:有离子参加或有离子生成的反应称为离子反应。
指在水溶液中有电解质参加的一类反应。
b.本质:溶液中某些离子能相互作用,使这些离子的浓度减小。
c.、离子反应分类与发生条件:间的某个反应,而且可以表示同一类型的离子反应。
书写步骤:“一写”:首先以客观事实为依据写出反应的化学方程式;“二改”:把易溶于水、易电离物质改写成离子形式(最关键的一步):“三删”:删去方程式两边未参加反应的离子;“四查”:检查离子方程式两边各元素的原子个数和电荷总数是否相等。



氧化还原反应的基本规律1、守恒规律氧化还原反应中,氧化剂得到电子总数等于氧化剂失去的电子总数,表现为化合价升高总数等于化合价降低总数。
2、强弱规律对于氧化还原反应“氧化剂+还原剂====还原产物+氧化产物”能进行,则满足:氧化性:氧化剂>氧化产物还原性:还原剂>还原产物3、价态规律当元素具有可变化合价时,一般情况下:例如,浓H2SO4中的S只具有氧化性,H2S中的S只具有还原性,单质S既具有氧化性也具有还原性。
4.先后规律在浓度相差不大的溶液中(1)如果一种氧化剂遇到了几种还原剂时,将按照还原性由强到的顾序依次反应。
例如:Zn、Fe同时加入盐酸中,还原性Zn>Fe,则Zn先与盐酸反应。
(2)如果一种还原剂遇到了几种氧化剂时,将按照氧化性由属到弱的顺序依次反应。
例如在含有Fe2+、Cu2+的溶液中加入锌粉,氧化性:Cu2+>Fe2+,则锌粉先与Cu2+反应,然后再与Fe2+反应5.归中规律例如:守恒法在金属与硝酸反应计算中的应用1、某稀硫酸和稀硝酸的混合溶液中c(NO3-)+c(SO42-)=2.5mol/L,取200mL该混合酸,则能溶解铜的最大质量为()A. 12.8gB. 19.2gC. 32.0gD. 38.4g通过离子方程式进行计算2、锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,产物有硝酸锌、X和水,则X可能是()A、NH4NO3B、N2OC、N2O3D、NO23、将38.4g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:①NO2的体积为___L.②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为___mol•L-1.4、在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、0.1 mol/L,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是()A.0.15 mol/L B.0.225 mol/L C.0.30 mol/L D.0.45 mol/L5、R2O6n-在一定条件下可以把Mn2+氧化成MnO4-,若反应后R2O6n-转变为RO3n-.又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为()6、已知2Fe2++Br2═2Fe3++2Br−往100mL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/3的溴离子被氧化成溴单质。

一、氧化还原相关概念1.定义:凡是反应过程中有元素化合价变化(或电子转移)的反应叫氧化还原反应。
2.特征 : 元素化合价的升降;3.实质 : 电子转移。
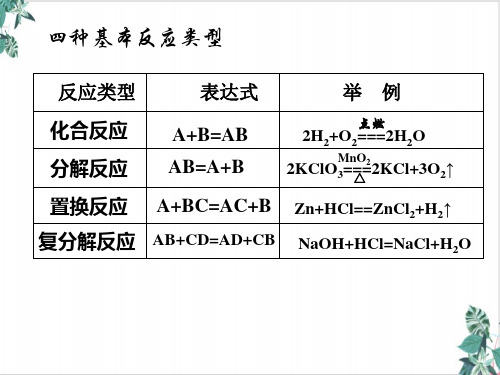
4.规律:二.氧化还原反应与四种基本反应类型三.氧化还原中的电子转移表示法(应用于实际)(1) 双线桥法:表示同一元素的原子或离子间的电子转移情况(必须表明得失电子,其他可不标)(2)单线桥法:在反应物中箭头由还原剂指向氧化剂2==2Na2O常见的氧化剂(1)非金属性较强的单质 : O2、Cl2(2)变价元素的高价态化合物:KMnO4、FeCl3、浓硝酸、浓硫酸(3)其他 : HCIO、MnO2、Na2O2、H2O2、漂白粉Ca (CIO)2常见的还原剂(1)金属性较强的单质: Al、Fe、Zn(2)某些非金属单质: H2、S、C(3)变价元素的低价态化合物: CO(4)其他: 浓盐酸、NH3四、氧化性、还原性强弱的判断1.根据氧化还原反应的方向判断氧化剂(氧化性)+还原剂(还原性)=还原产物+氧化产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物五、氧化还原反应的有关规律1.守恒规律 : 化合价升降总数相等,得失电子总数相等。
2.强弱规律 : 强氧化剂+强还原剂=弱还原产物+弱氧化产物。
3.价态规律:元素处于最高价态,只有氧化性;处于最低价态,只有还原性;若处于中间价态,既有氧化性又有还原性,但在一个反应中,主要表现一种性质。
五、附基本知识点1、化合价口诀钾钠银氢正一价 , 钙镁钡锌正二价;铝有正三氧负二,氯负一价最常见2、原子团NH4+铵根SO42-硫酸根 NO3- 硝酸根OH-氢氧根CO32-碳酸根PO43-磷酸根3、“口诀”熟记难溶(不溶)物质。
钾、钠、铵盐水中溶。
硝酸盐见水无影踪。
盐酸盐不溶银、亚汞(熟记AgCl不拆)。
硫酸盐不溶钡和铅(熟记BaSO4不拆)。
习题。
高一化学氧化还原反应知识点高一化学氧化还原反应知识点(一)1、根据氧化还原反应方程式化合价降低,得电子,被还原氧化剂+还原剂==还原产物+氧化产物化合价升高,失电子,被氧化在同一氧化还原反应中,氧化性:氧化剂>氧化产物还原性:还原剂>还原产物氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
例:2Cl2+2NaBr===2NaCl+Br22、根据金属活动性顺序表在金属活动性顺序表中,金属的位置越靠前,其还原性就越强(铂金除外);金属的位置越靠后,其阳离子的氧化性就越强。
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au3、根据元素周期表同周期元素,随着核电荷数的递增,其单质氧化性逐渐增强,还原性逐渐减弱。
同主族元素,随着核电荷数的递增,其单质氧化性逐渐减弱,还原性逐渐增强。
对于氧化剂来说,同族元素的非金属原子,它们的最外层电子数相同而电子层数不同时,电子层数越多,原子半径越大,就越难得电子。
因此,它们单质的氧化性就越弱。
4、根据反应的难易程度氧化还原反应越容易进行(表现为反应所需条件越低),则氧化剂的氧化性和还原剂的还原性就越强。
(如卤族元素和氢气反应)高一化学氧化还原反应知识点(二)1、电子守恒规律:氧化剂得电子总数等于还原剂失电子总数。
如:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO42、既有氧化性又有还原性的物质与强还原性物质反应时表现氧化性,与强氧化性物质反应时表现还原性,(亚铁离子和锌、次氯酸根)在自身的氧化-还原反应中既表现氧化性又表现还原性(氯气歧化)。
稀硫酸与活泼金属单质反应时,是氧化剂,起氧化作用的是H,被还原生成H2,浓硫酸是强氧化剂,与还原剂反应时,起氧化作用的是S,被还原后一般生成SO2。
3、归中规律:同种元素不同价态的物质之间发生氧化-还原反应时,生成物中该元素的价态介于反应物中高价与低价之间,且不能交叉。
人教版高一化学第一章第三节氧化还原反应一、内容概括本节主要介绍了氧化还原反应的基本概念,包括氧化数(氧化态)、氧化剂与还原剂的定义、氧化还原反应的特征以及如何通过电子转移来识别和配平氧化还原反应。
通过学习这些基础知识,学生能够理解物质在化学反应中的电子得失过程,并掌握氧化还原反应方程式的书写方法。
二、重点归纳1.氧化数:表示一个原子在一个化合物中所带的电荷数,用于描述元素的氧化状态。
2.氧化剂与还原剂:1.氧化剂:获得电子的物质,其氧化数降低。
2.还原剂:失去电子的物质,其氧化数升高。
3.氧化还原反应的特征:1.反应过程中存在电子的转移。
2.氧化数发生变化。
4.氧化还原反应的配平:1.使用氧化数法或离子-电子法配平氧化还原反应方程式。
5.常见的氧化还原反应类型:1.金属与非金属的直接反应。
2.酸碱反应中的氧化还原过程。
3.溶液中的离子反应。
三、练习题讲解及举一反三题目练习题1:下列哪个选项正确描述了氧化剂?• A. 失去电子的物质• B. 获得电子的物质• C. 保持电子不变的物质• D. 提供质子的物质答案:B解析:氧化剂是获得电子的物质,在反应过程中其氧化数降低。
举一反三题目:下列哪个选项正确描述了还原剂?• A. 失去电子的物质• B. 获得电子的物质• C. 保持电子不变的物质• D. 接受质子的物质答案:A解析:还原剂是失去电子的物质,在反应过程中其氧化数升高。
练习题2:写出并配平以下反应的化学方程式:锌与稀硫酸反应生成硫酸锌和氢气。
•答案:Zn + H₂SO₄→ ZnSO₄ + H₂•解析:锌(Zn)与稀硫酸(H₂SO₄)反应生成硫酸锌(ZnSO₄)和氢气(H₂)。
这是一个典型的置换反应,也是氧化还原反应,其中锌作为还原剂,硫酸作为氧化剂。
举一反三题目:写出并配平以下反应的化学方程式:铁与稀盐酸反应生成氯化亚铁和氢气。
•答案:Fe + 2 HCl → FeCl₂ + H₂•解析:铁(Fe)与稀盐酸(HCl)反应生成氯化亚铁(FeCl₂)和氢气(H₂)。
人教版高一化学必修一知识点:氧化还原反应
充分利用时间,最大限度地压缩非学习时间,各种学习以外的事情速战速决。
下面是XX小编为您推荐人教版高一化学必修一知识点:氧化还原反应。
一、概念判断:
1、氧化还原反应的实质:有电子的转移得失
2、氧化还原反应的特征:有化合价的升降判断是否氧化还原反应
3、氧化剂具有氧化性得电子的能力,在氧化还原反应中得电子,发生还原反应,被还原,生成还原产物。
4、还原剂具有还原性失电子的能力,在氧化还原反应中失电子,发生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化由阳离子变单质,
也可能被还原由阴离子变单质。
8、元素价态有氧化性,但不一定有强氧化性;元素态有还原性,但不一定有强还原性;阳离子不一定只有氧化性不一定是价态,,如:Fe2+,阴离子不一
定只有还原性不一定是态,如:SO32-。
9、常见的氧化剂和还原剂:
10、氧化还原反应与四大反应类型的关系:
【同步练习题】
1.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的脱氯剂。
S2O32-和Cl2反应的产物之一为SO42-。
下列说法不正确的是
A.该反应中还原剂是S2O32-
B.H2O参与该反应,且作氧化剂
C.根据该反应可判断氧化性:Cl2 SO42-
D.上述反应中,每生成lmolSO42-,可脱去2molCl2
答案:B
点拨:该反应方程式为:S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+,该反应中氧化剂是Cl2,还原剂是S2O32-,H2O参与反应,但既不是氧化剂也不是还原剂,故选B。
2.2022 河南开封高三一模分析如下残缺的反应:
RO3-+________+6H+===3R2 +3H2O。
下列叙述正确的是
A.R一定是周期表中的第ⅤA族元素
B.R的原子半径在同周期元素原子中最小
C.上式中缺项所填物质在反应中作氧化剂
D.RO3-中的R元素在所有的反应中只能被还原
答案:B
点拨:RO3-中R为+5价,周期表中ⅤA、ⅦA元素均可形成RO3-离子,A错误;据元素守恒,反应中只有R、H、O三种元素,则缺项一定为R-,且配平方程式为RO3-+5R-+6H+===3R2 +3H2O,据此可得R为ⅦA元素,B正确;R-中R 处于态,只能作还原剂,C错误;RO3-中R元素处于中间价态,在反应中既可被氧化又可被还原,D项错。
3.已知KH和H2O反应生成H2和KOH,反应中1molKH
A.失去1mol电子
B.得到1mol电子
C.失去2mol电子
D.没有电子得失
答案:A
点拨:KH中H为-1价,KH+H2O===KOH+H2
置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应;化合反
应和分解反应中有一部分是氧化还原反应。
例、在H+、Fe2+、Fe3+、S2-、S中,只有氧化性的是________________,只有还原性的是________________,既有氧化性又有还原性的是___________。
二、氧化还原反应的表示:用双、单线桥表示氧化还原反应的电子转移情况
1、双线桥:谁变谁还原剂变成氧化产物,氧化剂变成还原产物
例:
2、单线桥:谁给谁还原剂将电子转移给氧化剂
例:
三、氧化还原反应的分析
1、氧化还原反应的类型:
1置换反应一定是氧化还原反应
2CuO+C=2Cu+CO2SiO2+2C=Si+2CO
2Mg+CO2=2MgO+C2Al+Fe2O3=2Fe+Al2O3
2Na+2H2O=2NaOH+H2 2Al+6H+=2Al3++3H2
2Br-+Cl2=Br2+2Cl Fe+Cu2+=Fe2++Cu
2化合反应一部分是氧化还原反应
2CO+O2=2CO23Mg+N2=Mg3N2
2SO2+O2=2SO32FeCl2+Cl2=2FeCl3
3分解反应一部分是氧化还原反应
4HNO3浓=4NO2 +O2 +2H2O2HClO=2HCl+O2
2KClO3=2KCl+3O2
4部分氧化还原反应:
MnO2+4HCl浓=MnCl2+Cl2 +2H2O
Cu+4HNO3浓=CuNO32+2NO2 +2H2O
3Cu+8HNO3=3CuNO32+2NO +4H2O
Cu+2H2SO4浓=CuSO4+SO2 +2H2O
5自身氧化还原反应:歧化反应
Cl2+H2O=HCl+HClO3S+6OH-=2S2-+SO32-+3H2O
2Na2O2+2H2O=4NaOH+O2 ;2Na2O2+2CO2=2Na2CO3+O2
2CaOH2+2Cl2=CaCl2+CaClO2+2H2O
6同种元素不同价态之间的氧化还原反应归中反应
2H2S+SO2=3S+3H2O
5Cl +ClO3-+6H+=3Cl2 +3H2O
7氧化剂、还原剂、氧化产物、还原产物不止一种的氧化还原反应:
2KNO3+S+3C=K2S+N2 +3CO2
2KMnO4=K2MnO4+MnO2+O2
2、氧化还原反应分析:
1找四物:氧化剂、还原剂、氧化产物、还原产物
2分析四物中亮的关系:特别是歧化反应、归中反应、部分氧化还原反应 3电子转移的量与反应物或产物的关系
例:根据反应:8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
1氧化剂是_______,还原剂是______,氧化剂与还原剂的物质的量比是____________;
2当有68gNH3参加反应时,被氧化物质的质量是____________g,生成的还原产物的物质的量是____________mol。