蛋白质与双缩脲试剂反应实验步骤
- 格式:docx
- 大小:36.57 KB
- 文档页数:1

蛋白质含量测定——双缩脲试剂法实验报告一、实验目的1、掌握双缩脲试剂法测定蛋白质含量的原理和方法。
2、学会使用分光光度计进行比色测定。
3、熟悉标准曲线的绘制和应用,能够通过标准曲线计算样品中蛋白质的含量。
二、实验原理双缩脲试剂是由硫酸铜和酒石酸钾钠在碱性条件下生成的淡蓝色的络合物。
当含有两个或两个以上肽键的化合物与双缩脲试剂反应时,会形成紫色的络合物。
蛋白质分子中含有多个肽键,因此在碱性条件下能与双缩脲试剂反应产生紫色复合物。
颜色的深浅与蛋白质的浓度成正比,在一定范围内符合朗伯比尔定律,可通过比色法测定其吸光度,进而计算出蛋白质的含量。
三、实验材料与仪器1、材料(1)标准蛋白质溶液:称取结晶牛血清白蛋白(BSA) 10mg,用蒸馏水溶解并定容至 100ml,配制成100μg/ml 的标准蛋白质溶液。
(2)待测蛋白质溶液:_____(3)双缩脲试剂:称取硫酸铜(CuSO4·5H2O) 15g 和酒石酸钾钠60g,分别用蒸馏水溶解,然后混合,加入 300ml 10%氢氧化钠溶液,并用蒸馏水定容至 1000ml,摇匀,避光保存。
2、仪器(1)分光光度计(2)离心机(3)移液器(4)容量瓶(100ml、50ml)(5)试管及试管架四、实验步骤1、标准曲线的绘制(1)取 6 支干净的试管,按下表加入试剂:|管号| 1 | 2 | 3 | 4 | 5 | 6 ||||||||||标准蛋白质溶液(ml)| 0 | 02 | 04 | 06 | 08 | 10 ||蒸馏水(ml)| 10 | 08 | 06 | 04 | 02 | 0 ||蛋白质含量(μg)| 0 | 20 | 40 | 60 | 80 | 100 |(2)向各管中加入 4ml 双缩脲试剂,摇匀,在室温(20-25℃)下放置 30 分钟。
(3)以第 1 管为空白对照,在 540nm 波长处用分光光度计测定各管的吸光度(A)值。
(4)以蛋白质含量(μg)为横坐标,吸光度(A)值为纵坐标,绘制标准曲线。

蛋白质与双缩脲试剂反应实验步骤
蛋白质与双缩脲试剂反应实验步骤通常包括以下几个步骤:
1. 准备样品:将待测蛋白质溶解于适当的缓冲液中,并且注意避免蛋白质的氧化和降解。
2. 添加双缩脲试剂:将适量的双缩脲试剂(一般是二甲基亚砜或二硫巴比妥酸)加入蛋白质溶液中。
试剂的性质应根据实验的目的进行选择。
3. 静置反应:将混合物静置在适当的温度下进行反应。
通常反应时间较长(一般是数个小时),以确保充分反应。
4. 沉淀蛋白质:将反应后的混合物进行离心或者过滤,以去除未反应的试剂和其他杂质。
5. 洗涤沉淀:用适量的混合溶液洗涤沉淀物,以去除残余的试剂和其他杂质。
洗涤次数需要根据实验要求来确定。
6. 分析测定:可以根据需要,对沉淀物进行吸光度、荧光强度或其他分析测定,以得到蛋白质含量和其他相关数据。
需要注意的是,不同试剂和反应条件可能会有所不同,具体操作步骤需要根据具体实验和试剂的要求来确定。

蛋白质与双缩脲试剂反应方程式蛋白质与双缩脲试剂反应是一种常用的生化方法,用于检测蛋白质的含量或进行蛋白质的定量分析。
这个反应的方程式可以用以下方式来描述:蛋白质 + 双缩脲试剂→ 紫色产物这个方程式表达了蛋白质和双缩脲试剂之间的反应关系,通过这个反应可以得到紫色的产物。
下面将对这个方程式进行详细的解释,并从不同的角度进行扩展描述。
蛋白质是一类复杂的有机化合物,由氨基酸组成。
蛋白质在生物体内具有重要的功能,可以参与细胞的组成、代谢以及信号传导等生命过程。
双缩脲试剂是一种常用的分析试剂,用于检测蛋白质的含量。
双缩脲试剂可以与蛋白质中的酰胺键反应,形成紫色的产物。
这个反应称为双缩脲试剂法(又称为布拉德福德法),是一种常用的蛋白质定量方法。
在这个反应中,双缩脲试剂的结构中含有两个缩脲基团(NHCONH),它们可以与蛋白质中的酰胺键发生反应。
在反应过程中,双缩脲试剂的缩脲基团与蛋白质中的酰胺键结合,形成新的化学键。
这个反应是一个加成反应,即双缩脲试剂的缩脲基团与蛋白质中的酰胺基团结合,同时蛋白质中的氨基酸残基保持不变。
在反应完成后,产生的紫色产物可以通过吸光度测定来确定蛋白质的含量。
双缩脲试剂与蛋白质反应后的产物具有特定的吸光度光谱,可以通过测量光强来确定蛋白质的浓度。
这种测定方法基于比尔-朗伯定律,即溶液中吸光度与溶液中物质的浓度成正比。
蛋白质与双缩脲试剂反应的方程式描述了这个反应的基本过程,但实际操作中还需要考虑一些实验条件和细节。
例如,反应的温度、反应时间、试剂的浓度等因素都会影响反应的效果。
此外,还需要注意选择适当的吸光度测量波长和比色皿的选择等。
总结起来,蛋白质与双缩脲试剂反应是一种常用的生化方法,用于检测蛋白质的含量或进行蛋白质的定量分析。
这个反应的方程式描述了蛋白质和双缩脲试剂之间的反应关系,通过测量产生的紫色产物的吸光度来确定蛋白质的含量。
这个反应在生物化学研究和生物工程领域具有广泛的应用价值。


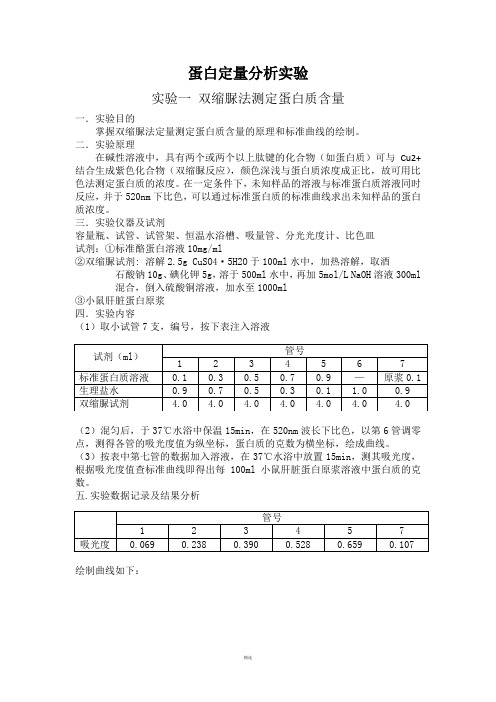
蛋白定量分析实验实验一双缩脲法测定蛋白质含量一.实验目的掌握双缩脲法定量测定蛋白质含量的原理和标准曲线的绘制。
二.实验原理在碱性溶液中,具有两个或两个以上肽键的化合物(如蛋白质)可与Cu2+结合生成紫色化合物(双缩脲反应),颜色深浅与蛋白质浓度成正比,故可用比色法测定蛋白质的浓度。
在一定条件下,未知样品的溶液与标准蛋白质溶液同时反应,并于520nm下比色,可以通过标准蛋白质的标准曲线求出未知样品的蛋白质浓度。
三.实验仪器及试剂容量瓶、试管、试管架、恒温水浴槽、吸量管、分光光度计、比色皿试剂:①标准酪蛋白溶液10mg/ml②双缩脲试剂: 溶解2.5g CuSO4·5H2O于100ml水中,加热溶解,取酒石酸钠10g、碘化钾5g,溶于500ml水中,再加5mol/L NaOH溶液300ml混合,倒入硫酸铜溶液,加水至1000ml③小鼠肝脏蛋白原浆四.实验内容(1)取小试管7支,编号,按下表注入溶液(2)混匀后,于37℃水浴中保温15min,在520nm波长下比色,以第6管调零点,测得各管的吸光度值为纵坐标,蛋白质的克数为横坐标,绘成曲线。
(3)按表中第七管的数据加入溶液,在37℃水浴中放置15min,测其吸光度,根据吸光度值查标准曲线即得出每100ml小鼠肝脏蛋白原浆溶液中蛋白质的克数。
五.实验数据记录及结果分析绘制曲线如下:由图可知,当吸光度为0.107时,相对应的蛋白质克数为1.38 mg,则100ml 小鼠肝脏蛋白原浆液中蛋白质克数为1.38 g。
实验二考马斯亮蓝法测定蛋白质含量一.实验目的掌握考马斯亮蓝法定量测定蛋白质含量的原理和方法;熟悉紫外分光光度计的使用。
二.实验原理考马斯亮蓝在游离状态下呈红色,当它与蛋白质结合后变为蓝色,在一定蛋白质浓度范围内,结合物在595 nm波长下有最大吸收峰,测其光的吸收量即可得结合蛋白质的量。
三.实验仪器及试剂仪器:分光光度计,试管,吸量管,比色皿试剂:①考马斯亮蓝试剂: 考马斯亮蓝G-250 100mg溶于50 ml 95%乙醇中,加入100ml 85%磷酸,用蒸馏水稀释至1000 ml。
实验46.双缩脲法定量测定蛋白质一、实验目的1、学会使用移液管,掌握双缩脲法测定尿蛋白的原理和操作方法。
2、掌握分光光度计的使用,初步了解比色法的基本原理。
二、实验原理蛋白质是含氮的有机高分子化合物,分子中含有多个与双缩脲分子相似的结构(肽键),碱性硫酸铜溶液中,蛋白质与硫酸铜的Cu2+离子等络合生成紫红色络合物,其颜色深浅与蛋白质含量成正比,可用比色法测定。
经比色法求出尿中蛋白质的含量。
反应如下:三、实验试剂与材料仪器试剂1.标准酪蛋白溶液(10mg/ml)酪蛋白预先用微量凯氏定氮法测定蛋白质含量,根据纯度称量配成标准液10.0mg/ml,用0.05N氢氧化钠溶液配制。
2. 双缩肽试剂取硫酸铜(CuSO4·5H2O.AR)1.5G和酒石酸钾钠(KNaC4H2O·4H2O.AR)6.0g分别用蒸馏水250ml溶解后,一并转入1000ml容量瓶中混合,再加入10%的NAaOH溶液300ml,随加随摇匀。
最后用蒸馏水稀释到刻度,贮存于塑料瓶中,可长期保存,如有红色或黑色沉淀出现,需重新配制。
3.未知浓度酪蛋白溶液:称取上述实验中酪蛋白0.5g,放入100ml烧杯中,加25ml0.2NNaOH 溶液,摇匀隔水加热,将溶液转移到50ml容量瓶中。
用少量蒸馏水洗烧杯数次,洗液并入容量瓶中,最后加水至刻度,摇匀,置冰箱中保存。
仪器1.721分光光度计(使用光径为10mm的比色皿)2.刻度吸管1ml1支、2 ml2支、5ml1支3.试管(15mm×150mm)7支4.托盘天平5.分析天平6.量筒:500 ml、100 ml各1支7.容量瓶:50 ml、1000ml各1支8.恒温水浴(20-250C,如室温接近可不用)。
四、实验方法1. 标准曲线制定:取6支试管编号,按下表加入试剂上述试剂加完后,混匀,室温放置30分钟以内测完,比色(540nm )。
记下各管光吸收度,做A 540-蛋白质浓度曲线。
双缩脲法测定蛋白质含量实验报告双缩脲法测定蛋白质含量实验报告引言:蛋白质是生命体内不可或缺的重要营养物质,对于维持生命活动和促进生长发育具有重要作用。
因此,准确测定蛋白质含量对于研究生物学、医学等领域具有重要意义。
本实验选用双缩脲法测定蛋白质含量,通过对其原理、步骤和结果的详细描述,探讨该方法的可行性和准确性。
实验原理:双缩脲法是一种常用的测定蛋白质含量的方法。
该方法基于蛋白质与双缩脲在碱性条件下发生酸解反应,生成氨基酸和缩脲。
然后,通过与酚类试剂发生酚酞反应,产生红色化合物,利用比色法测定其吸光度,从而间接测定蛋白质含量。
实验步骤:1. 准备样品:将待测样品溶解在适量的缩脲溶液中,并加入一定量的氢氧化钠溶液,使其呈碱性。
2. 酸解反应:将样品置于水浴中,加热至沸腾,保持一段时间,使蛋白质充分酸解。
3. 加入酚类试剂:待样品冷却后,加入酚类试剂,与缩脲反应生成红色化合物。
4. 比色测定:将反应液转移到比色皿中,利用分光光度计测定其吸光度。
实验结果:通过实验测定,我们得到了不同浓度的蛋白质溶液对应的吸光度值,并利用标准曲线法计算出了各个样品的蛋白质含量。
结果显示,吸光度与蛋白质浓度呈正相关关系,且线性关系良好。
通过对样品的测定,我们准确地测定了其蛋白质含量。
讨论:双缩脲法测定蛋白质含量具有操作简单、结果准确、灵敏度高等优点,被广泛应用于生物学、医学等领域。
然而,该方法也存在一些局限性。
首先,该方法对于某些特殊的蛋白质样品可能不适用,例如含有酶活性的蛋白质。
其次,该方法对于其他物质的干扰较为敏感,如胆红素、尿素等,可能会导致结果的误差。
因此,在实际应用中,我们需要根据具体情况选择合适的方法来测定蛋白质含量。
结论:通过本次实验,我们成功地利用双缩脲法测定了不同样品中蛋白质的含量,并得到了准确的结果。
该方法操作简单、结果准确,适用于大多数蛋白质样品的测定。
然而,在实际应用中,我们需要注意该方法的局限性,并结合具体情况选择合适的方法进行蛋白质含量的测定。
双缩脲检验蛋白质步骤蛋白质是生命体内重要的基础组成部分,研究蛋白质的结构和功能对于理解生命活动具有重要意义。
双缩脲法是一种常用的蛋白质检测方法,它能够通过比色法测定蛋白质的含量。
下面将介绍双缩脲法检验蛋白质的步骤。
1. 准备样品需要准备待检测的蛋白质样品。
样品可以是细胞提取液、血清或其他含有蛋白质的溶液。
为了保证实验的准确性,样品应该是新鲜的,并且需要根据实验需要进行适当的稀释。
2. 制备双缩脲试剂双缩脲试剂是双缩脲法中的关键试剂,用于将蛋白质与缩脲反应生成可测定的复合物。
制备双缩脲试剂的方法是将缩脲溶解于碱性溶液中,并添加少量表面活性剂,然后进行混合和搅拌,直至完全溶解。
3. 加入样品和双缩脲试剂将准备好的样品滴加到含有双缩脲试剂的试管中,并进行充分混合。
在混合过程中,蛋白质与双缩脲试剂发生反应,生成稳定的复合物。
4. 孵育反应混合物将反应混合物孵育在适当的温度下,使蛋白质与双缩脲试剂充分反应。
通常,孵育时间为15-30分钟,可以根据实验需要进行调整。
5. 比色测定在反应混合物孵育结束后,使用紫外可见光谱仪或分光光度计对反应溶液进行比色测定。
双缩脲试剂与蛋白质反应后会产生一种特定的吸收峰,根据吸光度的变化可以确定蛋白质的含量。
6. 构建标准曲线为了准确测定蛋白质的含量,需要根据已知浓度的标准品制备一系列浓度不同的标准溶液,并对这些标准溶液进行双缩脲法测定。
然后,根据标准溶液的吸光度值和浓度值绘制标准曲线,利用标准曲线可以计算出待测样品中蛋白质的含量。
7. 计算蛋白质含量根据待测样品的吸光度值和标准曲线,可以计算出待测样品中蛋白质的含量。
通常,使用线性回归方程或差值法进行计算。
通过以上步骤,我们可以使用双缩脲法对蛋白质进行准确测定。
双缩脲法具有操作简单、结果稳定可靠的优点,被广泛应用于生物化学、分子生物学和生物医学研究中。
它不仅可以用于测定蛋白质的总量,还可以用于检测特定蛋白质的含量,对于研究蛋白质的生理功能和病理变化具有重要意义。
双缩脲检测蛋白质的实验步骤嘿,咱今儿个就来讲讲双缩脲检测蛋白质的实验步骤哈!这可是个
挺有意思的事儿呢。
首先呢,你得把要检测的东西准备好呀,就像战士上战场得先把武
器拿稳咯。
然后呢,就是调配双缩脲试剂啦,这就好比是给战士配备
精良的弹药。
把硫酸铜和氢氧化钠按比例混合好,可别弄错了比例哦,不然可就
像做菜盐放多了一样,味道就不对啦!这一步可得仔细着点儿。
接着呀,把准备好的样品加进去,就等着看有没有神奇的变化啦。
要是有蛋白质在里面,那颜色就会发生变化哟,就好像是变魔术一样。
你说这蛋白质咋就这么神奇呢,遇到双缩脲试剂就能现形?就跟那
孙悟空火眼金睛能看出妖怪似的。
然后你就瞪大眼睛瞧着,看看颜色变成啥样啦。
要是颜色变得很明显,那说明蛋白质含量可能还不少呢!要是颜色淡淡的,那可能蛋白
质就少一些咯。
这实验就像是一场探索之旅,你带着好奇的心,一步一步去发现那
些隐藏的秘密。
想象一下,你就像个小侦探,通过这个实验去寻找蛋白质这个“小
调皮”藏在哪里。
做这个实验的时候,可别毛手毛脚的呀,要小心翼翼的,不然一不小心弄洒了试剂或者搞坏了样品,那不就白忙活啦!
每一步都要稳稳当当的,就跟走钢丝似的,得保持平衡。
等做完实验,得出结果啦,你就会有一种满满的成就感,就好像是解开了一道很难的谜题一样。
总之呢,双缩脲检测蛋白质的实验步骤就是这么回事儿,只要你认真去做,肯定能发现其中的乐趣和奥秘哟!。
蛋白质与双缩脲试剂反应实验步骤
蛋白质与双缩脲试剂(例如二硫苏糖醇(BME)、二巯基乙酸(DTT)等)可以发生还原反应,将蛋白质中的二硫键还原为巯基。
以下是一种常见的蛋白质与双缩脲试剂反应的实验步骤:
1. 准备样品:将需要还原二硫键的蛋白质样品制备好(通常为溶液形式)。
2. 准备反应体系:将蛋白质样品加入一个含有双缩脲试剂的反应体系中。
通常需要将双缩脲试剂事先溶解在缓冲液中,再加入蛋白质样品。
3. 反应条件:根据实验需要,可以控制反应的温度和时间。
一般情况下,反应温度为室温或较低温度,反应时间通常为15
分钟至数小时。
4. 停止反应:可以通过加入一些化学物质(如磷酸化合物)来停止反应。
这样可以避免进一步的还原反应。
5. 储存样品:根据需要,可以将反应后的样品进行储存或继续后续的实验处理。
需要注意的是,上述步骤只是一种常见的实验操作流程,并不能适用于所有情况。
具体的实验步骤还需要根据实验目的、样品特性和使用的双缩脲试剂等因素进行调整。
在进行实验之前,最好参考相关文献或咨询专业人士的建议。