二 氧化还原反应电子转移的表示方法
►双线桥法•表示意义:表示反应前后同一元素原子间电子转移情况。•基本步骤
如 •注意事项1.箭头、箭尾必须对应化合价变化的同种元素的原子。2.必须注明“得”或“失”。3.氧化剂和还原剂得、失电子总数要相等。
►单线桥法•表示意义:表示反应前后不同元素原子间电子转移情况。•基本步骤
关系图解
第一章 物质及其变化
第2课时 氧化剂和还原剂
人教版化学必修第1册
第三节 氧化还原反应
1.学会判断氧化剂、还原剂、氧化产物、还原产物。2.了解氧化还原反应的应用
学习目标
一、氧化剂和还原剂
1、氧化剂和还原剂
+2 0 0 +1
结论
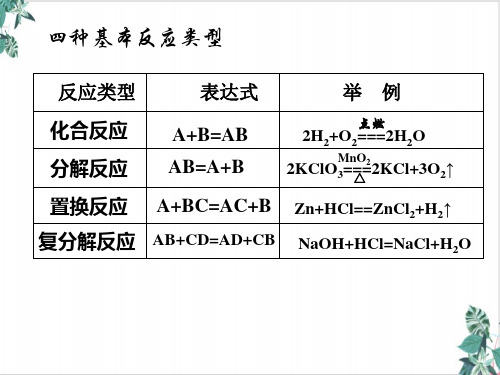
化合反应 A+B═AB
有单质参加的化合反应全部是氧化还原反应
分解反应 AB═A+B
有单质生成的分解反应全部是氧化还原反应
置换反应 A+BC═ AC+B
—
置换反应全部是氧化还原反应
复分解反应 AB+CD═ AD+CB
—
复分解反应都不是氧化还原反应
【说明】 四种基本类型反应不包含所有的化学反应,如+2NaOH═不属于四种基本类型反应中的任何一种,但它有元素化合价的升降,属于氧化还原反应。
CuO → Cu H2 →H2O
氧化反应和还原反应相互依存而统一于同一个氧化还原反应中。
氧化还原反应中元素的化合价为什么会发生变化?其本质原因是什么
?
氧化还原反应的实质:
电子的转移
电子的转移
元素化合价变化
一 氧化还原反应中概念间的关系
概念间的关系图 记忆口诀:氧→得→降→还→还还→失→升→氧→氧即:氧化剂→得到电子→所含元素化合价降低→被还原→发生还原反应。还原剂→失去电子→所含元素化合价升高→被氧化→发生氧化反应。