尼群地平片 2015年版 检验标准
- 格式:docx
- 大小:14.24 KB
- 文档页数:2

尼群地平片说明书用法尼群地平片说明书用法篇一:尼群地平片说明尼群地平片尼群地平片,髙血压。
药品名称尼群地平片汉语拼音 Ni Qun D i Ping Pia n 药品类型工伤医保甲类双跨用途分类钙拮抗药目录3 4 5用法用量6 7 8 9 10儿童用药 11 1213 14 15 16包装 1成份本品主要成份为尼群地平。
化学名称: 2,6二甲基-4-用法:静滴,40滴分钟,2次日×3天 5%葡萄糖注射液 250ml+喜炎平125mg 用法:静滴,40滴分钟,1次日×3天点评:①根据《抗菌药物合理使用原则》,上呼吸道感染多数是病毒性感染或者是病毒与革兰氏阳性菌的混合感染。
如确诊是细菌感染方有使用抗菌药物指征。
首选药物应该是青霉素,阿莫西林或第一代头孢菌素,不能使用第三代菌素。
②头孢噻肟钠是第三代头孢菌素,为广谱抗菌药,对革兰氏阴性菌作用强。
增加了患者耐药性的产生。
例4,患者,男,43岁,临床诊断;前列腺炎。
处方:罗红霉素软胶囊×1盒 2粒日口服巨泰×2盒 2片,口服,Bid 前列康片×2瓶 2片,口服,tid 点评:①没有用药品通用名称开写处方,“巨泰”是阿莫西林克拉维酸钾的商品名。
②联合用药不合理,罗红霉素是快速抑菌剂,阿莫西林是繁殖期快速杀菌剂,两种药联合使用产生拮抗作用,疗效减弱。
③此处方药品规格不写。
④处方中“用法”两字未书写。
⑤阿莫西林克拉维酸钾是时间依赖性药,2次日,效果不理想,达不到有效血药浓度。
例5,患者,男,26岁,临床诊断:包皮术。
处方中开具左氧氟沙星注射液,《抗菌药物合理使用原则》规定:喹诺酮类为广谱抗菌药物,不能作为预防用药使用。
首选药物应该是青霉素类或第一代头孢菌素作为预防用药。

尼群地平片体内外相关性研究尼群地平片(Nitrendipine tablets)市售厂家众多,内在质量参差不齐,虽然同一厂家不同制剂的体外溶出度均符合中国药典标准,但药动学行为存在差异,这也是导致药物临床疗效千差万别的主要原因之一。
尼群地平又是治疗危及生命疾病的重要药物,所以,提高其制剂质量的研究工作势在必行。
本文通过不同溶出度测定条件对10个厂家的尼群地平片进行了质量再评价,通过Beagle犬体内药动学试验,对其中质量较好厂家的制剂和在不同溶出条件下溶出行为存在差异的厂家的制剂进行了体内外相关性研究,旨在筛选出合理的体外溶出条件,提高不同厂家同一品种的内在质量,使其对不同患者均具有相当的临床疗效。
建立了紫外分光光度法用于尼群地平片的含量测定。
测定了10个厂家尼群地平片的含量,均符合中国药典2005年版要求,不同厂家制剂间含量差异较大。
采用中国药典2005年版尼群地平片项下含量均匀度测定方法测定了10个厂家尼群地平片的含量均匀度,同一厂家制剂每片问含量存在较大差异。
采用不同条件对10个厂家尼群地平片进行溶出度考察,并测定了尼群地平在不同介质中的平衡溶解度。
溶出度测定结果表明,10个厂家制剂的体外溶出度均符合中国药典2005年版要求,各厂家制剂溶出行为差异较大。
10个厂家制剂的体外溶出度均不符合《日本医疗用医药品品质情报集》(Pharmacy Japan-Orange book)方法要求,两种标准规定方法对制剂区分能力不同。
改变溶出介质中表面活性剂十二烷基硫酸钠(SDS)的浓度、pH值、转速等条件,测定了不同厂家尼群地平片的溶出度,溶出度数据用美国食品药品监督管理局(FDA)推荐的相似因子法进行统计分析。
结果表明,SDS浓度为0.5%时,满足漏槽“条件”,可以区分制剂优劣,与中国药典2005年版方法区分能力不同。
表面活性剂浓度越高,区分制剂能力降低,尼群地平的溶出不受pH值影响,转速降低,累积溶出百分率下降。

尼群地平片含量分析方法研究摘要:目的:通过试验验证尼群地平片的含量分析方法。
方法:通过对比国内外相关质量标准对含量检测方法法进行了筛选,通过筛选结果初步确定了各项的检测方法,并初步确定了质量标准。
结果:通过专属性、系统适用性、线性和范围、回收率试验、精密度试验、色谱系统的耐用性、溶液稳定性等含量方法学验证,验证了尼群地平含量分析方法的可靠性。
结论:研究结果表明检测样品各项均符合规定,证明检测方法合理,产品质量合格。
关键词:尼群地平片含量分析1.含量分析方法1.1专属性由于含量和有关物质测定方法相同,因此参照有关物质专属性考察的结论:混合辅料及溶剂均不干扰本品主药的测定,说明该方法专属性强。
1.1.1系统适用性取尼群地平对照品适量,用流动相稀释制成每1ml中约含左旋氨氯地平25μg的溶液,连续进样6针,考察主峰的保留时间和峰面积的RSD%、理论塔板数、拖尾因子等,试验结果见表1-1。
表1-1 系统适用性考察结果序号123456平均RSD%保13.13.13.13.13.13.13.0留时间074262315149099196183.71峰面积1473163147047914704241470028147154214864111473675.43理论塔板数957396069631963397539594————拖尾因子1.1121.1171.1241.1251.1261.121————结论:保留时间RSD值小于1.0%,峰面积的RSD值小于2.0%;理论板数均大于2000,拖尾因子符合要求。
1.1.2线性和范围精密称取尼群地平对照品9.51mg(含量:95.7%),置50ml量瓶中,用流动相溶解并稀释至刻度,摇匀,制成每1ml含左旋氨氯地平190.2μg/ml的溶液,作为尼群地平对照品贮备液;分别精密量取贮备液0.8ml、0.9ml、1.0ml、1.1ml、1.2ml,置5ml容量瓶中,加流动相稀释至刻度,照含量测定色谱条件,分别进样20µl,记录色谱图,量取主峰面积,以进样量与主峰面积进行线性回归[1],结果见表1-2,图1-1。

通则1105 非无菌产品微生物限度检查:微生物计数法微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按下述规定进行检验,包括样品的取样量和结果的判断等。
除另有规定外,本法不适用于活菌制剂的检查。
微生物计数试验环境应符合微生物限度检查的要求。
检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区域、工作台面及环境应定期进行监测。
如供试品有抗菌活性,应尽可能去除或中和。
供试品检查时, 若使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。
供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
计数方法计数方法包括平皿法、薄膜过滤法和最可能数法(Most-Probable-Number Method,简称MPN 法)。
MPN 法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN 法可能是更适合的方法。
供试品检查时,应根据供试品理化特性和微生物限度标准等因素选择计数方法,检测的样品量应能保证所获得的试验结果能够判断供试品是否符合规定。
所选方法的适用性须经确认。
计数培养基适用性检查和供试品计数方法适用性试验供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。
若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
表 1 试验菌液的制备和使用计数培养基适用性检查计数方法适用性试验试验菌株试验菌液的制备需氧菌总数计数霉菌和酵母菌总数计数需氧菌总数计数霉菌和酵母菌总数计数金黄色葡萄球菌(Staphylococ cus aureus)〔CMC C(B)26 003)〕胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基,培养温度30 ~35℃,培养时间18~24小时胰酪大豆胨琼脂培养基和胰酪大豆胨液体培养基,培养温度30~35℃,培养时间不超过3 天,接种量不大于100cfu胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基( MPN法),培养温度30~35℃,培养时间不超过3 天,接种量不大于100cfu铜绿假单胞菌(Pseudomona s aeruginosa)〔CMCC(B)10 104〕胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基,培养温度30 ~35℃,培养时间18~24小时胰酪大豆胨琼脂培养基和胰酪大豆胨液体培养基,培养温度30~35℃,培养时间不超过3 天,接种量不大于100cfu胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基( MPN法),培养温度30~35℃,培养时间不超过3 天,接种量不大于100cfu枯草芽孢杆菌(Bacillus subtilis)〔C MCC(B) 63 501〕胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基,培养温度30 ~35℃,培养时间18~24小时胰酪大豆胨琼脂培养基和胰酪大豆胨液体培养基,培养温度30~35℃,培养时间不超过3 天,接种量不大于100cfu胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基( MPN法),培养温度30~35℃,培养时间不超过3 天,接种量不大于100cfu白色念珠菌(Candida albicans)〔C MCC(F) 98 001〕沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养基,培养温度20 ~25℃,培养时间2~3天胰酪大豆胨琼脂培养基,培养温度30 ~35℃,培养时间不超过5 天,接种量不沙氏葡萄糖琼脂培养基,培养温度20~25℃,培养时间不超过5胰酪大豆胨琼脂培养基( MPN 法不适用),培养温度30~35℃,培养时间不超过5 天,接沙氏葡萄糖琼脂培养基,培养温度20~25℃,培养时间不超过5大于100cfu天,接种量不大于100cfu 种量不大于100cfu天,接种量不大于100cfu黑曲霉(Aspergillus niger)〔CMCC (F) 98 003〕沙氏葡萄糖琼脂培养基或马铃薯葡萄糖琼脂培养基,培养温度20~25℃,培养时间5~7天,或直到获得丰富的孢子胰酪大豆胨琼脂培养基,培养温度30 ~35℃,培养时间不超过5天,接种量不大于100cfu沙氏葡萄糖琼脂培养基,培养温度20~25℃,培养时间不超过5天,接种量不大于100cfu胰酪大豆胨琼脂培养基( MPN 法不适用),培养温度30~35℃,培养时间不超过5天,接种量不大于100cfu沙氏葡萄糖琼脂培养基,培养温度20~25℃,培养时间不超过5天,接种量不大于100cfu注:当需用玫瑰红钠琼脂培养基测定霉菌和酵母菌总数时,应进行培养基适用性检查,检查方法同沙氏葡萄糖琼脂培养基。

测定尼群地平片含量HPLC法的改进目的:对尼群地平片进行含量测定的高效液相法;方法:色谱柱为Diamonsil (TM)-C18(250mm×4.6mm,5μm),流动相为甲醇-水(70:30),检测波长为237nm,流速为1.0ml/min,进样量为10μl。
结果:再改条件下,尼群地平进样量在0~2.5μg范围内线性关系良好(r=0.9996),平均回收率为100.16%(n=9)。
结论:本方法简便、准确、快捷,重复性良好,可用于尼群地平片剂的含量测定和质量控制。
标签:尼群地平;高效液相色谱;含量测定尼群地平(商品名落普思)为钙离子通道阻滞剂,属短效抗高血压药。
能选择性地作用于外周血管,阻断其钙离子内流,松弛其平滑肌,扩张血管而降压,能显著扩张冠状动脉,降低心肌耗氧量,保护缺血性心肌,用于各种类型的高血压,特别是伴有冠心病的高血压的治疗。
目前《中国药典》2010年版收载尼群地平片的含量测定虽为高效液相色谱法,但操作较繁琐,流动相复杂,对仪器要求较高,为更简单有效控制尼群地平质量特建立了用HPLC法测定其含量的方法。
1 仪器与试药1.1 仪器Agilent-1100高效液相色谱仪;岛津UV-2450紫外分光光度计;Aiamonsil-C18(250mm×4.6mm,5μm)色谱柱;Mettler ToledoAE-100电子天平(瑞士Mettler公司)。
1.2 试药尼群地平对照品来源批号:100585-200602;中国药品生物检定所。
尼群地平原料药来源由赤峰万泽制药有限公司提供。
尼群地平片来源规格:10mg/片;天津太平洋制药有限公司生产;产品批号:080704.甲醇为色谱纯;水为纯化水,自制。
2 液的制备2.1 对照品溶液精密称取尼群地平对照品25mg,置25ml量瓶中,用甲醇溶解并稀释至刻度,摇匀即得。
2.2 原料药溶液精密称取尼群地平原料药25mg置25ml量瓶中,加甲醇溶解并稀释至刻度,摇匀即得。

不同厂家尼群地平片有关物质的对比研究目的比较不同厂家尼群地平片中有关物质的含量。
方法采用2015年版《中国药典》项目下该药物有关物质的检测方法,通过HPLC的方法测定不同厂家尼群地平片的有关物质。
结果通过对3个不同厂家尼群地平有关物质的测定,采用自身面积对照法说明了不同厂家片剂中有关物质的含量及归属。
结论检测结果对于尼群地平片的杂质分析、质量控制具有重要作用,并为尼群地平片的生产和用药安全提供检测方法和判断依据。
标签:尼群地平;有关物质;HPLC尼群地平(Nitrendipine,NTD)最早由德国拜耳公司研发,于20世纪70年代开始生产。
商品名:Bayotensin[1]。
尼群地平片为二氢吡啶类钙通道阻滞剂,能抑制血管平滑肌和心肌的跨膜钙离子内流,且以血管作用为主,故具有较强的血管选择性。
能引起冠状动脉、肾小动脉等全身血管的扩张,产生降压作用[2]。
由于尼群地平具有起效迅速、药效持续时间长、疗效确切、副作用小等优点,被广泛应用于高血压及冠心病的治疗。
各国药典尼群地平片有关物质限度规定如表1:目前《中国药典》[3]对尼群地平片有关物质的控制限度相比其他药典要宽松,因此为更好的控制该品种质量,本研究检测了3个不同厂家尼群地平片的杂质情况,并与德国拜耳的原研产品进行对比,为国产尼群地平片的检测方法提供部分数据依据[4]。
1 仪器和试药1.1 仪器Aglient 1260液相色谱仪;Sartorius电子天平;Aglient C18色谱柱1.2 试药尼群地平对照品(中检所);杂质A对照品(中检所);杂质B对照品(LGC);杂质C对照品(LGC);原研尼群地平片(德国拜耳);国产尼群地平片(厂家A、B、C);乙腈、四氢呋喃、甲醇均为色谱纯。
2 方法和结果2.1 样品的配制(1)对照品溶液:取尼群地平对照20 mg,加2.5 mL四氢呋喃溶解,以流动相定容至10 mL容量瓶中。
(CNTD=2 mg/ml)(2)对照品溶液(a):将1 mL的供试品溶液用流动相定容至100 mL容量瓶中,取1 mL 上述溶液用流动相定容至10 mL容量瓶中。

尼群地平片含量测定方法学确认方案1————————————————————————————————作者:————————————————————————————————日期:2尼群地平片含量测定、有关物质测定及溶出度测定检验方法确认文件编号:xxxx药业集团有限公司尼群地平片含量测定、有关物质测定及溶出度测定检验方法确认方案起草人_____________ 部门____________ 日期___________审核人_____________ 部门____________ 日期___________审核人_____________ 部门____________ 日期___________批准人_____________ 日期__________ _目录一、确认方案1. 确认的原则和目的2.范围3.组织及职责3.1确认方案和报告的起草、审核、批准3.2确认方案的培训3.3组织实施过程中的变更和偏差3.3实施组织人员4.标准品和样品信息5. 分析仪器6. 实施检验人员信息7. 确认项目及方法7. 1含量测定确认7. 2有关物质测定确认7. 3溶出度测定确认8. 结论报告二、确认报告三、确认证书1. 确认的原则和目的建立尼群地平片测定方法的确认方案,在实验过程中严格按照标准操作,确保试验结果真实可信,以确认尼群地平片按《中国药典》二部测定的方法是否适用于本分析中心。
2.范围本验证方案适用于尼群地平片含量测定、有关物质测定、溶出度测定的检验方法确认。
3.组织及职责3.1确认方案和报告的起草、审核、批准该检验方法确认方案由检验室负责起草,方案经检验室、验证管理办公室、质管部等部门审核,最终由质量副总批准。
确认过程实施完成后,确认过程由方案起草人负责汇总,并经检验室、验证管理办公室、质管部部门主管审核,最终由质量副总批准报告及合格证书。
3.2确认方案的培训确认方案起草人在方案经质量副总批准后及确认方案实施前,对本次确认实施的相关人员组织培训工作,由检验室主管领导人负责该次验证方案的培训工作,并将该次的培训记录交至人力资源部归档。

尼群地群片说明书【药品名称】通用名称:尼群地平片【成份】本品主要成份为尼群地平。
【性状】本品为淡黄色片。
【适应症】用于高血压。
【规格】10mg【用法用量】口服。
成人常用量:开始一次 10mg(1 片),每日 1 次,以后可根据情况调整为 20mg(2 片),每日 2 次。
【不良反应】较少见的有头痛、面部潮红。
少见的有头晕、恶心、低血压、足踝部水肿、心绞痛发作,一过性低血压。
本品过敏者可出现过敏性肝炎、皮疹,甚至剥脱性皮炎等。
【禁忌】对本品过敏及严重主动脉瓣狭窄的患者禁用。
【注意事项】1、少数病例可能出现血碱性磷酸酶增高。
2、肝功能不全时血药浓度可增高,肾功能不全时对药代动力学影响小,以上情况慎用本品。
3、绝大多数患者服用此药后仅有可以耐受的轻度低血压反应,但个别患者可出现严重的体循环低血压症状。
这种反应常发生在初期调整药量期间或者增加药物用量的时候,特别是合用β受体阻滞剂时。
故在此期间应监测血压。
4、已经证明极少数的患者,特别是那些有严重冠状动脉狭窄的患者,在服用此药或者增加剂量期间,心绞痛或心肌梗死的发生频率、持续时间和严重程度会增加。
其作用机制目前尚不清楚。
5、孕妇及哺乳期妇女用药:本品在孕妇中应用的研究尚不充分,已有的研究未显示有致畸作用,但孕妇一般不宜应用,哺乳期妇女应用本品时应停止哺乳。
6、儿童用药:未进行该项实验且无可靠参考文献。
7、老年用药:老年人应用血药浓度较高,但半衰期未延长,故宜适当减少剂量。
【药物相互作用】1、β受体阻滞剂:绝大多数患者合用此两种药物可加强降压作用,并可减轻尼群地平引起的心率加快的副作用。
但个别患者有可能诱发和加重体循环低血压、心力衰竭和心绞痛。
2、血管紧张素转换酶抑制剂:合用可加强降压作用,并可减少尼群地平引起的水钠潴留现象。
3、长效硝酸盐类:合用有较好的耐受性,但尚缺乏评价这种合用控制心绞痛的有效性临床研究。
4、西咪替丁:可增加尼群地平的血药浓度。
5、洋地黄:部分研究提示服用地高辛期间加用尼群地平可增加地高辛血药浓度,平均增加 45%。
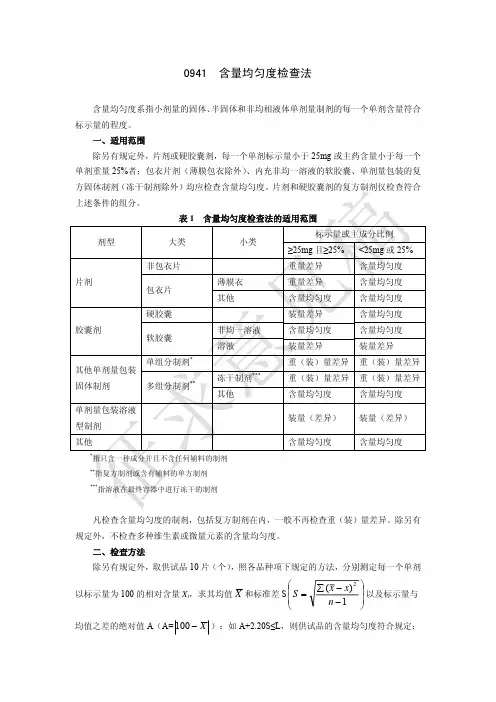
0941含量均匀度检查法含量均匀度系指小剂量的固体、 半固体和非均相液体单剂量制剂的每一个单剂含量符合 标示量的程度。
一、适用范围 除另有规定外,片剂或硬胶囊剂,每一个单剂标示量小于 25mg 或主药含量小于每一个 单剂重量 25%者;包衣片剂(薄膜包衣除外) 、内充非均一溶液的软胶囊、单剂量包装的复 方固体制剂(冻干制剂除外)均应检查含量均匀度。
片剂和硬胶囊剂的复方制剂仅检查符合 上述条件的组分。
表1 剂型 大类 非包衣片 片剂 包衣片 硬胶囊 胶囊剂 软胶囊 单组分制剂* 多组分制剂** 冻干制剂*** 其他 非均一溶液 溶液 薄膜衣 其他 含量均匀度检查法的适用范围 小类 标示量或主成分比例 ≥25mg 且≥25% 重量差异 重量差异 含量均匀度 装量差异 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度指只含一种成分并且不含任何辅料的制剂 指复方制剂或含有辅料的单方制剂 指溶液在最终容器中进行冻干的制剂<25mg 或 25% 含量均匀度 含量均匀度 含量均匀度 含量均匀度 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度其他单剂量包装 固体制剂 单剂量包装溶液 型制剂 其他******凡检查含量均匀度的制剂,包括复方制剂在内,一般不再检查重(装)量差异。
除另有 规定外,不检查多种维生素或微量元素的含量均匀度。
二、检查方法 除另有规定外,取供试品 10 片(个) ,照各品种项下规定的方法,分别测定每一个单剂⎛ 以标示量为 100 的相对含量 Xi,求其均值 X 和标准差 S ⎜ S = ⎜ ⎝∑ ( x − x) n −12⎞ ⎟ 以及标示量与 ⎟ ⎠均值之差的绝对值 A(A= 100 − X ):如 A+2.20S≤L,则供试品的含量均匀度符合规定;若 A+S>L,则不符合规定;若 A+2.20S>L,且 A+S≤L,则应另取 20 片(个)复试。

尼群地平片说明书
一、药品名称
二、成分
每片含尼群地平5毫克
三、性状
本品为白色或类白色片剂
四、适应症
本品适用于治疗高血压、心绞痛等症状。
五、用法用量
口服。
一般情况下,成人每次口服5毫克,每日两次。
六、不良反应
七、禁忌症
已知尼群地平药物过敏个体禁用本品。
八、注意事项
1.使用本品期间,如果出现严重的头晕、心悸等症状,应立即停药并
就医。
2.本品患有肝功能异常等病症的患者慎用。
3.长期使用本品时,应定期进行体格检查,包括血常规、肝肾功能等。
4.本品与其他药物可能存在相互作用,使用过程中请遵医嘱。
5.请存放在阴凉干燥处,避免阳光直射,儿童不宜接触。
九、药物相互作用
1.与β-受体阻断剂、利尿剂合用时,可能出现血压降低或心血管抑
制等副作用。
2.与一些抗菌药物合用时,尼群地平片可能被抑制代谢,导致血药浓
度增加。
3.与一些肝酶诱导剂合用时,尼群地平片可能被加速代谢,导致血药
浓度下降。
十、药物过量
如使用本品剂量过大,可能导致血压降低,严重时可出现昏厥等症状。
如出现药物过量反应,请尽快就医。
十一、规格
每瓶装60片。
十二、批准文号与生产企业
批准文号:XXX
生产企业:XXX
十三、日期
本说明书最近修订日期为XXXX年XX月XX日
特别提示:
1.请仔细阅读说明书,按医嘱使用本品。
2.请妥善保管本品,避免儿童接触。

尼群地平片说明书及副作用
尼群地平片是一种经过研发成功,用于治疗癫痫发作的抗癫痫类
药物。
一般尼群地平片中含有的成分会发挥显著的抗癫痫作用,能够
有效抑制、镇静癫痫状态,减轻病人的发作,获得较好的控制效果。
用法用量:尼群地平片应按照医嘱服用,平时一次1-4片,最多
一天8片,依据个人的情况而定,通常应常用分次用药的方法服用,
常开口服用,服用时不要咀嚼,若服用量大于或等于20片,以100ml
水冲服,但如发作前服用,小于20片,可用少量水咽下,这样可以快
速获得药效,缩短癫痫发作的持续时间。
副作用:尼群地平片服用副作用会比较多,可致口干、头晕、视
物模糊、皮肤出现皮疹、脾痛等,严重者可出现面部潮红、呼吸急促、皮疹等。
而且容易对肝功有轻度影响,因此使用的时候一定要慎重,
应遵医嘱,严格按规定的剂量使用,一旦出现任何不良反应,立即停
药并咨询医生,在允许的条件下,应选择更安全、有效的治疗方案。
尼群地平片是一种抗癫痫药物,有如此明显的控制癫痫发作的作用,给癫痫患者带来了福音,但是服用药物的副作用也是必须要重视的,因此一定要遵照医嘱,严格按照使用说明书使用,在症状有明显
改善时停药,以防副作用的出现和不良后果的发生。
HPLC法测定尼群地平片的含量及有关物质
杨敏智;蒋敏阳;陈国清
【期刊名称】《中国药品标准》
【年(卷),期】2004(5)2
【摘要】目的:建立一种高效液相色谱法测定尼群地平片的含量及有关物质的方法.方法:以C18为固定相,甲醇-水(70 : 30)为流动相,检测波长:237nm.结果:尼群地平片的浓度在20~180μg/ml范围内线性关系良好,回归方程:Y=39128X-66845,r=0.9999精密度试验RSD%=0.9%(n=9),片剂的回收率为
100.5%(RSD%=0.6%,n=5).有关物质可检出2个杂质.结论:本方法测定尼群地平的含量及有关物质,分离效果好,结果准确.
【总页数】3页(P53-55)
【作者】杨敏智;蒋敏阳;陈国清
【作者单位】江苏省无锡药品检验所,无锡,214021;江苏省无锡药品检验所,无锡,214021;江苏省无锡药品检验所,无锡,214021
【正文语种】中文
【中图分类】R9
【相关文献】
1.HPLC法测定尼群地平片的含量 [J], 高佳丽;王毅;张晓东;马瑞莲;
2.HPLC法测定尼群地平片的含量 [J], 米振清;刘芹
3.HPLC法测定尼群地平片的含量 [J], 高佳丽;王毅;张晓东;马瑞莲
4.RP—HPLC法测定普伐他汀钠片含量,含量均匀度及其有关物质 [J], 林斌
5.HPLC法测定盐酸莫索尼定片的含量、含量均匀度及原料的有关物质检查 [J], 李秀珍;姚华
因版权原因,仅展示原文概要,查看原文内容请购买。
尼群地平片含量均匀度检测法的改进
范秋如;李佩蓉
【期刊名称】《北方药学》
【年(卷),期】2011(008)005
【摘要】@@ 尼群地平片收载于中国药典2005年版[1],是一种常用抗高血压药品,选择作用于血管平滑肌的钙拮抗剂.其含量均匀度检测法操作步骤繁琐,重复.根据多年临床经验,笔者对其加以改进,并取得了满意的结果,现报道如下.rn1 仪器和试药rn美国热电公司500型双光束紫外分光光度计,无水乙醇(分析纯);尼郡地平片;批号20100301、20100104、(A厂生产)H01003(B厂生产)、990918(C厂生产)、1001181(D厂生产).
【总页数】1页(P82)
【作者】范秋如;李佩蓉
【作者单位】陕西省榆林市药检所,榆林,719000;陕西省榆林市药检所,榆
林,719000
【正文语种】中文
【中图分类】R927.2
【相关文献】
1.测定尼群地平片含量HPLC法的改进 [J], 聂世英
2.尼群地平片的工艺改进 [J], 陈晓燕;黄坚伟;汪茂先;尤孝庆
3.对比2015版《中国药典》与《美国药典》中含量均匀度检测法 [J], 纪建勋
4.对尼群地平片含量均匀度质量标准的商榷 [J], 禹小平;刘保珍;王远忠
5.盐酸西替利嗪片含量均匀度检测方法的改进与研究 [J], 肖驰
因版权原因,仅展示原文概要,查看原文内容请购买。
世界最新医学信息文摘2019年第19卷第87期 33 西尼地平片微生物限度检查方法适用性试验陈超1,韩佩莲2,游蓉丽3(1.北京中医药大学,北京;2.山西振东泰盛制药有限公司,山西 大同;3.山西振东制药股份有限公司,山西 长治)摘要:目的对西尼地平片微生物限度检查方法适用性试验进行验证。
方法采用计数培养基适用性检查,采用平皿法计数方法适用性试验(回收率)、控制菌试验、供试品检查。
结果西尼地平片微生物限度检查方法适用性试验符合规定要求。
结论通过适用性试验,表明西尼地平片(规格:5 mg)微生物限度检查采用《中国药典》2015年版四部平皿法,方法可行。
关键词:西尼地平片;微生物限度;方法适用性中图分类号:r927.1 文献标识码:a doi: 10.19613/ki.1671-3141.2019.87.016本文引用格式:陈超,韩佩莲,游蓉丽.西尼地平片微生物限度检查方法适用性试验[J].世界最新医学信息文摘,2019,19(87):33-34,40.Applicability Test of Microbial Limit Test for Cilnidipine TabletscHen chao1, Han Pei-lian2, YoU rong-li3(1.Beijing University of Chinese Medicine, Beijing, China;2.Shanxi Zhendong Taisheng Pharmaceutical Co., Ltd, Datong, Shandong, China;3.ShanxiZhendong Pharmaceutical Co., Ltd, Changzhi, Shanxi, China)ABSTRACT:Objective study on the applicability of microbial limit test for cinidipine tablets. Methods the applicability of counting medium, the applicability test (recovery rate), the control bacteria test and the test article inspection were used. Results the applicability test of the microbial limit test method of cilnidipine tablets meets the requirements. Conclusion the applicability test showed that the microbial limit test of Cinidipine tablets (specification: 5mg) was feasible by using the four plates method of “Chinese Pharmacopoeia” 2015 edition.KEY WORDS: cilnidipine tablet; Microbial limit; applicability of the method0 引言西尼地平片[1]是适用于高血压患者的治疗药物。
尼群地平片溶出度测定
张天虹;李磊;章洪方;何仲贵
【期刊名称】《沈阳药科大学学报》
【年(卷),期】2003(20)6
【摘要】目的采用不同方法考察市售尼群地平口服片剂和软胶囊的溶出度 ,并提出尼群地平溶出度检查的标准。
方法用含不同浓度的十二烷基硫酸钠 (SDS)醋酸盐缓冲液 (pH 4 5 )为溶出介质 ,采用紫外分光光度法检查 ,比较不同厂家尼群地平片和尼群地平软胶囊的体外溶出度。
用相似因子法对片剂溶出度数据进行统计分析。
结果用 0 3 %SDS醋酸盐缓冲液 (pH 4 5 ) ,除B片和D片之间的 (B片 D片 )相似因子F2 >5 0外 ,其余的F2 ≤ 5 0 ,可以显示出不同厂家生产的尼群地平片的溶出度差异。
而用 0 1 %SDS醋酸盐缓冲液可以显示出尼群地平软胶囊与片剂的溶出度差异。
结论不同厂家生产的尼群地平片的溶出度存在较大的差异 ,尼群地平片和软胶囊在溶出度方面整体存在较大差异 ,建议《中华人民共和国药典》
【总页数】3页(P416-418)
【关键词】尼群地平;片剂;软胶囊;溶出度
【作者】张天虹;李磊;章洪方;何仲贵
【作者单位】沈阳药科大学药学院;常州制药有限公司
【正文语种】中文
【中图分类】R944.4
【相关文献】
1.制片压力对不同厂家尼群地平片溶出度的影响 [J], 陈志;李传响
2.紫外分光光度法测定尼群地平片含量和溶出度 [J], 沈春鸣
3.尼群地平片在不同介质中的溶出度比较 [J], 王翼;缪娅妮;詹长娟;王华;徐伟
4.影响尼群地平片溶出度的主要因素探讨 [J], 李辉
因版权原因,仅展示原文概要,查看原文内容请购买。
尼群地平片有关物质检查方法的比较与讨论
孙莉
【期刊名称】《中国现代药物应用》
【年(卷),期】2012(006)016
【摘要】尼群地平(Nitrendipine)为第二代二氢吡啶类钙拮抗剂,见光易分解,形成无药理活性的1,4脱氢吡啶衍生物(称之为尼群地平杂质A)。
《英国药典》中规定尼群地平中杂质A的量不得超过0.1%,其他单个杂质的量不得超过0.8%,
【总页数】2页(P134-135)
【作者】孙莉
【作者单位】241000,安徽芜湖市食品药品检验所
【正文语种】中文
【相关文献】
1.中、英两国药典尼美舒利有关物质检查方法比较 [J], 卢家梁;凌日金
2.关于中国药典与英国药典(2005年版)尼群地平原料和片剂中有关物质检查HPLC 方法的比较与讨论 [J], 岳志华;牛秀华;张启明
3.HPLC法测定尼群地平片的含量及有关物质 [J], 杨敏智;蒋敏阳;陈国清
4.苦参素胶囊中有关物质氧化槐果碱检查方法比较 [J], 张霞;张文华;倪海芳
5.劳拉西泮片有关物质检查方法的比较 [J], 袁猛;余振喜;王慧文;王菲菲
因版权原因,仅展示原文概要,查看原文内容请购买。