生物无机化学3第三章 物理化学方法
- 格式:ppt
- 大小:5.30 MB
- 文档页数:38


《无机化学》教案1.教科书:卫生部规划教材,高等医药院校教材(供药学类专业用)许锦善主编《无机化学》第三版,人民为生出版社,北京,2000年5月2.教学安排讲课:54 学时,实验:52 学时考试课:期中考试占15% ; 实验课占15% ; 期末考试占70%3.授课内容(1)普通化学原理部分:重点围绕酸碱平衡、沉淀平衡、氧化还原平衡、配位平衡讲授四大平衡及其变化规律。
(2)结构理论部分:重点讲授原子和分子结构有关理论与应用。
(3)元素化学部分:选修自学。
4.教学参考书(1)北京师范大学无机化学教研室等编写. 无机化学(上,下),高等教育出版社,北京, 1994(2)曹锡章宋天佑王杏乔,武汉大学无机化学教研室等. 《无机化学》(上,下)第三版,高等教育出版社 1994.10,(3)朱裕贞,顾达,黑恩成编写. 现代基础无机化学(上下),化学工业出版社,北京,1998(4)刘新泳,刘丽娟,柳翠英编著. 无机化学,中国科学技术出版社,北京. 2001(5)徐春祥,韩玉洁. 无机化学习题解析,哈尔滨出版社2000(6)章琦主编无机化学(第二版)中国医药科技出版社,北京1992第一章绪论(1学时)基本要求1.了解无机化学在自然科学和化学学科发展中的地位和作用。
2.了解无机化学的发展史和重要分支学科及新的边缘学科。
3.掌握无机化学的研究基本内容。
4.了解化学与药学的关系。
重点与难点本章重点讲授无机化学在自然科学和化学学科发展中的地位和作用,以及化学的发展史和近代无机化学发展的重要分支学科以及新的边缘学科。
重点讲授无机化学的研究基本内容及与药学学科的关系。
本章难点内容:有关无机化学的现代研究方法。
基本概念无机化学;四大平衡;元素化学;稀土元素化学;配位化学;生物无机化学;金属有机化学;金属酶化学授课要点一.无机化学的发展和研究内容1.无机化学的发展基础化学包括四大化学:无机化学,有机化学,分析化学,物理化学。
无机化学是化学学科发展最早的一个分支,可以说化学发展史就是无机化学发展史。

1、教材《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章p区金属(4学时)第二十二章ds区元素(6学时)第二十三章d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质(chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。


“物理化学”课程简介及教学大纲课程代码:课程名称:物理化学课程类别:学科基础课总学时/学分:80 / 3+2 (其中含实验或实践学时:48 )开课学期:每学年第一和第二学期适用对象:化工类专业本科生先修课程:高等数学、普通物理学、无机化学、分析化学和有机化学内容简介:物理化学也称为理论化学,是化学的重要分支之一。
物理化学是用数学和物理学的方法研究化学中最具有普遍性的一般规律。
本课程介绍研究化学变化和相变化的平衡规律和化学反应的速率规律的宏观层次理论方法,从微观到宏观层次的研究方法和多相系统的研究方法等。
包括热力学三大定律和基本方程、统计热力学、多组分系统热力学、相平衡、化学平衡、电化学、化学反应动力学、表面现象和胶体等。
一、课程性质、目的和任务【课程性质】物理化学是学生在具备了必要的高等数学、普通物理、无机化学、分析化学等基础知识之后必修的理论基础课,是应用化学、化学工程、生物化学等专业的一门主干基础理论课程,同时也是后继化学专业课程的基础。
【教学目的】通过本课程的学习使学生建立一个系统、完整的物理化学基本理论和方法的框架,掌握热力学、动力学、电化学、统计热力学中的普遍规律和实验方法;在强化基础的同时,逐步培养学生的思维能力和创造能力。
【教学任务】本课程共分十章:热力学第一定律、热力学第二定律、统计热力学初步、溶液理论、相平衡、化学平衡、电化学、化学动力学、表面现象、胶体化学。
本课程重点在于化学基础理论、基本知识的教学,在阐述基本原理时应着重讲清整个问题的思路、介绍问题的提出背景和形成理论的思维方法,使学生学到有关知识的同时能学到探索问题的思路和方法,培养解决问题的能力;在基础层次上选择有代表性的科学研究成果和实际,着眼于前沿涉及的新思想和新方法。
二、课程教学内容及要求绪论§ 1 物理化学的学科特点和发展史§ 2 物理化学的研究内容和研究方法§ 3 必要的数学知识§ 4 物理化学的学习方法和学习要求【基本要求】1. 了解学生的心理特点和学科特点,探讨物理化学的学习方法,使学生确立学好物理化学的信心。

无机化学教学大纲(生物类)大纲编写者:李俊然目的和要求本教学大纲是针对北京大学生命科学院和医学部本科生学习的无机化学课程编写的。
本课程为生命科学院和医学部学生的基础课,它是本科生在一年级时的必修课程。
课程的主要内容包括:化学热力学和结构化学的基本知识,酸碱电离等四大平衡的基本理论,有关气体、液体和溶液的基本概念,元素及其化合物的基本性质和定性分析等。
本课程的目的是要求学生掌握无机化学的基本概念、基本理论、元素及无机化合物的基本性质规律以及定性分析方法,为学生后续化学课以及相关专业课的学习打好基础。
该课程与基础无机化学实验结合,使学生进一步加深对无机化学的基本概念和理论的理解和认识,让学生初步掌握基本的化学实验方法。
课程名称:无机化学(生物类)课程类型:本科生必修课学时学分:30学时,2学分教学方式:教学讲授与基础无机化学实验结合;学时分配:课堂讲授30学时,期中考2学时,复习总结2学时学生成绩评定:期末80%,平时20%主要教学内容第一章气体、液体、溶液(自学)一.理想气体定律1.理想气体状态方程的导出,方程式中各项的物理意义和单位2.理想气体状态方程的应用二.混合气体分压定律1.气体的分压定律2.分压定律的应用三.实际气体四.气液转化与平衡,液体的蒸汽压五.溶液浓度的表示方法及换算,溶解度第二章化学反应的方向(3学时)一.化学热力学的常用术语二.热化学1.热力学第一定律2.焓和焓变的性质3.如何得到反应的焓变三.化学反应方向的判断1.熵与熵变的性质2.熵增加原理、熵变的计算3.Gibbs自由能(G)与Gibbs自由能变化(ΔG)(1) ΔG是反应自发性的判据(2) ΔG的性质和计算(3) Gibbs-Helmholts方程的应用第三章化学反应的限度(2学时)一.化学平衡的特征二.平衡常数1.经验平衡常数(K)2.标准平衡常数(Kθ),Kθ与K的区别与联系3.多重平衡4.平衡常数的计算与应用三. 化学平衡的移动1.浓度的影响2.压力的影响3.温度的影响第四章酸碱电离平衡(3学时)一. 酸碱质子理论1. Brφn sted-lowry质子理论,共轭酸碱对的概念2. 酸碱的强弱,K a、K b及其相互关系二. 各类酸碱平衡,平衡常数K及溶液pH的计算1.水的自偶电离平衡2.一元弱酸(碱),多元弱酸(碱)的电离平衡3.酸碱中和反应三.酸碱电离平衡的移动及应用1.同离子效应及其计算2.酸度对电离平衡的影响3.缓冲溶液的组成、选择、配制及pH的计算第五章沉淀溶解平衡(2学时)一.溶度积(K sp)1.溶度积的概念2.如何求得溶度积,溶度积与溶解度的关系二.沉淀的生成和溶解1.同离子效应和沉淀的完全度2.沉淀的溶解,酸溶反应3.沉淀的转化三、分步沉淀1.分步沉淀的可能性2.分步沉淀的控制第六章氧化还原反应及电化学基础(3学时)一.氧化还原反应的一些基本概念1.氧化还原反应,氧化态与还原态的共轭关系2.氧化数3.氧化还原反应方程式的配平二.标准电极电势与非标准电极电势1.原电池、电池符号、电池电动势2.标准电极电势的确定,标准电极电势表及其应用3.非标准电极电势,Nernst方程及其应用4.氧化还原平衡,Kθ与εθ的关系三.电极电势的应用1.判断氧化剂还原剂的相对强弱2.判断氧化还原反应的方向3.判断氧化还原反应的先后次序4.pH, K sp, K稳,等热力学常数与电极电势的关系第七章原子结构(3学时)一.氢原子光谱与Bohr模型二.微观粒子的运动规律1.微观粒子的波粒二象性及其实验依据2.波函数与原子轨道3.四个量子数4.波函数与电子云的图象表示三、多电子原子结构1.多电子原子轨道与能级2.屏蔽效应与钻穿效应3.多电子原子核外电子排布与周期率四.元素某些基本性质及其变化规律第八章化学键与分子结构(4学时)一.化学键1.离子键的本质、特征、强弱、离子半径2.共价键与共价分子的特征(1) 经典Lewis学说(2) 价键理论:共价键本质、特征,杂化轨道理论(3) 价层电子对互斥理论(4) 分子的极性二.分子间作用力与氢键1.分子间作用力的类型、本质、特点2.氢键的类型、形成条件、本质、特点三、晶体结构1.晶体的一般类型、晶胞2.四种晶体及其基本性质四.化学键型和晶体构型的变异离子极化的概念,离子极化对键型、晶型及物质性质的影响第九章配位化合物(3学时)一.配位化合物的基本概念定义、组成、命名、类型、异构现象二.配位化合物的化学键理论1.价键理论2.晶体场理论三.配位平衡1.K稳及有关配位平衡的计算2.配位平衡与其他平衡的关系及配合物之间的转化四.配合物的应用第十章 s区和ds区元素(2学时)一.s区和ds区元素的结构特点及差异性二.s区元素1.金属的活泼性2.氢氧化物的碱性3.Li, Be的特殊性+、Mg2+、Ca2+、Ba2+的分离及鉴定反应(见第十三章13.2) 4. Na+、K+、NH4三.ds区元素1.单质的物理化学性质2.常见氧化态及其转化3.重要化合物(配合物)4.Cu2+、Ag+、Zn2+、Hg2+的分离及鉴定反应(见第十三章13.2)第十一章p区元素(6学时)一.p区非金属元素1.卤素(1) 卤素单质的物理化学性质,非金属的活泼性(2) 卤化氢沸点、还原性、热稳定性、酸碱性等的变化规律(3) 卤素含氧酸(盐)卤素各价态含氧酸及其盐的命名,氧化性强弱,热稳定性,含氧酸的酸性(4) Cl-、Br-、I-离子的分离及鉴定反应(见第十三章13.3)2.氧、硫(1) 氧化物,过氧化物(2) 硫化氢、硫化物(3) 各种硫的含氧酸及其盐(4) S2-, SO32-, SO42-, S2O32-的分离及鉴定反应(见第十三章13.3)3.氮、磷(1) 氨和铵盐(2) 氮、磷氧化物(3) 氮、磷含氧酸及其盐(4) NO3-、NO2-、PO43-的鉴定反应(见第十三章13.3)4.碳、硅、硼(1) 氧化物(2) 含氧酸及其盐二.p区金属元素1.铝及其化合物2.锡、铅、铋(1) 锡、铅、铋的重要化合物及其特性(2) Sn2+、Pb2+、Bi3+、Al3+的分离及鉴定反应(见第十三章13.2)三.p区元素小结1.单质与氢化物2.氧化物,含氧酸及其盐第十二章d区元素(3学时)一.过渡金属的通性1.金属单质的物理化学性质2.形成化合物的某些特点二.铬、锰1.金属活泼性2.氧化物、氢氧化物的酸碱性3.Cr的高低价态的氧化还原性4.Mn的高低价态的氧化还原性三.铁、钴、镍1.金属活泼性2.氧化物、氢氧化物酸碱性及稳定性3.二、三价铁盐的还原性,铁的E-pH图4.铁、钴、镍的重要配合物5.Fe3+、Cr3+、Al3+、Co2+、Ni2+的分离及鉴定反应第十三章定性分析简介(自学)一.定性分析反应二.金属阳离子的分离及检出三.阴离子的检出(干扰离子的分离)。

无机化学,有机化学,物理化学,分析化学无机化学元素化学、无机合成化学、无机高分子化学、无机固体化学、配位化学(即络合物化学)、同位素化学、生物无机化学、金属有机化学、金属酶化学等。
有机化学普通有机化学、有机合成化学、金属和非金属有机化学、物理有机化学、生物有机化学、有机分析化学。
物理化学结构化学、热化学、化学热力学、化学动力学、电化学、溶液理论、界面化学、胶体化学、量子化学、催化作用及其理论等。
分析化学化学分析、仪器和新技术分析。
包括性能测定、监控、各种光谱和光化学分析、各种电化学分析方法、质谱分析法、各种电镜、成像和形貌分析方法,在线分析、活性分析、实时分析等,各种物理化学性能和生理活性的检测方法,萃取、离子交换、色谱、质谱等分离方法,分离分析联用、合成分离分析三联用等。
无机化学第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:nRT PV = R 为气体摩尔常数,数值为R =8.31411--⋅⋅K molJ3、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton 分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃=273.15K STP 下压强为101.325KPa = 760mmHg = 76cmHg)第二章:热化学第一节:热力学术语和基本概念1、 系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为: ⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。


《物理化学Ⅲ》课程教学大纲根据2015版化工类本科培养计划英文课程名称:Physical Chemistry I课程编号:B043022总学时:80总学分:5先修课程:高等数学、概率与统计、大学物理、无机化学、分析化学、有机化学等适用专业:应用化学、化学工程、制药、材料、材化、生物、生技、食品、轻化工等开课单位:化学工程学院 物理化学教研室执笔人: 审校人:一、课程教学内容绪论物理化学课的目的和基本内容;学习物理化学的要求及方法;物理化学量的表示及运算:物理量的表示;对数中的物理量;量值计算。
第一章 气体的P V T 关系第一节 理想气体的状态方程理想气体状态方程;理想气体模型;摩尔气体常数。
第二节 理想气体混合物混合物的组成;理想气体状态方程对理想气体混合物的应用;道尔顿定律;阿马加定律。
第三节真实气体的液化与临界参数液体的饱和蒸气压;临界参数;真实气体的m V p -图及气体的液化。
第四节 真实气体的状态方程真实气体的m V p -图及波义尔温度;范德华方程;维里方程;其他重要方程举例。
第五节 对应状态原理及普遍化压缩因子图压缩因子;对应状态原理;普遍化压缩因子图。
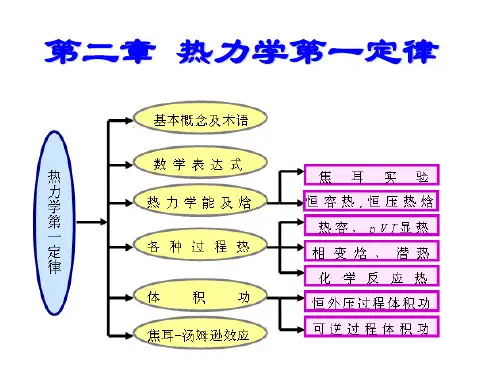
第二章 热力学第一定律第一节热力学基本概念及术语系统和环境;状态和状态函数;过程和途径。
第二节 热力学第一定律功;热;热力学能;热力学第一定律。
第三节 恒容热、恒压热及焓恒容热;恒压热;焓;H Q U Q P v ∆=∆=,两关系式的意义。
第四节 摩尔热容热容;气体恒容变温过程;气体恒压变温过程;凝聚态物质变温过程。
焦尔实验;焦尔实验的讨论;理想气体的热力学能;理想气体的焓。
第五节 相变焓相变焓;相变焓与温度的关系。
第六节化学反应焓化学计量数;反应进度;摩尔反应焓;标准摩尔反应焓。
第七节标准摩尔反应焓反应焓的计算由标准摩尔生成焓及由标准摩尔生成焓计算标准摩尔反应焓;标准摩尔燃烧焓及由标准摩尔燃烧焓计算标准摩尔反应焓;标准摩尔反应焓随温度的变化—基希霍夫公式;恒容反应热与恒压反应热之间的关系;燃烧和爆炸反应的最高温度。

第三章化学热力学基础——反应方向与反应限度3.1 什么是化学热力学Fe 2O 3(s) + 3 CO(g) →2 Fe(l) + 3 CO 2(g)为什么不能用同样的方法进行高炉炼铝?NO ,CONO 和CO 是汽车尾气中的有毒成分,它们能否相互反应生成无毒的N 2和CO 2?2NO (g) + 2CO(g) →N 2(g) + 2CO 2 (g)石墨金刚石C (石墨) →C (金刚石)库里南1号?化学热力学的作用:●体系(System)●环境(Surrounding)(一)The system is the sample or reaction mixture in which we are interested. Outside the system are the surroundings. The system plus its surroundings is sometimes called the universe.体系环境能量敞开体系封闭体系孤立体系●封闭体系(closed system):●敞开体系(open system):●孤立体系(isolated system):(二)●热(heat, Q):Q的符号——体系吸热取正值,放热取负值。
●功(work, W):Work = (Force) ×(Distance)体积膨胀功W的符号——环境对体系做功取正值,体系对环境做功取负值。
●体积膨胀功:The gas does work as it expands isothermally, but heat flows in torestore the energy lost as work.The gas does no work as it expands isothermally into a vacuum.W = -F ⋅d =-(P ⋅A ) ⋅h = -P ⋅ΔV W =-P ext ⋅ΔV(三)——恒压反应热(Q p)和恒容反应热(Q v)铝热剂(thermite)可引发强烈的放热反应(Al + Fe2O3),其可熔化所产生的金属铁,并产生“铁花”。
无机化学,有机化学,物理化学,分析化学无机化学元素化学、无机合成化学、无机高分子化学、无机固体化学、配位化学(即络合物化学)、同位素化学、生物无机化学、金属有机化学、金属酶化学等。
有机化学普通有机化学、有机合成化学、金属和非金属有机化学、物理有机化学、生物有机化学、有机分析化学。
物理化学结构化学、热化学、化学热力学、化学动力学、电化学、溶液理论、界面化学、胶体化学、量子化学、催化作用及其理论等。
分析化学化学分析、仪器和新技术分析。
包括性能测定、监控、各种光谱和光化学分析、各种电化学分析方法、质谱分析法、各种电镜、成像和形貌分析方法,在线分析、活性分析、实时分析等,各种物理化学性能和生理活性的检测方法,萃取、离子交换、色谱、质谱等分离方法,分离分析联用、合成分离分析三联用等。
无机化学第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:nRT PV = R 为气体摩尔常数,数值为R =8.31411--⋅⋅K molJ3、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton 分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃=273.15K STP 下压强为101.325KPa = 760mmHg = 76cmHg)第二章:热化学第一节:热力学术语和基本概念1、 系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为: ⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。