实验项目二住骨髓间充质干细胞的倍增时间与生长曲线的测定资料
- 格式:doc
- 大小:701.00 KB
- 文档页数:7

细胞生长曲线的测定细胞生长曲线的测定一:背景与原理生长曲线是测定细胞生长数的常用方法,也是判定细胞活力的重要指标,是培养细胞生物学特性的基本参数之一。
一般细胞传代之后,经过短暂的悬浮后贴壁,随后渡过长短不同的潜伏期,即进入快速生长的指数生长期。
在细胞达到饱和密度后,停止生长,进入平台期,然后退化衰亡。
为了准确描述整个过程中细胞数目的动态变化,需连续对细胞进行计数。
通常计数6天。
为精确起见,一般每次实验设3个平行重复。
【晶莱生物】二:材料、试剂与仪器1. 实验材料Hela细胞系。
2. 实验试剂DMEM培养基(青霉素,链霉素,10%血清),0.25%胰蛋白酶溶液,台酚蓝染液。
3. 实验仪器超净工作台,CO2培养箱,倒置显微镜,微量移液器,血细胞计数板,培养瓶,离心管,移液管,废液缸,盖玻片,24孔板。
三:方法与步骤1.取生长良好的细胞,用培养基制成细胞悬液后计数。
根据细胞计数结果按5×104/mL作传代培养接种于24孔板中,共接种21孔细胞。
1 ml/孔。
余下三孔可设传代培养的对照。
2.24h后每天记录细胞数目,每次取3孔细胞,分别进行计数。
计算平均值。
连续计数7d。
细胞用胰酶消化后加入一定量的培养基,混匀制成细胞悬液。
取少量悬液与台酚蓝1:1混合。
取一干净的血细胞计数板,盖上盖片,从盖片两边滴入细胞悬液使之充满计数板和盖片之间。
注意滴液勿有气泡,也不能太多,否则会使盖片浮起而使细胞计数不准。
3.低倍镜下观察,活细胞不着色,台盼蓝着色的细胞呈深蓝色,是不健康或已死亡的细胞,不能计数。
找出计数板上的方格,计算四角大格内总细胞数,压大格线者只计左侧和上方,不计右侧和下方细胞悬液中细胞密度计算公式为:细胞数/mL=(四角大格内细胞数/4)×104×24.根据细胞计数结果,以单位细胞数(细胞数/mL)为纵坐标,以时间为横坐标绘制生长曲线。

骨髓间充质干细胞分离及条件培养基在其培养扩增中的作用摘要:【目的】建立一种简便、快速、实用的大鼠骨髓间充质干细胞(mesenehymal stem cells,MSCs)体外分离、纯化和扩增的方法。
【方法】采用贴壁法分离纯化大鼠骨髓MSCs(rMSCs),并对其形态学特征进行观察,培养时观察条件培养基对rMSCs生长的影响。
【结果】贴壁法能有效地分离rMSCs,采用条件培养液培养,细胞活力好,增殖能力强,对维持细胞正常形态有着重要作用。
【结论】贴壁分离法能成功地进行rMSCs的体外分离,采用爷件培养液建立的rMSCs培养方法有效可行。
关键词:骨髓问充质干细胞/分离和提纯;细胞培养骨髓间充质干细胞(MSCs)是一种成体干细胞,具有较强的可塑性,能被诱导分化为成骨细胞、成软骨细胞、成脂肪细胞、成肌细胞等⋯1,同时发现MSCs还具有独特的免疫调节作用[2-4J。
细胞学、组织学及器官学的研究者均把目光投向MSCs,同时MSCs也受到药理研究者的关注。
MSCs除了可作为组织工程较理想的种子细胞外,也可作为药物作用的靶标或药理研究的工具,利用MSCs体内外生物学性质进行中药作用机理的研究已有众多报道I 。
但由于骨髓中的MSCs含量很低,1 个骨髓单核细胞中仅含有1~2个MSCs~11 J,加之MSCs主要存在于骨内膜_】,要获得满足药物研究所需的数量比较困难。
因此,采用合适的MSCs分离、纯化和扩增的方法是许多研究的重要前提。
1 材料与方法1.1 动物Sprague Dawley(SD)大鼠,性别不限,体质量100~120 g,本校实验动物中心提供,合格证号为SCXK (粤)2003.0001。
1,2 主要试剂低糖Dulbeceo改进的Eagle培养基(1ow glucose Dulbecco’s Modified Ea e Medium,LDMEM)由GIBCO 公司提供;胎牛血清(fetalbovine serum,FBS)由杭州四季青生物工程材料有限公司提供;2.5 g/L胰酶(含0.2 g/L EDTA)由吉诺生物医药技术有限公司提供;HEPES为Sigma产品,广州威佳公司分装;青霉素、链霉素由华北制药有限公司提供;兔抗大鼠CD44、CD54、I 型胶原抗体,生物素化抗生蛋白链菌素复合(Streptavidin.Biotin.Complex,SABC)试剂盒,二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒均由武汉博士德公司提供。
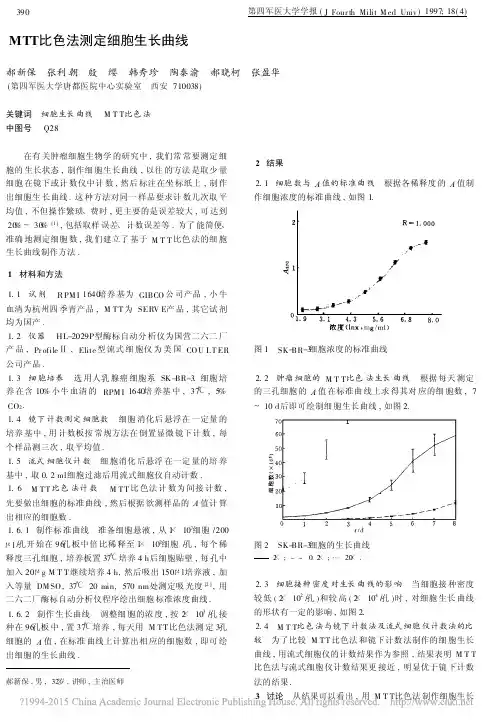
MTT比色法测定细胞生长曲线郝新保 张利朝 殷 缨 韩秀珍 陶秦渝 郝晓柯 张盈华(第四军医大学唐都医院中心实验室 西安710038)关键词 细胞生长曲线 M T T比色法中图号 Q28 在有关肿瘤细胞生物学的研究中,我们常常要测定细胞的生长状态,制作细胞生长曲线,以往的方法是取少量细胞在镜下或计数仪中计数,然后标注在坐标纸上,制作出细胞生长曲线.这种方法对同一样品要求计数几次取平均值,不但操作繁琐、费时,更主要的是误差较大,可达到20%~30%[1],包括取样误差、计数误差等.为了能简便、准确地测定细胞数,我们建立了基于M T T比色法的细胞生长曲线制作方法.1 材料和方法1.1 试剂 R PM I1640培养基为GIBCO公司产品,小牛血清为杭州四季青产品,M T T为SERV E产品,其它试剂均为国产.1.2 仪器 HL-2029P型酶标自动分析仪为国营二六二厂产品,Pr ofileⅡ,Elite型流式细胞仪为美国CO U L T ER 公司产品.1.3 细胞培养 选用人乳腺癌细胞系SK-BR-3.细胞培养在含10%小牛血清的RPM I1640培养基中,37℃,5% CO2.1.4 镜下计数测定细胞数 细胞消化后悬浮在一定量的培养基中,用计数板按常规方法在倒置显微镜下计数,每个样品测三次,取平均值.1.5 流式细胞仪计数 细胞消化后悬浮在一定量的培养基中,取0.2ml细胞过滤后用流式细胞仪自动计数.1.6 M T T比色法计数 M T T比色法计数为间接计数,先要做出细胞的标准曲线,然后根据欲测样品的A值计算出相应的细胞数.1.6.1 制作标准曲线 准备细胞悬液,从1×107细胞/200μl/孔开始在96孔板中倍比稀释至1×102细胞/孔,每个稀释度三孔细胞,培养板置37℃培养4h后细胞贴壁,每孔中加入20μg M T T继续培养4h,然后吸出150μl培养液,加入等量DM SO,37℃20min,570nm处测定吸光度[2],用二六二厂酶标自动分析仪程序绘出细胞标准浓度曲线.1.6.2 制作生长曲线 调整细胞的浓度,按2×103/孔接种在96孔板中,置37℃培养,每天用M T T比色法测定3孔细胞的A值,在标准曲线上计算出相应的细胞数,即可绘出细胞的生长曲线.郝新保,男,32岁,讲师,主治医师2 结果2.1 细胞数与A值的标准曲线 根据各稀释度的A值制作细胞浓度的标准曲线,如图1.图1 SK-BR-3细胞浓度的标准曲线2.2 肿瘤细胞的M T T比色法生长曲线 根据每天测定的三孔细胞的A值在标准曲线上求得其对应的细胞数,7~10d后即可绘制细胞生长曲线,如图2.图2 SK-BR-3细胞的生长曲线2×;--0.2×;…20×.2.3 细胞接种密度对生长曲线的影响 当细胞接种密度较低(2×102/孔)和较高(2×104/孔)时,对细胞生长曲线的形状有一定的影响,如图2.2.4 M T T比色法与镜下计数法及流式细胞仪计数法的比较 为了比较M T T比色法和镜下计数法制作的细胞生长曲线,用流式细胞仪的计数结果作为参照,结果表明M T T 比色法与流式细胞仪计数结果更接近,明显优于镜下计数法的结果.3 讨论 从结果可以看出,用M T T比色法制作细胞生长曲线完全可行.因其减少了取样和计数误差,免除了贴壁细胞的消化等,使其具有简便、快速的特点.对几种不同方法制作的生长曲线进行比较发现,M T T比色法在客观性上也比镜下计数法有了很大的提高.要掌握好这个方法首要的一点是标准曲线的制作,稀释一定要准确,在保证标准曲线如实反映细胞数的基础上,才能制作出好的生长曲线.在测定时,接种细胞的密度对生长曲线的影响较大.从图2可以看出,接种密度过高或过低都不利于生长曲线的制作,这与细胞的生长能力有关,可进行简单的预实验确定,一般在(1~5)×103细胞/孔为好.尽管M T T比色法测定细胞生长曲线具有很多优点,但因其需要使用自动酶标仪而受到了一定的限制,如果能开发出细胞生长曲线专用软件,就能摆脱自动酶标仪的限制,利用普通酶标仪就可以开展工作了.参考文献1鄂 征.组织培养技术.第2版.北京:人民卫生出版社,1993: 1542候 健,孔宪涛.四甲基偶氮唑蓝比色法检测人血清白细胞介素6.中华医学检验杂志,1993;16(4):208~210(收稿1996-09-17 修回1997-02-04)编辑 王小仲化云宁滴眼液的质控标准王 颖 雷其云 蒋永培 樊亚萱 (第四军医大学西京医院药局 西安710033)关键词 化云宁 钾离子 耐缺氧 质量控制 刺激性中图号 R289 我院研制的新药化云宁滴眼液为一复方中药制剂,具有活血化瘀、退翳明目的功效,是治疗角膜瘢痕(角膜云翳,角膜斑翳)的理想药物.在化云宁研制和生产的质量控制上,我们采用了钾离子(K+)含量测定、刺激性实验及生物检定方法作为质控标准,保证了化云宁滴眼液在临床上安全和有效地使用.1 材料和方法1.1 药物与试剂 化云宁滴眼液由丹参、黄芩和金银花等生药的提取液按眼药常规要求制备而成;心得安注射液(1mg/ml,批号830706,北京制药厂);丹参素注射液(10 mg/ml,批号820401,上海医科大学附属中山医院制);生理盐水(2ml/支,批号8303023,自制).1.2 实验动物 BA L B/c小鼠,雄性,6~8周龄,体重18~21g;新西兰白兔2只,雄性,编号分别为543,554,体重分别为2.05kg和2.45kg(以上动物均由本校实验动物研究中心提供).1.3 K+含量测定[1] 用System E4A型火焰光度计(美国BECKM AN公司制造)分别测定化云宁滴眼液成品及其组方中各味药的提取液(丹参,黄芩,金银花等)中K+浓度.样品在测定前均用N aO H调p H值至6.8~7.0.1.4 刺激性实验 采用家兔滴眼法.选取健康新西兰白兔2只,编号分别为543,554,用药前,检察兔眼结膜血管、角膜透明度等均属正常,如①结膜无血丝及发红;②王 颖,女,42岁,主管药师角膜不浑浊,呈透明状;③眼角无分泌物.左眼点化云宁滴眼液2滴(批号850619),右眼点生理盐水2滴作为对照,用药后开始记录时间,并观察眼部反应情况.结果判定以上述用药前检察的①~③项指标无异常为无刺激症状表现(-),否则为被检眼药有刺激性(+).1.5 常压耐缺氧实验 按表2中的剂量,小鼠腹腔(注射)给药(批号830509,自制)后30min,放入容量为250ml的磨口玻璃瓶中,瓶内放钠石灰5g,每瓶放小鼠一只,放入后用凡士林密封盖紧,并开始记录其存活时间[2].以生理盐水组为对照,比较各组间统计学上的差异,统计学处理采用t检验.2 结果2.1 药液中K+浓度的测定 在中药滴眼液与中药注射液中常含有来源于植物药材本身的K+,其浓度过高可引起局部疼痛.我们采用中草药注射液的K+浓度限定范围[40%~60%(mg/ml)以下][3]做为化云宁滴眼液的质控标准之一.六个批号的化云宁滴眼液中K+浓度测定的结果见表1,均符合限定标准.此外,对化云宁滴眼液中丹参,黄芩和金银花三种主药提取液的K+浓度也分别进行了检测,结果(三次测定的平均值)分别为47.6%,0.8%和1.2%(mg/ml),由此可见,该滴眼液中的K+主要来源于丹参.2.2 刺激性实验 经2只新西兰白兔左、右眼对照实验观察,除1只兔左眼在用药液后15min时观察有轻度流泪外,其余均无任何刺激性反应.因此,该眼药符合有关规定.。

细胞生长状况有关指标的检测方法一、细胞计数这是细胞培养中常用的基本技术之一。
所用材料为细胞计数板。
巴氏吸管和显微镜。
步骤如下。
l 取清洁计数板和专用盖玻片,用丝绸布轻轻擦干。
l 取细胞悬液0.3ml,加入0.9结晶紫染液,混匀后滴半滴于细胞计数板内,以充满不外溢为宜。
也可直接将细胞悬液在一侧滴加到盖玻片中,不要溢出,也不要过少或出现气泡。
l 在显微镜下用10X物镜观察计数四角大方格中的细胞数。
代入下式得出细胞密度。
细胞数(ml)=(4大格细胞数之和/4)×104×稀释倍数台盼蓝染色法可计算出活细胞和死细胞数以测定细胞存活百分率。
一般0.5%-1.0%的台盼蓝染液可使死细胞染成蓝色,活细胞不着色。
此外还可用0.02%的藻红b染液将死细胞或受损细胞染成红色,或用0.05%的苯胺黑染液将死细胞染成黑丝。
细胞存活率=[4大格活细胞数/(4大格活细胞数+4大格死细胞数)]×100%在进行细胞计数操作时,必须把细胞悬液准备好,细胞应分散良好,并充分混匀,若出现较多细胞团或细胞数少于200个/10mm2或多于500个/100mm2时,需重制细胞悬液,重新计数。
二、细胞生长曲线和生长倍数细胞生长曲线是细胞培养实验中最基本的指标,是测定细胞绝对增值数值和生长繁殖基本规律常用的简便方法。
常用的方法为:在同一规格的培养瓶中,接种等量的同一代细胞,经培养后每隔24h取出几瓶细胞进行计数,以培养时间为横坐标,不同时刻的细胞数的对数为纵坐标,标出各点并连成线,即为该细胞的生长曲线,可反映出细胞生长的动态。
测定生长曲线的另一种方法是用96孔/24孔细胞培养板,分7组,每组3孔,培养1周(7天),期间逐日检测一组,计数,最后把7天中的细胞数值绘成图,即为细胞生长曲线。
也可采用MTT法来进行生长曲线测定。
标准的细胞生长曲线近似“S”形,一般在传代后第一天细胞数有所减少,经过一段时间的潜伏期,再进入对数生长期,达到平台期后生长稳定,最后衰老。

isct 间充质干细胞鉴定标准理论说明1. 引言1.1 概述在细胞治疗和再生医学领域,间充质干细胞(ISCT)作为一种重要的细胞资源,引起了广泛的关注。
ISCT具有多向分化潜能、免疫调节作用及促进组织修复的能力,被认为是一种理想的干细胞来源。
然而,由于缺乏统一和规范的鉴定标准,在实践应用中存在着不确定性和挑战。
1.2 文章结构本文将对ISCT进行深入探讨,并重点介绍其鉴定标准的理论说明。
文章包括以下几个部分:引言、ISCT间充质干细胞、鉴定标准理论说明、实践应用与挑战以及结论与展望。
1.3 目的本文旨在系统梳理当前关于ISCT鉴定标准的理论知识,并探讨该领域面临的实践应用和挑战。
通过对ISCT表面标记物使用、功能性特征评估方法以及分子生物学检测手段应用等方面原理的介绍,希望能够提供给读者一个全面的理论基础,并展望ISCT鉴定标准未来的发展方向。
同时,对于临床转化前景展望、存在的问题与挑战以及解决方案和研究进展等方面也将进行讨论。
以上是本文“1. 引言”部分的详细内容。
该部分概述了文章的主题和目的,并介绍了本文的结构。
接下来将继续展开描述ISCT间充质干细胞及其鉴定标准相关内容。
2. ISCT间充质干细胞2.1 定义与特征ISCT(国际干细胞治疗学会)定义了间充质干细胞(MSCs)作为一类多潜能的成体干细胞,具有自我更新和多向分化的能力。
这些细胞可以从不同来源获得,包括骨髓、脐带血、脂肪组织等。
ISCT认为,MSCs应满足以下三个基本标准:1) 在培养条件下,MSCs应具备黏附能力;2) MSCs应表达特定的表面标记物,如CD73、CD90和CD105,并且在同时应该缺乏(或仅有极低水平)CD34、CD45、HLA-DR等造血和免疫相关标记物;3) MSCs应能够分化为成骨细胞、软骨细胞和脂肪细胞等不同种类的细胞。
此外,ISCT提出了额外的功能性特点来进一步确认MSCs。
这些功能性特点包括:1) 免疫调节作用:MSCs可以抑制免疫反应,并通过调节T淋巴细胞、B 淋巴细胞和自然杀伤细胞等免疫细胞的功能来达到免疫调节作用;2) 细胞迁移能力:MSCs具有从注射部位向受损组织迁移的能力;3) 分泌多种生物活性分子:MSCs可以产生多种生长因子、细胞因子和表观遗传调控因子,对损伤修复和组织再生具有重要作用。

MTT法绘制生长曲线一细胞生长曲线:A、目的:学习细胞生长曲线的测定方法,观察细胞生长基本规律。
B、背景知识细胞生长曲线是观察细胞生长基本规律的重要方法。
只有具备自身稳定生长特性的细胞才适合在观察细胞生长变化的实验中应用。
因而在细胞系细胞和非建系细胞生长特性观察中,生长曲线的测定是最为基本的指标。
原理(选填项目):细胞生长曲线的测定一般可利用细胞计数法进行。
C、材料(一)仪器1. 净化工作台2. 离心机3. 恒温水浴箱4. 冰箱(4℃、-20℃)5. 倒置相差显微镜6. 培养箱(37℃、5%CO2、饱和湿度)(二)玻璃器皿1. 吸管(弯头)2. 培养瓶3. 玻璃瓶(250ml、100ml)4. 废液缸(三)塑料器皿1. 吸头2. 枪头3. 24培养板4. 胶塞(四)其他物品1. 微量加样枪2. 红血球计数板(五)试剂1. D-Hanks液2. 小牛血清3. RPMI16404. 双抗(青霉素、链霉素)5. 0.08%胰酶(四)、操作步骤1. 取生长状态良好的细胞,采用一般传代方法进行消化,制成细胞悬液;2. 计数,精确地将细胞分别接种于21~30个大小一致的培养瓶内或培养孔(以24孔培养板为宜),每瓶或孔细胞总数要求一致,加入培养液的量也要一致。
3. 每天或每隔一天取出3瓶(孔)细胞进行计数,计算均值。
培养3~5d常要给未计数的细胞换液。
4. 以培养时间为横轴,细胞数为纵轴(对数),描绘在半对数座标纸上,连接成曲线后即成该细胞的生长曲线。
9(五)、注意事项1.细胞生长曲线虽然最为常用,但有时其反映数值不够精确,可有20~30%的误差,需结合其它指标进行分析。
2.现在很多实验室利用培养板采用MTT法进行生长曲线测定,较为简便。
3.标准的细胞生长曲线近似“S”形,一般在传代后第一天细胞数有所减少,再经过几天的潜伏适应期,然后进入对数生长期,达到平台期后生长稳定,最后到达衰老。
4.在生长曲线上细胞数量增加1倍时间称为细胞倍增时间,可以从曲线上换算出。
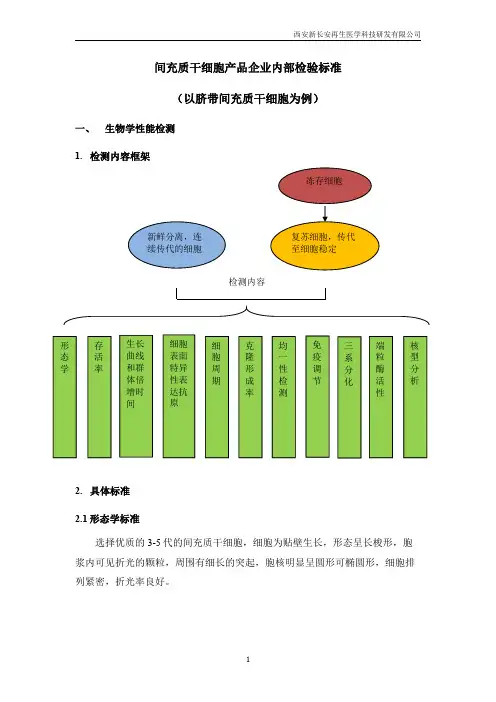
间充质干细胞产品企业内部检验标准(以脐带间充质干细胞为例)一、生物学性能检测1.检测内容框架2.具体标准2.1形态学标准选择优质的3-5代的间充质干细胞,细胞为贴壁生长,形态呈长梭形,胞浆内可见折光的颗粒,周围有细长的突起,胞核明显呈圆形可椭圆形,细胞排列紧密,折光率良好。
冻存细胞新鲜分离,连续传代的细胞复苏细胞,传代至细胞稳定形态学存活率生长曲线和群体倍增时间细胞周期克隆形成率端粒酶活性细胞表面特异性表达抗原均一性检测核型分析三系分化免疫调节检测内容2.2存活率标准台盼蓝染色计数,传代细胞存活率应≥90%。
经过冷冻、复苏后细胞活率应≥80%。
活细胞率(%)=活细胞总数/细胞总数*100%2.3生长曲线和群体倍增时间标准2.3.1生长曲线应呈S型增长曲线,如下图(代数越低细胞对数增长期越明显,增长越旺盛)2.3.2群体倍增时间30±8h(注:群体倍增时间越高表明细胞衰老程度越高)细胞群体倍增简化公式:Td=24h/b2.4细胞周期标准流式细胞仪检测细胞周期,G0/G1期:65±5%、S期:20±5%、G2期:15±5%。
2.5克隆形成率标准30%>克隆形成率应>20%克隆形成率=(克隆数/接种细胞数)×100%2.6端粒酶活性标准脐带间充质干细胞应无端粒酶(或非常微弱)表达。
2.7细胞表面特异性分子表达标准通过流式细胞仪检测细胞表面特异性表达分子:抗原分子CD73CD90CD105CD14CD19CD34CD45HLA-DR 表达标准≥95%≥95%≥95%≤2%≤2%≤2%≤2%≤2%2.8均一性检测本品应无异基因混合细胞(采用PCR-毛细管电泳分析方法,STR图谱分析法)。
2.9核型分析本品的染色体数目、核型无异常。
判定标准:对1000个和500个中期细胞标本异常率进行检査,合格的上限(可信限90%Poison法)见下表。
2.10生物学功能具备多向分化功能(三系分化:成骨成脂成软骨分化)2.10.1成骨细胞诱导分化间充质干细胞经传统成骨诱导培养基诱导培养,应具备分化为成骨细胞的功能。

骨髓间充质干细胞的研究进展【关键词】骨髓干细胞骨组织工程学研究内容要紧包括三方面a)种子细胞的研究;b)支架材料的研究;c)组织工程化骨的临床应用。
其中种子细胞是组织工程研究中首要的、最大体的环节。
作为骨组织工程的理想种子细胞,应具有以下特点:a)结构比较简单,是不具有特定性能的原始细胞;b)取材容易,对机体损伤小;c)体外培育增殖能力强;d)可在必然条件下向特定方向转化;e)稳固表达到骨细胞表型;f)植入人体后能继续产生成骨活性;g)无致瘤性[1~2]。
20世纪70年代中期已证明骨髓间充质干细胞(Bone mesenchymal stem,BMSCs)具有自我增殖能力和分化潜能,且具有来源普遍、取材简单、分化成骨的潜能强等特点,成为目前骨组织工程种子细胞研究的重点。
1 BMSCs体外增殖的生物学特性及培育BMSCs的体外增殖生物学特性干细胞是指那些具有高度增殖和自我更新能力,并能分化为两种以上不同类型组织细胞的细胞;组织干细胞是指发育成熟的个体内具有多向分化潜能的细胞,目前比较明确的能够转化的组织干细胞主若是BMSCs。
对BMSCs的细胞周期研究说明,其大约有20%为静止期细胞,即G0期细胞。
这说明BMSCs具有壮大的增殖能力,每传一代细胞数量就增加2~4倍。
但有文献报导,高度传代(大于25代)的BMSCs中有一部份已经表现出凋亡特性。
BMSCs的体外培育Freiden stein发觉了骨髓培育中有呈纺锤状的少量贴壁细胞,能够分化形成多种中胚层组织,包括:骨、软骨、肌腱、肌肉组织、骨髓基质结缔组织等,这种形成集落的初始骨髓基质细胞被称为成纤维细胞样细胞集落形成单位(Colony forming unit firbroblastic,CFU F)。
Minguell[3]以为BMSCs为存在于骨髓基质中的非造血来源的细胞亚群,Ashton称其为骨髓基质成纤维细胞。
BMSCs对营养条件要求高,而且含量很低,约为%~%,要利用BMSCs就必需实现其体外分离培育及扩增[4]。

MTT法测定细胞生长曲线
1、取生长状况良好的细胞,常规消化制成单细胞悬液并计数,调整细胞成六个浓度梯度,依次为:5x103、1x104、2x104、3x104、4x104、5x104/ml,均匀接种细胞于96孔细胞培养板,每孔加细胞悬。
液200ul,每个浓度组设6个复孔,共接种7块培养板,37℃、5%C02浓度,饱和湿度培养箱中连续孵育24/48/72/96/120/148/172小时后。
2、每孔加入20ulMTT溶液(smg/m1用PBS<ph=7.4>配),继续孵育4h后终止培养。
3、快速翻转培养板,弃去上清液,每孔加入150ulDMSO,振荡10min,使MTT蓝紫色结晶完全溶解。
4、用酶联免疫检测仪于490nm处检测各孔的吸光值(OD值),并以未接种细胞只加培养基孔的吸光值为空白对照调零,取6孔平均值。
5、实验重复3次,以培养“时间”为横轴,“吸光值”为纵轴绘制细胞生长曲线。


MRC-5体外培养细胞生长曲线测定一.实验目的认识细胞接种和传代培养中细胞生长增殖规律。
二.实验原理在培养接种或每一次传代培养过程中,培养物都要经历相似的恢复和生长过程。
细胞生长曲线反映的是培养细胞从接种到传代之前的生长状况,也是判定细胞活力的重要指标。
一般细胞传代之后,经过短暂的悬浮然后贴壁,随后度过长短不同的潜伏期,紧接着进入大量分裂的指数生长期。
在细胞达到饱和密度后,停止生长,进入平台期,然后退化衰亡。
为了准确描述整个过程中细胞数目的动态变化,典型的生长曲线可分为生长缓慢的潜伏期,斜率较大的指数生长期,呈平台状的平台期及退化衰亡4个部分。
以培养时间为横坐标、细胞密度为纵坐标绘制细胞的生长曲线坐标图。
三.实验准备3.1实验人员用品工作服、帽子、口罩、手套、肥皂、医用手臂消毒桶、0.1%新洁尔灭消毒液;3.2消毒和灭菌用品电炉、高压蒸汽灭菌锅、铝盒、24孔细胞培养板、移液管、枪头、洗耳球、离心管(规格:1.5mL/5mL/10mL);3.3药品和试剂DMEM细胞培养液(10%血清)、0.25%胰蛋白酶-0.53Mm EDTA、PBS(-);3.4 细胞MRC-5人二倍体细胞;3.5设备与器材CO2培养箱、离心机、移液枪(规格:1000uL、200uL)、二级生物安全柜、血细胞计数板、显微镜、记号笔、废液瓶;四.实验步骤4.1细胞接种4.1.1选择生长良好的MRC-5人二倍体细胞,移液管移除原细胞培养液至废液瓶中;4.1.2 DPBS润洗三次,每次5mL;4.1.3 吸管吸取1mL胰蛋白酶溶液浸润培养层细胞,37℃恒温消化2~10min;4.1.4用含10%血清的DMEM培养液4mL终止消化;4.1.5将终止消化后的细胞悬液用移液管转移至离心管中,1000r/min离心8min,弃上清;4.1.6吸管吸取2mL DMEM细胞培养液悬浮细胞;4.1.7对细胞悬浮液进行细胞计数;4.1.8调整悬浮液的细胞浓度分别为5×103个/mL(A) 、2×104个/mL(B)、 5×104个/mL(C)3种不同的细胞浓度(细胞理论数:1.575×104个);4.2 细胞培养4.2.1依次将浓度为5×103个/mL(A) 、2×104个/mL(B)、 5×104个/mL(C)的细胞悬液分装于3个有盖的24孔细胞培养板,分别按每孔接种1mL,每种浓度各接21孔,进行细胞的悬浮培养;4.3 细胞换液细胞接种培养后,分别按照每间隔3d和5d换液一次。
人骨髓间充质干细胞的培养与鉴定目的分离培养人骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cells,hBMSCs),体外观察其生长特性。
方法采用密度梯度离心结合贴壁培养法自脐血中分离间充质干细胞,倒置显微镜下观察其形态及生长情况;流式细胞仪分析细胞周期并检测细胞表面标志物。
结果纯化的hBMSCs 贴壁生长,呈均一梭形,具有较强的增殖能力,流式细胞仪分析P3代hBMSCs 稳定表达间充质干细胞表面抗原标志CD73,CD90和CD105等。
结论本实验分离培养的hBMSCs具有较强的增殖能力,表达间充质干细胞的表面标记。
Abstract:Objective To isolate and culture human bone marrow derived mesenchymal stem cells(hBMSCs),and to observe biological characteristics of hBMSCs. Methods Bone marrow mononuclear cells were separated by the method of density gradient centrifugation and MSCs were obtained by adhere culture.The cell morphology and their growth characteristics in vitro were observed under an inverted phase contrast microscope and the cell cycles were tested by flowing cytometry. Mesenchymal like stem cells were identified by surface marker with flow cytometry.Results hBMSCs were adhered like a fibroblast morphology and with pool like growth alinement.Flow cytometry showed that the third passage cells were positive for CD73,CD90and CD105 expression.Conclusion The MSCs from bone marrow in this study show great capability of proliferation.Key words:Bone marrow mesenchymal stem cells;Separation;Culture and identification间充质干细胞(mesenchymal stem cells,MSCs)是来源于中胚层的具有多向分化潜能的干细胞。
生长曲线和细胞生长周期的测定MTT比色法绘制生长曲线生长曲线测定一般可用细胞计数法进行,但数值不够精确,可有20%-30%的误差,需结合其他指标进行分析。
原理:MTT,商品名噻唑蓝,是一种能接受氢原子的染料的四唑盐。
活细胞的线粒体中的琥珀脱氢酶能使外源性的MTT还原为难溶的蓝紫色结晶物并沉积在细胞中,而死细胞无此功能。
二甲基亚砜能溶解细胞中的蓝紫色复合物,用酶联免疫检测仪在490nm波长处测定其光吸收值,可间接反映细胞数量。
在一定细胞数范围内,MTT结晶物形成的量与细胞数成正比。
步骤;1.接种:用含%10胎小牛血清的培养液配成细胞悬液,以每孔1000-10000个细胞接种到96孔板,每孔体积200ul.2细胞培养:同一培养条件,培养3-5天3呈色:培养3-5天后,每孔加MTT溶液(5mg/ml用PBS配制,ph=7.4)20ul.继续孵育4h。
终止培养,小心吸弃孔内培养基上清液,对于悬浮细胞需要分离后再吸弃孔内上清液。
每孔加150ul DMSO,脱色摇床震荡10min,使结晶充分溶解。
4.比色;选择490nm(570nm)波长,在没脸免疫检测仪上测定各孔光吸收值,记录时间,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
流式细胞仪测细胞生长周期:流式测细胞周期,只需在实验结束后收集细胞(细胞数量须达到2-5x105),离心,用PBS洗三次,再转移到1.5ml的EP管内,用预冷的70百分之的酒精固定1小时,就可以送到流式细胞仪检测。
流式细胞仪细胞周期检测流程1,做前提前换液,调整细胞状态,小皿或大皿(保证细胞达到10--100万个)。
2,遇冷PBS 清洗两次3,加入胰酶(Tripsin),静止2-3分钟(消化时间不要过长,以免损伤细胞),加入2-3mlDMEM慢慢吹打细胞成单细胞悬液。
4,1000rpm 离心3min5,去上清,加入遇冷PBS 1000rpm 离心3min6,去上清,加入0.5ml PBS(预冷)悬浮细胞7,加入1.5ml无水乙醇在漩涡器上涡旋(逐滴加入)8,-20℃固定过夜(overnight)9,拿出已固定细胞,1000rpm 离心3min 去上清10,加入预冷PBS 100rpm 离心3mim11,去上清加入500ul---1000ul 预冷PBS 悬浮细胞12,加入5-10ul RNA酶37℃水浴消化30min13,过400目细胞筛注入EP管,封口膜封口。
细胞生长曲线的绘制实验报告细胞生长曲线的绘制实验报告范文篇一:实验五微生物生长量的测定及生长曲线的绘制一、实验目的学习了解微生物生长量测定的方法学习了解细菌生长曲线的绘制方法学习掌握血细胞计数板的使用方法(一)微生物生长量的测定计数法重量法生理指标法1、显微镜直接计数法(1)利用血细胞计数板计数(2)涂片计数2、活菌菌落计数法3、滤膜法(二)细菌生长曲线将单细胞细菌接种到恒定容积的液体培养基中,不补充营养物或移去培养物,细菌以二分裂方式繁殖,以时间为横坐标,细菌数目的对数值为纵坐标,可画出一条反映细菌在整个培养期间菌数变化规律的曲线,称为生长曲线(growth curve)篇二:细胞生长曲线的测定细胞生长曲线的测定一、实验目的掌握测定细胞生长曲线的.方法。
二、实验器具24孔细胞培养板、微量加样器、eppendorf管、吸头、吸头盒、显微镜、细胞计数板、载玻片、盖玻片、吸管、试管架、普通显微镜、细胞悬液、0.4%台盼蓝。
三、实验方法1. 培养细胞:首先在24孔细胞培养板内分别接种相同数量的细胞,计数并记录接种的细胞悬液密度,接种时间记为0小时。
2. 计数细胞密度:从接种时间算起,每隔24小时计数3孔的细胞密度,算出平均值。
为提高准确率,对每孔细胞可计数2-3次,如此操作至第七天结束。
3. 绘制曲线:以培养时间为横坐标、细胞密度为纵坐标,将全部结果在坐标纸上绘图,即得所培养细胞的生长曲线。
篇三:MTT法绘制生长曲线实验材料:1,5%FBS-L-DMEM, 5x104个/ml细胞悬液,5mg/mlMTT溶液,DMSO,0.01M PBS,2, 96孔板共7个,酶标仪,50ml离心管,1.5ml 离心管,0.22μm滤膜,锡箔纸,MTT工作液(1ml/管)实验步骤:1,分别选取生长良好的P1、P3、P5代BMSCs消化后制备成细胞悬液,调整细胞密度为5x104/ml。
接种到96孔板,每孔接种200μl细胞悬液进行培养(每孔1x104细胞)。
大鼠骨髓间充质干细胞的培养与鉴定干细胞研究一直是生物医学领域的前沿热点,其中骨髓间充质干细胞(BMSCs)因其具有多向分化潜能和低免疫原性而备受。
在众多研究中,大鼠BMSCs的体外培养和鉴定方法为其在科研和临床领域的应用提供了基础。
本文将就大鼠BMSCs的培养、鉴定方法进行详细介绍,并结合实验数据进行阐述。
BMSCs是一种成体干细胞,具有自我更新和多向分化潜能,可以分化为多种细胞类型,如成骨细胞、脂肪细胞、肌肉细胞等。
因其来源广泛,免疫原性低,大鼠BMSCs已成为再生医学、免疫调节等领域的重要研究对象。
近年来,随着生物技术的不断发展,BMSCs的培养和鉴定方法也得到了不断优化和改进。
BMSCs的培养需要无菌环境,常用的培养基为DMEM、F12等,添加适量的生长因子和抗生素以维持细胞的生长和存活。
细胞的鉴定主要包括形态学观察、表面标志物检测和多向分化潜能的证实。
其中,表面标志物如CDCD90等可用来区分BMSCs和其他细胞,多向分化潜能的证实包括成骨、成脂和成肌等方向的诱导分化。
本实验采用大鼠BMSCs的常规体外培养方法。
具体步骤如下:采集大鼠骨髓:在无菌环境下,用注射器抽取大鼠股骨和胫骨骨髓,加入肝素抗凝。
细胞分离:将采集的骨髓用密度梯度离心法分离出单个核细胞。
细胞培养:将单个核细胞接种于培养瓶中,用含10%血清、1%抗生素和1%谷氨酰胺的培养基培养。
细胞鉴定:经过约7-10天的培养,细胞达到80%-90%融合时,进行细胞鉴定。
通过形态学观察、表面标志物检测和多向分化潜能的证实,对BMSCs进行鉴定。
通过观察细胞的形态和生长情况,发现培养的BMSCs呈典型的长梭形,且细胞间连接紧密(图1)。
经表面标志物检测,BMSCs表达CD29和CD90等间充质干细胞表面标志物(图2)。
在多向分化潜能的证实中,我们发现BMSCs经成骨、成脂和成肌诱导后,可分别形成矿化结节、脂肪滴和肌纤维(图3)。
这些结果说明所培养的细胞为BMSCs。
PMSCs生长曲线和倍增时间的测定【1】来自猪脂肪间充质干细胞的分离培养及其成脂分化:取生长状况良好的P1、P3、P5、P9代细胞,用0.25%胰酶消化液,在37℃消化1-3min,制成单细胞悬液,然后以5x104个/ml密度接种到30个直径为35mm培养皿中,随机分成10组,每组3皿,每天检测一组中每皿的细胞总数,取3个皿的均值,如此至第10组结束,细胞技术如下(2004,司徒镇强)即一天消化3个组,共消化10天.P1,P3,P5,P9均如此,每代30个皿,共计120个皿.细胞群体倍增时间(PDT)=(t—t0)lg2/(lgN t-lgN0) t0培养起始时间,t,培养终止时间;N0培养初始细胞数,N t培养终止细胞数。
【2】增强型绿色荧光蛋白转染猪骨髓间充质干细胞特性观察用0.25%胰酶将转染后的细胞克隆消化为单个细胞,用PBS洗2遍,1x105个细胞加入75μl破膜剂,振荡10s,加入PI染料700μl,室温避光30min,上机检测;选同期培养的为转染细胞为对照组,比较EGFP转染对细胞增殖的影响,分别计算出静止期G0/G1 ,增殖期S%,和G2/M【3】两种方法分离小型猪骨髓间充质干细胞的比较分别取两组0,1,3代细胞,制成1x103的细胞悬液,接种到96孔板,每孔细胞悬液200微升,置37℃、5%CO2饱和湿度孵箱内孵育,各组每24小时分别取出4孔,每孔加入MTT (2mg/ml)20微升37℃孵育,4h后吸弃孔内培养液,每孔加入150微升分析纯的二甲基亚砜,移至酶联免疫检测仪上振荡10min,用分光光度计在492nm波长处测定每孔的吸光度值(OD492),以OD(492)值为纵坐标,时间为横坐标绘制生长曲线.【4】人骨髓间充质干细胞体外培养及其生物学特性研究取不同代数细胞,调整细胞浓度为2x104/ml后,接种于96孔培养板,置37℃,5%CO2,饱和湿度培养箱培养后,用胰酶-EDTA进行消化,用台盼蓝拒染法计数活细胞,每天取12复孔,共7天;根据计数结果绘制细胞生长曲线。
PMSCs生长曲线和倍增时间的测定
【1】来自猪脂肪间充质干细胞的分离培养及其成脂分化:
取生长状况良好的P1、P3、P5、P9代细胞,用0.25%胰酶消化液,在37℃消化1-3min,制成单细胞悬液,然后以5x104个/ml密度接种到30个直径为35mm培养皿中,随机分成10组,每组3皿,每天检测一组中每皿的细胞总数,取3个皿的均值,如此至第10组结束,细胞技术如下(2004,司徒镇强)即一天消化3个组,共消化10天。
P1,P3,P5,P9均如此,每代30个皿,共计120个皿。
细胞群体倍增时间(PDT)=(t-t0)lg2/(lgN t-lgN0) t0培养起始时间,t,培养终止时间;
N0培养初始细胞数,N t培养终止细胞数。
【2】增强型绿色荧光蛋白转染猪骨髓间充质干细胞特性观察
用0.25%胰酶将转染后的细胞克隆消化为单个细胞,用PBS洗2遍,1x105个细胞加入75μl破膜剂,振荡10s,加入PI染料700μl,室温避光30min,上机检测;选同期培养的为转染细胞为对照组,比较EGFP转染对细胞增殖的影响,分别计算出静止期G0/G1,增殖期S%,和G2/M
【3】两种方法分离小型猪骨髓间充质干细胞的比较
分别取两组0,1,3代细胞,制成1x103的细胞悬液,接种到96孔板,每孔细胞悬液200微升,置37℃、5%CO2饱和湿度孵箱内孵育,各组每24小时分别取出4孔,每孔加入MTT (2mg/ml)20微升37℃孵育,4h后吸弃孔内培养液,每孔加入150微升分析纯的二甲基亚砜,移至酶联免疫检测仪上振荡10min,用分光光度计在492nm波长处测定每孔的吸光度值(OD492),以OD(492)值为纵坐标,时间为横坐标绘制生长曲线。
【4】人骨髓间充质干细胞体外培养及其生物学特性研究
取不同代数细胞,调整细胞浓度为2x104/ml后,接种于96孔培养板,置37℃,5%CO2,饱和湿度培养箱培养后,用胰酶-EDTA进行消化,用台盼蓝拒染法计数活细胞,每天取12复孔,共7天;根据计数结果绘制细胞生长曲线。
记录测得的结果,即培养潜伏期持续多长时间(12-24h),多长时间进入对数生长期(3天后),对数增殖期持续时间(3-5天),铺满皿底所需时间(5-7天),细胞进入平台期多长时间及持续多长时间,停止生长时间。
【5】来自;山羊骨髓间充质干细胞体外分离与培养,
选择P1,P5,P9(即早、中、晚三代)作生长曲线,进行观察,记录各自的潜伏期,对数生长期,平台期
山羊BMSC原代培养生长曲线绘制。
山羊BMSC P1、P5、P9代生长曲线。
【6】来自:胎猪骨髓间充质干细胞核移植及核移植胚胎干细胞的分离
将传至第4代生长旺盛pFMSCs(porcine fetal mesenchymal stem cells)细胞用0.25%胰酶+0.04%EDTA(称取胰蛋白酶0.5g和EDTA0.08g,溶入200mlPBS中,常温磁力搅拌器搅拌直至彻底溶解,用0.22μm孔径的滤膜过滤,无菌条件分装成小瓶(4ml/瓶),-20℃冻存)消化3-5min,培养液中和,吹打成单个细胞,调整细胞浓度为2x104个/ml,接种在两个12孔细胞培养板中,每孔接种1ml,再补加培养液1ml,混匀。
38.5℃,5%CO2,饱和湿度的条件下培养。
常规换液。
每24h用0.25%胰酶+0.04%EDTA消化液消化3孔细胞,细胞计数板计算每孔细胞总数,每孔记2次,取平均值。
细胞接种当天记为第0天,连续测定8天。
以时间(d)为横坐标,每天测定3孔细胞数的平均值为纵坐标,绘制生长曲线。
胎猪骨髓间充质干细胞周期化处理:血清饥饿处理(当细胞生长到80%汇合时,将血清浓度由10%降成0.5%,继续培养2-4天;或者是利用接触抑制处理(当细胞生长至80%汇合时,继续使用含10%NBS的DMEM培养液培养2-3天。
将上述处理的细胞常规消化离心,PBS重悬细胞,按每管106细胞分装于10ml离心管,离心,0.5mlPBS重悬细胞,边振荡边缓慢加入3ml预冷的75%乙醇,4℃过夜固定12h以上,离心去除乙醇,用含1%NBS 的PBS重悬细胞,离心洗涤2遍,200μlPBS重悬细胞,加入0.8mg/mlRNase 1ml,37℃,30min.离心,200微升PBS重悬细胞。
加入含有100μg/mlPI0.1%X-100的PBS 1ml,室温下作用10-15min,100目滤沙过滤,上机检测。
进行流式细胞仪检测。
【7】来自:猪骨髓间充质干细胞分离培养及其核移植胚胎发育潜能研究
生长曲线测定:取第3代MSCs细胞,以每孔5.0x104个/ml接种到24孔培养板内。
在37.5℃,5%CO2培养箱中培养,每天取2孔,连续7天,采用血球计数板计数法计算每孔的细胞数,取平均值,即细胞数/毫升原液=(5个大方格细胞数之和/5)x104.
绘制生长曲线,重复实验3次。
贴壁率曲线的测定:取pMSCs第3代细胞,以每瓶5x104个/cm2密度接种到12个25ml培养瓶内培养,每2h取2瓶,倒掉培养液(未含贴壁细胞),0.25%胰蛋白酶消化贴壁细胞并计数,计数贴壁率,绘制贴壁率曲线。
计算公式:贴壁率(%)=贴壁存活细胞数/接种细胞数x100%
分裂指数测定:用0.25%胰蛋白酶消化第3代细胞,以1x104个/cm2密度接种铺有盖玻片的6孔培养板中37℃、5%CO2培养箱中培养,每隔24h取出观察一次,PBS 清洗三遍后,95%乙醇固定10min,PBS清洗三遍,置于5μg/ml DAPI内染色10min,PBS清洗后,滴加甘油油滴,封片后在荧光显微镜下观察,同倍镜下取5个不同视野,计数分裂相细胞,取平均值。
连续7天,以时间(天)为横坐标,细胞分裂相的千分率(%)为纵坐标,绘制分裂指数曲线图。
【8】来自:两种培养方法在猪自体骨髓间充质干细胞培养的比较研究
直接贴壁培养法原代培养时受红细胞影响容易失败,且培养时潜伏期较长,一般为11-13天,15-17天进入对数增长期,20天左右进入生长平台期。
密度梯度离心结合直接贴壁法培养原代细胞较单纯直接贴壁法培养潜伏期较短,一般为7-9天,11-15天进入对数生长期,17天左右进入生长平台期。
【9】来自:猪骨髓间充质干细胞的分离培养及核移植后重构胚胎发育能力的研究生长曲线:取pMSCs和PF第3代细胞,分别以每孔密度5x104和6.5x104接种到24孔培养板内,上述条件培养,每天取3孔,连续7天,采用血球计数板计数法计数每孔的细胞数,计算公式:细胞数/毫升原液=(5大格细胞数之和/5)x104,绘制生长曲线。
pMSCs贴壁率曲线的测定:取pMSCs第3代细胞,以每瓶5x104密度接种到12个25ml 培养瓶内培养,每2h取2瓶,倒掉培养液(含有未贴壁细胞),0.25%胰蛋白酶消化贴壁细胞并计数,计算贴壁率。
计算公式:贴壁率(%)=贴壁存活细胞数/接种细胞数x100%.绘制贴壁率曲线。
PMSCs分裂指数测定:用0.25%胰蛋白酶消化第3代细胞,以1x104密度接种铺有盖玻片的6孔培养板中37℃,5%CO2培养箱中培养,每隔24h取出观察一次,PBS 三遍后,95%乙醇固定10min,PBS清洗三遍,置于5μg/mlDAPI内染色10min,PBS 清洗后,盖在滴有甘油的载玻片上,封片后在荧光显微镜下观察,同倍镜下取5个不同视野,计数分裂相细胞,取平均值。
连续7天,以时间(天)为横坐标,细胞分裂相的千分率(‰)为纵坐标,绘制分裂指数曲线图。
【10】,来自:猪骨髓间充质干细胞培养参考
【10】来自:SD大鼠骨髓间充质干细胞体外分离培养的实验研究
大鼠MSCs生长曲线测定:为了定量测定大鼠BMSCs的生长状况,对来源于同一动物的原代细胞进行连续培养。
分别选取生长良好的P1、P3、P5代BMSCs消化后制备成细胞悬液,调整细胞密度为5x104/ml。
接种到96孔板,每孔接种200μl细胞悬液进行培养(每孔1x104细胞)。
次日起每天选择6个培养孔各自加入MTT溶液(5mg/ml)20μl,37℃继续孵育4h后终止培养,吸出孔内上清,每孔加入150μlDMSO,室温振荡10min,使结晶充分溶解,于试验孔平行设不加细胞只加培养液的空白对照1孔。
在酶标仪上选择570nm波长,以空白孔调零,测定各孔吸光度(A)值,连续测7天,以时间为横轴,A值为纵轴绘制细胞生长曲线。
【11】来自:多耐药基因MOR1逆转录病毒载体的构建及其转染人胎盘源间充质干细胞的研究
生长曲线的绘制及对数生长期倍增时间的测定
取对数生长期细胞,消化计数,用MSC培养基制成细胞悬液(2x104/ml),0.5ml/孔在24孔板中培养。
每天取3复孔,台盼蓝染色计数活细胞数,计算平均值,连续观察6天。
以培养时间为横轴,细胞数为纵轴,绘制细胞生长曲线。
Patterson公式计算细胞在对数生长期倍增时间,即Td=Tlg2/Lg(Nt/N0),Td:倍增时间(h);T:细胞由N0增至Nt所用的时间(h),N:细胞数。