高三化学一轮复习:《原电池的原理及应用》课件
- 格式:ppt
- 大小:3.22 MB
- 文档页数:35



2025年高考化学一轮复习基础知识讲义—原电池的工作原理及应用(新高考通用)【知识模型】1、原电池的概念及构成条件(1)定义:将化学能转化为电能的装置。
(太阳能电池:将太阳能转化为电能)(2)原电池的形成条件①能自发进行的氧化还原反应。
②两个活泼性不同的电极(燃料电池的两个电极可以相同)。
③形成闭合回路,需满足三个条件:a.存在电解质;b.两电极直接或间接接触;c.两电极插入电解质溶液或熔融电解质中。
2、工作原理(以锌铜原电池为例)(1)装置变迁名称单液原电池双液原电池装置相同点电极名称负极:锌片正极:铜片电极反应负极:Zn-2e-===Zn2+(氧化反应) 正极:Cu2++2e-===Cu (还原反应) 总反应Zn+Cu2+===Zn2++Cu电子流向电子由负极(锌片)经导线流向正极(铜片)电流流向电流由正极(铜片)经导线流向负极(锌片)不同离子迁移方向电解质溶液中,阴离子向负极(锌片)迁移,阳离子向正极(铜片)迁移Cu2+移向正极,SO42-移向负极盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极①盐桥的成分:盐桥通常是装有饱和KCl或者NH4NO3琼脂溶胶的U形管,溶液不致流出来,但离子则可以在其中自由移动②盐桥的作用有三种:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流;c.隔绝正负极反应物,避免直接接触,导致电流不稳定,提高电池效率。
③盐桥中离子移向:阴离子移向负极,阳离子移向正极。
④无论是单液原电池装置还是双液原电池装置,电子均不能通过电解质溶液(离子走水,电子走线)3、原电池电极判断4(1)加快氧化还原反应的速率:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率(2)比较金属活动性的强弱:原电池中,负极一般是活动性较强的金属,正极一般是活动性较弱的金属(或非金属)方法:电极质量减少作负极,较活泼;有气体生成、电极质量不断增加或不变作正极,较不活泼(3)设计制作化学电源①拆分反应:将氧化还原反应分成两个半反应②选择电极材料:电极材料必须导电。



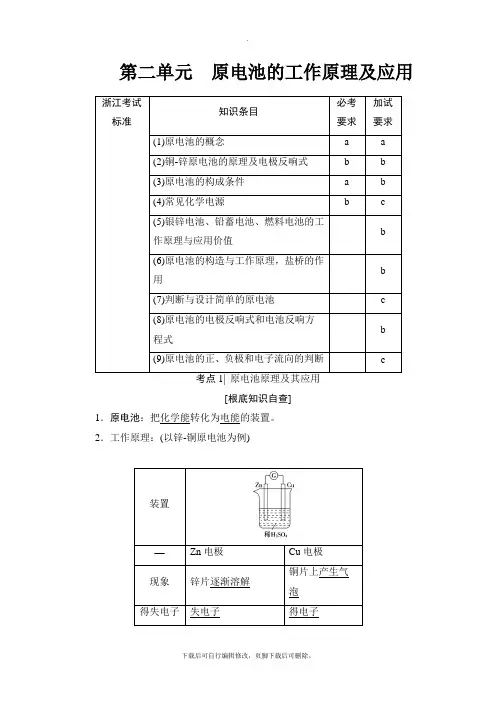
第二单元原电池的工作原理及应用浙江考试标准知识条目必考要求加试要求(1)原电池的概念 a a(2)铜-锌原电池的原理及电极反响式 b b(3)原电池的构成条件 a b(4)常见化学电源 b c(5)银锌电池、铅蓄电池、燃料电池的工作原理与应用价值b (6)原电池的构造与工作原理,盐桥的作用b(7)判断与设计简单的原电池 c(8)原电池的电极反响式和电池反响方程式b (9)原电池的正、负极和电子流向的判断 c考点1| 原电池原理及其应用[根底知识自查]1.原电池:把化学能转化为电能的装置。
2.工作原理:(以锌-铜原电池为例)装置—Zn电极Cu电极现象锌片逐渐溶解铜片上产生气泡得失电子失电子得电子正、负极判断负极正极电子流向流出流入电极反响式Zn-2e-===Zn2+2H++2e-===H2↑总反响式Zn+2H+===Zn2++H2↑3.构成条件4.盐桥电池的构造与工作原理(加试要求)(1)构造盐桥中通常装有含KCl饱和溶液的琼脂。
随着反响的进展,Zn棒中的Zn 原子失去电子成为Zn2+进入溶液中,使ZnSO4溶液中Zn2+过多,带正电荷;Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO2-4过多,溶液带负电荷。
当溶液不能保持电中性时,将阻止放电作用的继续进展,盐桥的存在就防止了这种情况的发生;其中Cl-向ZnSO4溶液中迁移,K+向CuSO4溶液中迁移,分别中和过剩的电荷,使溶液保持电中性,反响可以继续进展。
(2)盐桥电池的构成特点①一般情况下,金属插入其可溶性盐溶液中,组成负极和正极。
②为使溶液保持电中性,盐桥中离子的定向迁移构成了电流通路。
③盐桥电池的两个电极材料可以不同,也可以一样,但环境绝对不同。
(3)盐桥的作用①使整个装置构成闭合回路,代替两溶液直接接触。
②平衡电荷。
通过盐桥中阴阳离子定向移动而使两极电解质溶液中正负电荷守恒而保持电中性。
③将两个半电池完全隔开,有利于将化学能最大限度地转化为电能。
