考点互动探究
(8)若位于短周期,同一周期的第ⅠA族元素、第ⅢA族元素的原子序 数相差2,即乙的原子序数为x+2;若元素在第四、五周期,同一周期的 第ⅠA族元素、第ⅢA族元素的原子序数相差12,即乙的原子序数为x +12;若元素在第六、七周期,存在镧系和锕系,同一周期的第ⅠA族元 素、第ⅢA族元素的原子序数相差26,即乙的原子序数为x+26。
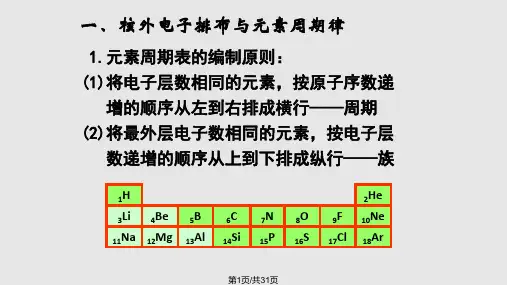
C.元素周期表中第一、二、三周期为短
周期 D.元素周期表中第ⅠA族全部是金属元 素
短周期,C项正确;元素周
期表中第ⅠA族中H是非 金属元素,D项错误。
考点互动探究
2.X和Y均为短周期元素,已知aXn- [答案] B 比 [解析] aX+ne-→Xn-,aXn-与aX电子 m+ bY 多两个电子层,则下列说法 层数相等; Y-me-→Ym+, Ym+比 Y少
主族序数 (O、F除
-(8-主族序数)
减 金属性逐渐 弱 增 非金属性逐渐 强
增 金属性逐渐 强 减 非金属性逐渐 弱
考点互动探究
题组训练
项目 同周期(左→右)(第一周期除外)
(续表) 增 强 减 弱 减 阳离子氧化性逐渐 弱 阴离子还原性逐渐 增 强 减 逐渐 弱 增 碱性逐渐 强 减 酸性逐渐 弱
A.B、D的原子序数之
图5-20-2 B.E、B的原子序数之差可能是 8、18
是第一周期元素,则D一定属
于元素周期表最左边的第Ⅰ A族元素或最右边的0族元素), A项错误;由题意可知5种元素 在前四周期,所以D、B、E分 别为第二、三、四周期的元 素,
考点互动探究
2.在元素周期表中的前四周期,两
两相邻的5种元素如图5-20-2 所 示,若B元素的核电荷数为a。 下列说法正确的是( 差可能为2 图5-20-2 B.E、B的原子序数之差可能是 8、 18或32 C.5种元素的核电荷数之和为5a+ 10 D.A、E的原子序数之差可能是7 ) A.B、D的原子序数之 由元素周期表的结构可知5种 元素一定在过渡元素右边,所 以D、E的原子序数分别为a8、a+18,A、C的原子序数分 别为a-1、a+1,即只有C项正