动物脾脏单个核细胞分离液试剂盒使用说明
- 格式:pdf
- 大小:107.06 KB
- 文档页数:4

脾脏单个核细胞的制备脾脏单个核细胞的制备: 将5 只小鼠断颈椎处死, 无菌取出脾脏, 分别剪碎, 置200 目无菌尼龙网上, 分次滴入4~ 5 ml RPMI1640 培养液, 轻轻研磨脾脏, 直到脾脏变白;收集细胞悬液( 由于红细胞所占比例很低且对实验影响不大, 故无需作红细胞裂解处理) , 1 000 r/ min( 离心半径17. 5 cm) 离心5 min, 弃上清; 加入2 ml pH7. 4 的PBS, 混匀后1 000 r/ min( 离心半径17. 5 cm) 离心5min, 弃上清; 加入4 ml RPMI1640 培养液, 混匀, 用RPMI1640 培养液稀释200 倍后滴加在细胞计数板上进行细胞计数, 根据计数结果用RPMI1640 将细胞悬液调成2 × 10 / 300 µl 的浓度。
《流式细胞术检测小鼠脾细胞内细胞因子刺激方案的筛选》单细胞悬液的制备:将大鼠颈椎脱位处死后, 置70%乙醇中浸泡5 m in, 无菌取出脾脏和胸腺置于平皿中, 除掉结缔组织, 用生理盐水清洗3次。
加入2 mL RPM I- 1640完全培养液, 用剪刀分别将脾和胸腺剪成1 mm 1 mm 1 mm 碎块后, 用毛玻片轻柔研磨组织碎片, 经8层纱布过滤制成单细胞悬液, 经H anks液离心洗涤后, 将细胞悬浮于含10%小牛血清的RPM I- 1640 培养液。
台盼蓝染色, 计数活细胞在95%以上, 调整细胞数至5×10 cells /L。
《粗江蓠多糖对大鼠淋巴细胞周期的影响》610制备脾细胞悬液脾淋巴细胞的获取:手术刀、解剖剪、解剖镊、止血钳等手术器械,300 目尼龙网等须经消毒处理; 以颈椎脱臼法处死小鼠, 用7 5 % 乙醇浸泡小鼠10-15min 。
沿腹腔中线剪开小鼠胸腔, 取出脾脏置于培养皿中, 剪去脂肪和筋膜组织, 用R PMI-1640培养液漂洗。
粗剪成小块, 用注射器芯轻轻挤压, 加人基础培养液, 混悬, 用300目尼龙网过滤到玻璃离心管中, 再加人基础培养液冲洗网上剩余组织细胞。


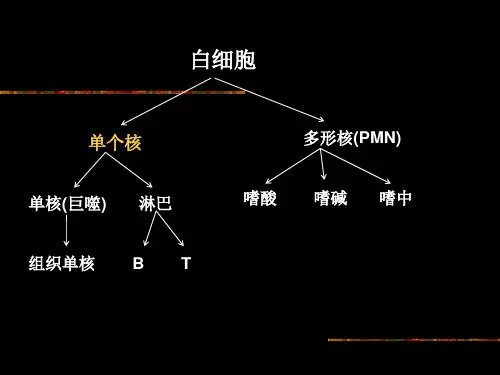

小鼠脾脏单个核细胞分离及细胞计数实验时间:实验地点:实验人:1实验原理小鼠脾脏位于上腹部左后侧,体积较大,长条形,属于外周免疫器官。
外周血中淋巴细胞可经再循环驻如脾脏等外周免疫器官的特定区域,所以富含各类免疫细胞。
免疫细胞的分离:采用红细胞裂解法,是根据细胞对渗透压变化的敏感度。
红细胞由于细胞结构较为简单,仅有细胞膜结构,对于膨胀的耐受能力较差,因此绝大部分就会涨破,受到破坏。
是一种比较温和的去除红细胞最简便易行的方法。
2实验材料:1)健康小鼠2)手术器械(剪刀、镊子)、解剖板3)70%乙醇4)PBS缓冲液、红细胞裂解液(ACK)5)0.2%台盼蓝6)细胞计数板、计数器7)离心机8)显微镜3实验方法:3.1取小鼠脾脏●将小鼠颈椎脱位处死,用酒精消毒。
●用剪刀剪开背部皮肤,再找到脾脏,用镊子夹出脾脏并剪除周围组织。
3.2制备单个核细胞悬液●将取出的脾脏置于盛有3mlPBS缓冲液的平皿中,然后再置于尼龙指套中,用针芯轻轻碾压使得单个核细胞悬浮于平皿中。
●吸取平皿中细胞悬液置于刻度离心管(15ml)中,以1500rpm离心10min,弃去上清液,加入ASK至2-3ml,轻轻吹打混匀并放置2min,以破坏红细胞。
然后加入PBS缓冲液至10ml,以1500rpm离心10min。
●弃去上清液,用PBS缓冲液定容至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
3.3计算细胞浓度稀释十倍,随机选取一个大方格计数细胞计数为324个,计算细胞浓度为324×104×10=3.24×107/ml3.4计算细胞活力在总计为324个细胞中计数,死亡细胞有16个,计算细胞活力为:324-16/324×100%=95.1%在理论范围之内4实验结果4.1研磨脾脏得到细胞悬液本实验中将小鼠的脾脏放入尼龙指套内,置于少量PBS液中缓慢研磨,获得细胞悬液。
实验中,我们发现尼龙指套不能滤去所有结缔组织,操作中会有结为絮状团块的结缔组织。



小鼠脾脏单个核细胞分离及细胞计数实验时间:实验地点:实验人:1实验原理小鼠脾脏位于上腹部左后侧,体积较大,长条形,属于外周免疫器官。
外周血中淋巴细胞可经再循环驻如脾脏等外周免疫器官的特定区域,所以富含各类免疫细胞。
免疫细胞的分离:采用红细胞裂解法,是根据细胞对渗透压变化的敏感度。
红细胞由于细胞结构较为简单,仅有细胞膜结构,对于膨胀的耐受能力较差,因此绝大部分就会涨破,受到破坏。
是一种比较温和的去除红细胞最简便易行的方法。
2实验材料:1)健康小鼠2)手术器械(剪刀、镊子)、解剖板3)70%乙醇4)PBS缓冲液、红细胞裂解液(ACK)5)0.2%台盼蓝6)细胞计数板、计数器7)离心机8)显微镜3实验方法:3.1取小鼠脾脏●将小鼠颈椎脱位处死,用酒精消毒。
●用剪刀剪开背部皮肤,再找到脾脏,用镊子夹出脾脏并剪除周围组织。
3.2制备单个核细胞悬液●将取出的脾脏置于盛有3mlPBS缓冲液的平皿中,然后再置于尼龙指套中,用针芯轻轻碾压使得单个核细胞悬浮于平皿中。
●吸取平皿中细胞悬液置于刻度离心管(15ml)中,以1500rpm离心10min,弃去上清液,加入ASK至2-3ml,轻轻吹打混匀并放置2min,以破坏红细胞。
然后加入PBS缓冲液至10ml,以1500rpm离心10min。
●弃去上清液,用PBS缓冲液定容至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
3.3计算细胞浓度稀释十倍,随机选取一个大方格计数细胞计数为324个,计算细胞浓度为324×104×10=3.24×107/ml3.4计算细胞活力在总计为324个细胞中计数,死亡细胞有16个,计算细胞活力为:324-16/324×100%=95.1%在理论范围之内4实验结果4.1研磨脾脏得到细胞悬液本实验中将小鼠的脾脏放入尼龙指套内,置于少量PBS液中缓慢研磨,获得细胞悬液。
实验中,我们发现尼龙指套不能滤去所有结缔组织,操作中会有结为絮状团块的结缔组织。

小鼠脾脏单个核细胞的分离一、实验目的1. 熟悉细胞分离的基本原理2. 掌握小鼠脾脏单个核细胞的分离的方法3. 掌握流式细胞术检测细胞表面标志的方法二、实验原理1.台盼蓝染色:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内。
丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色。
通常认为细胞膜完整性丧失,即可认为细胞已经死亡。
2.脾是人和脊椎动物最大的淋巴器官。
人的脾脏位于左季肋区的后外侧部,呈卵圆形,脾是血循环中重要的滤过器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。
三、实验材料小鼠手术器械(剪刀、镊子)、酒精喷壶、杀鼠板平皿,尼龙膜指套、研磨棒、吸管、试管、EP管、移液器和tipsPBS缓冲液、红细胞裂解液(ACK)细胞计数板0.2%台盼蓝染液8.显微镜四、实验步骤(一)取小鼠脾脏1.小鼠颈椎脱位处死——用拇指和食指往下按住鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离。
2.取其后右侧卧位,消毒左侧背腹交界处皮肤,剪取脾脏并尽量将去除脂肪及筋膜组织。
(二)制备单个核细胞悬液:1.将脾脏置于盛有5mLPBS缓冲液的平皿中,然后再置于尼龙指套中。
用针芯轻轻碾磨使单个核细胞通过尼龙指套悬浮于平皿中;2.吸取平皿中细胞悬液(再次用尼龙指套过滤)置于刻度离心管中,加PBS缓冲液(可冲洗培养皿)至10mL,以1500rpm离心5min。
弃去上清,弹散细胞沉淀,加ACK2ml,轻轻吹打混匀并放置3-4min,以破坏红细胞。
然后加PBS缓冲液至10ml,以1500rpm离心5min;3.弃去上清,弹散细胞沉淀,加PBS缓冲液至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
(放置冰上)4.取100uL至EP管中,进行计数和活力测定(建议5倍稀释)5.以1500rpm离心5min,根据计数结果稀释到合适的浓度a)注:减少操作的时间,并放置冰上或低温离心机里以保证细胞活力(三)计算细胞浓度1.将上述细胞悬液做一定倍数的稀释;(建议5倍稀释)。

脾脏单个核细胞的制备: 将5 只小鼠断颈椎处死, 无菌取出脾脏, 分别剪碎, 置200 目无菌尼龙网上, 分次滴入4~ 5 ml RP MI1640 培养液, 轻轻研磨脾脏, 直到脾脏变白; 收集细胞悬液( 由于红细胞所占比例很低且对实验影响不大, 故无需作红细胞裂解处理) , 1 000 r/ min( 离心半径17. 5 cm) 离心5 min, 弃上清; 加入2 ml pH7. 4 的PBS, 混匀后1 000 r/ min( 离心半径17. 5 cm) 离心5min, 弃上清; 加入4 ml RPMI1640 培养液, 混匀, 用RPMI1640 培养液稀释200 倍后滴加在细胞计数板上进行细胞计数, 根据计数结果用RPMI1640 将细胞悬液调成2 × 106 / 300 µl 的浓度。
《流式细胞术检测小鼠脾细胞内细胞因子刺激方案的筛选》单细胞悬液的制备:将大鼠颈椎脱位处死后, 置70%乙醇中浸泡5 m in, 无菌取出脾脏和胸腺置于平皿中, 除掉结缔组织, 用生理盐水清洗3次。
加入2 mL RPM I- 1640完全培养液, 用剪刀分别将脾和胸腺剪成1 mm 1 mm 1 mm 碎块后, 用毛玻片轻柔研磨组织碎片, 经8层纱布过滤制成单细胞悬液, 经H anks液离心洗涤后, 将细胞悬浮于含10% 小牛血清的RPM I- 1640 培养液。
台盼蓝染色, 计数活细胞在95%以上, 调整细胞数至5×1010 cells /L。
《粗江蓠多糖对大鼠淋巴细胞周期的影响》制备脾细胞悬液脾淋巴细胞的获取:手术刀、解剖剪、解剖镊、止血钳等手术器械,300 目尼龙网等须经消毒处理; 以颈椎脱臼法处死小鼠, 用7 5 % 乙醇浸泡小鼠10-15min 。
沿腹腔中线剪开小鼠胸腔, 取出脾脏置于培养皿中, 剪去脂肪和筋膜组织, 用R PMI-1640培养液漂洗。
粗剪成小块, 用注射器芯轻轻挤压, 加人基础培养液, 混悬, 用300目尼龙网过滤到玻璃离心管中, 再加人基础培养液冲洗网上剩余组织细胞。

实验三小鼠脾细胞的分离制备及其活力检测
实验二小鼠脾细胞的分离制备及其
活力检测
材料
1、器材:离心机、手术剪、镊子、平皿、10ml离心管,5ml 注射器等
2、动物:昆明小鼠(25g左右,雄性)
3、试剂:碘伏、红细胞裂解液、Hank’s 液、0.4%台盼兰染液
方法
1、取小鼠一只,置于蜡盘上,颈椎脱臼处死,用碘伏消毒小鼠腹部后,打开腹腔,取出脾,去除周围的结缔组织,放入含有5ml Hank’s的平皿中。
2、用眼科剪将脾一端剪一小口后,将含有5ml Hank’s液的注射器从脾的另一端刺入脾,缓缓注入Hank’s液,即可见脾细胞悬液流入平皿,注意在注射Hank's液同时不断转动针头方向,直至脾变苍白为止。
3、将平皿倾斜静置10 min后,用干净吸管吸取细胞液到10ml 离心管中,平衡后,离心(1500rpm 10min),将
离心管盖子打开,快速弃上清液,往管底的细胞中加入1ml的红细胞裂解液,充分混匀20秒,立即加入9ml的Hank’s液,混匀,离心(1500rpm 10min),弃上清,将细胞定容到1ml。
4、吸取0.1ml的细胞悬液到干净的试管中,加入等量的0.4%台盼兰染液,混匀,吸取1滴的细胞液到玻片上,加上盖片,显微镜观察:死亡细胞染成蓝色,活细胞不染色。
正常情况下,活细胞数应达到95%以上。
免疫细胞使用说明书(V1.0)【适用范围】该产品说明书适用于人和动物PBMC、SMC、CBMC、BMMNCs等单个核细胞和人、小鼠CD3+T、CD4+T、CD8+T、CD19+B、单核、NK细胞等亚型免疫细胞的复苏、保存、使用等过程。
【产品描述】单个核细胞是白细胞中只有一个细胞核的细胞,相对密度在1.076~1.090。
根据其组织来源不同,又可分为外周血单个核细胞(Peripheral Blood Mononuclear Cell,PBMC)、脐带血单个核细胞(Cord Blood Mononuclear Cell,CBMC)、脾脏单个核细胞(Spleen Mononuclear Cell)、骨髓单个核细胞(Bone Marrow Mononuclear Cells,BMMNCs)等。
IPHASE单个核细胞均是由新鲜的组织或器官,利用细胞比重的差异,通过密度梯度离心的方法获得。
免疫细胞(Immune cell),由多种不同类型的细胞组成,包括淋巴细胞、单核细胞、巨噬细胞、树突状细胞、自然杀伤细胞等。
免疫细胞作为免疫系统的重要成员,具有吞噬异物并产生抗体、机体伤病的损伤治愈、抗御病原体入侵等能力,在执行免疫应答和免疫功能方面担负重任。
IPHASE免疫亚型细胞均是通过免疫磁性细胞阴选分选的方法,从新鲜制备的单个核细胞悬液中分选而来。
【包装规格】5×106cells/管1×107cells/管2×107cells/管5×107cells/管【应用方向】可作为大分子药物临床前药代动力学和药效学研究、药物毒性筛选、免疫学研究、疫苗开发以及移植免疫等多个领域研究的原材料。
【合规保障】合规是研究的开始。
按照国家要求,凡涉及到人和猴相关的细胞产品均需办理合规审批流程,只有审批通过,且取得证明文件后才可买卖细胞。
IPHASE/汇智和源分离免疫细胞的组织或器官均由合规渠道获得,来源清晰,免除客户后顾之忧。
动物细胞高纯内质网分离试剂盒产品说明书(中文版)主要用途动物细胞高纯内质网分离试剂是一种旨在通过机械或化学处理、差速和等密度离心方法,从动物细胞中分离出活性完整而高度纯化的内质网细胞器组分的权威而经典的技术方法。
该技术经过精心研制、成功实验证明的。
其制备物产量高,活性保证,纯度可达99%。
适合于各种动物原代和培养细胞(人体、老鼠、兔子等)内质网的制备。
可以被用于细胞色素P450系统外源化合物(xenobiotics)代谢、脂类代谢、内质网膜蛋白和腔内蛋白等研究。
产品不含污染性蛋白酶和核酶,即到即用,性能稳定,分离产量高。
技术背景内质网(endoplasmic reticulum;ER)是真核生物的细胞器组分,构成细胞内小管(tubules)、囊泡(vesicles)和小池(cisternae/sac)相互连接的网络结构,负责蛋白转译、折叠和转运成为细胞膜成分(例如跨膜受体和其它整合膜蛋白等)或分泌型蛋白(例如消化性酶),负责钙离子区隔(sequestration),以及糖原、固醇类和其它大分子的生产和储存等功能。
内质网分成三种:粗面内质网(Rough endoplasmic reticulum;RER)、滑面内质网(Smooth endoplasmic reticulum;SER)和肌质网(sarcoplasmic reticulum;SR)。
根据细胞代谢的需要,粗面内质网和滑面内质网会互相转换。
粗面内质网通过核糖体合成蛋白质并分类;滑面内质网进行固醇、碳水化合物和药物代谢等。
肌质网的主要功能为储存和释放钙离子。
内质网的分离是现代细胞生物学研究的常用手段之一:第一,通过机械或化学方法破裂组织细胞;第二,通过低速差速离心去除残渣碎屑和巨大细胞器;第三,通过高速差速离心获得内质网;甚至,第四,可以通过等密度离心获得纯度更高的内质网。
产品内容清理液(Reagent A)毫升裂解液(Reagent B)毫升净化液(Reagent C)毫升活性液(Reagent D)微升强化液(Reagent E)毫升保存液(Reagent F)毫升高纯液(Reagent G)毫升分层液(Reagent H)毫升产品说明书1份保存方式保存净化液(Reagent C)和活性液(Reagent D)在-20℃冰箱里,其余的保存在4℃冰箱里,有效保证6月用户自备HANK平衡盐缓冲溶液(HL12028)或PBS缓冲溶液(HL12033):用于清理细胞胰蛋白酶乙二胺四乙酸混合液(HL12024):用于细胞脱离完全细胞培养液(HL12052):用于细胞处理所需的培养基50毫升锥形离心管:用于样品制备的容器15毫升锥形离心管:用于样品制备的容器1.5毫升离心管:用于样品操作的容器6毫升超速离心管:用于超高速离心的容器4℃台式离心机:用于样品制备4℃超速离心机:用于样品制备DOUNCE匀浆器:用于裂解组织试管固定支架:用于离心管固定支撑3号针筒和18号针头:用于收集样品实验步骤一、组织匀浆法实验开始前,将试剂盒里的净化液(Reagent C)和活性液(Reagent D)冻融,然后移出移取xx微升活性液(Reagent D)、xx毫升净化液(Reagent C)到xx毫升的裂解液(Reagent B)里,混匀后,置入冰槽里,标记为裂解工作液。
小鼠骨髓中性粒细胞分离液试剂盒使用说明货号:P8550规格:200mL/kit保存:18℃-25℃保存,有效期两年。
小鼠骨髓中性粒细胞分离液试剂盒易感染细菌,需无菌条件下操作。
无菌条件下操作,启封后常温保存。
如4℃保存,本分离液易出现白色结晶,影响分离效果。
试剂盒内容:试剂A200mL试剂F(赠品)200mL样本稀释液(赠品)200mL清洗液(赠品)200mL红细胞裂解液(赠品)100mL说明书1份操作步骤:1.首先制备骨髓单细胞悬液。
2.取一支15mL离心管,小心加入试剂A。
3.用吸管小心吸取血液样本加于分离液之液面之上,400-550g,离心20-30min(注:如改变血液样本及分离液用量,需相应调整离心力及离心时间,具体离心条件需客户自行摸索,以达到最佳分离效果。
)4.离心后,离心管中将出现两层环状乳白色细胞层,上层为单个核细胞,下层细胞为中性粒细胞。
5.用吸管小心吸取分离液中的中性粒细胞层,如有红细胞混杂则加入适量的红细胞裂解液,将红细胞裂解,即得目的细胞。
6.将获得的细胞层移至另一15mL离心管中,向所得离心管中加入10mL清洗液,混匀细胞。
7.250g,离心10min。
8.弃上清。
9.用5mL清洗液重悬所得细胞。
10.250g,离心10min。
11.重复8、9、10,弃上清后以0.5mL后续实验所需相应液体重悬细胞。
注意事项:1.全程过程样本、试剂及实验环境均需要在20℃±2℃的条件下进行。
为获得最佳的实验结果,最好在取血后2h内进行实验。
2.本实验最好不使用高聚合材质(如聚苯乙烯)的塑料制品,应使用无静电、低静电离心管及未经碱处理后的玻璃制品,因为静电作用会导致细胞贴壁、碱处理的玻璃表面会变成毛面,影响细胞分离效果。
3.分离液用量大于骨髓单细胞悬液样本量时,分离效果更佳。
动物脾脏NK细胞分离液货号:P9310规格:5×200ml/Kit名称规格试剂B200ml试剂D200ml试剂F200ml样本稀释液200ml清洗液200ml保质期:18-25℃保存,有效期2年。
本品易感染细菌,需无菌条件操作。
无菌条件下操作,启封后置常温保存。
如4℃保存,本分离液易出现白色结晶,影响分离效果。
操作步骤:全过程样本、试剂及实验环境均需在20±2℃的条件下进行。
1.首先制备脾脏组织单细胞悬液。
2.取一支15ml离心管,依次小心加入试剂B、试剂D(体积比为3:2,试剂总量与稀释后的样本量相等。
如脾脏组织单细胞悬液为5ml,则先后加入试剂B3ml、试剂D2ml),制成梯度界面,各液面分层一定要清晰。
3.用吸管小心吸取脾脏组织悬液样本加于分离液液面上,400-500g,离心20-30min(注:根据单细胞悬液样本量确定离心条件,脾脏组织单细胞悬液样本量越多,离心力越大,离心时间越长,具体离心条件需客户自行摸索,以达到最佳分离效果)。
4.离心后,此时离心管中由上至下分为五层。
第一层为稀释液层。
第二层为试剂D层。
第三层为环状乳白色目的细胞层。
第四层为试剂B层。
第五层为红细胞层。
5.用吸管小心吸取第二层试剂D层和第三层环状乳白色细胞层到另一15ml离心管中,往所得离心管中加入10ml清洗液,混匀细胞。
第1页,共2页6.250g,离心10min。
7.弃上清。
8.用吸管以5ml清洗液重悬所得细胞。
9.250g,离心10min。
10.重复7、8、9,弃上清后以0.5ml后续实验所需相应液体重悬细胞。
11.差异贴壁法纯化细胞(1)用NK细胞无血清培养基或NK细胞完全培养基以1.5-3×106个/ml的密度重悬细胞,将细胞铺于一次性细胞板或细胞瓶中,放于37℃二氧化碳培养箱中进行贴壁培养。
(2)2-4小时内贴壁的为巨噬细胞前体(俗称为单核细胞)。
(3)10-24小时内贴壁的单个核细胞为内皮、内皮祖细胞、干细胞。
动物脾脏单个核细胞分离液试剂盒使用说明
规格:3×200mL/kit
保存:动物脾脏单个核细胞分离液试剂盒对光敏感,应该室温避光储存,保质期2年。
无菌开封后,保存于室温。
组成:
各种动物脾脏单个核细胞分离液200mL
全血及组织稀释液200mL
细胞洗涤液200mL
单个核细胞分离方法
1.制备脾脏的单细胞悬液。
2.取一支适当的离心管,加入与脾脏单细胞悬液等量的分离液(分离液最少不得少于3mL,
总体积不能超过离心管的三分之二,否则会影响分离效果)。
3.小心吸取单细胞悬液加于分离液液面上,注意保持两液面界面清晰。
(可以使用巴氏德
吸管吸取单细胞悬液,然后小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。
)
4.室温,500~900g,离心20~30min。
(根据脾脏单细胞悬液的量确定离心条件,单细胞悬
液量越大,离心力越大,离心时间越长,具体离心条件可以自行摸索,以达到最佳分离效果)。
5.离心后,此时离心管中由上至下细胞分四层。
第一层为稀释液层;第二层为环状乳白色
单个核细胞层;第三层为透明分离液层;第四层为红细胞层。
6.用吸管小心吸取第二层环状乳白色单个核细胞层至另一洁净的15mL离心管中,向离心管
中加入10ml细胞洗涤液洗涤白膜层细胞,250g,离心10min。
7.弃上清,5mL的PBS或细胞清洗液重悬细胞,250g,离心10min。
8.重复步骤7
9.弃上清,细胞重悬备用。
分层示意图
脾脏单细胞悬液的制备方法
脾脏研磨的方法:
1.无菌条件下摘取脾脏,撕去脾脏被膜,用眼科剪将脾脏剪成小块。
2.将尼龙筛网或者是细胞过滤筛放置于平皿上,加入少量全血及组织稀释液(保证脾脏及
获得的细胞处于液体环境中)。
3.将脾脏放置于筛网上,使用注射器活塞或者是无菌镊子来研磨脾脏(尽量控制研磨力度,
保持筛网悬空,避免在皿底上直接研磨而造成大批细胞死亡)
4.研磨完全后使用全血及组织稀释液冲洗筛网,收集细胞悬液,再经滤网过滤。
注:
A.可用酶消化法,使用胶原酶对脾脏组织进行消化,得到单细胞悬液。
B.如果最终得到的细胞需要培养,那全过程所需试剂与器材均要求无菌。
C.根据脾脏的体积控制单细胞悬液的浓度在108~109个/mL。
注意事项:
A.开封前颠倒混匀,本分离液为无菌产品,为延长分离液保存时间,请在无菌条件下启封,
避免微生物污染。
B.分离液使用时应始终保持室温(18℃~25℃),如室内温度较低,可将分离液预热。
4℃
或者是温度较低的条件下离心,可能会导致白膜层中红细胞污染加重。
C.待分离的组织要求新鲜,避免冷冻和冷藏。
D.部分塑料制品(如聚苯乙烯)因其带有的静电作用,可能会导致细胞挂壁影响分离效果。
E.如果要进一步对分离的细胞进行培养,那在制备单细胞悬液和分离过程中,注意无菌操
作,避免微生物污染。
参考文献:
1.Boyum A.Separation of leucocytes from blood and bone marrow.Scand J Clin Lab
Invest Suppl.1968;97:7.
2.Ting A,Morris PJ.A technique for lymphocyte preparation from stored
heparinized blood.Vox Sang.1971Jun;20(6):561-3.
3.Boyum A.Separation of Blood Leucocytes,Granulocytes and Lymphocytes Tissue
Antigens.1974;4(4):269-74.
4.Weisbart RH,Webb WF,Bluestone R,Goldberg LS.
A simplified method for lymphocyte separation.Vox Sang.1972;23(5):
478-80.
相关试剂:
200目细胞过滤筛YA0949
200目尼龙筛网YA0961
全血及组织稀释液R1017
一次性巴氏德吸管YA0902
细胞洗涤液R1018
各种其他动物及其他细胞的分离液及试剂盒。