氮族元素
- 格式:doc
- 大小:1.21 MB
- 文档页数:14

氮族元素氮族元素氮族元素是指元素周期表中第15族的元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和钋(Bi)。
这些元素都具有一些相似的化学性质和电子结构特征。
在自然界中,氮族元素广泛存在于岩石、土壤、空气、生物体等不同环境中,并且在地球上具有重要的地球化学循环。
首先,我们来了解一下氮。
氮是地球上气体态元素的主要成分之一,占据了近地表大气的78%左右。
它属于非金属元素,具有两个共价键,通常以N2的形式存在。
氮气是一种非常稳定和惰性的分子,这使它在常温常压下不易与其他元素或化合物反应。
因此,人们通常称氮气为惰性气体。
此外,氮还是生物体中许多重要化合物,如氨基酸、蛋白质和核酸的组成部分。
接下来是磷。
磷是一种非金属元素,其化学性质相对活泼。
它在地球上的存在主要以磷酸盐的形式,广泛分布于矿石、岩石、土壤和水体中。
磷是生命体中重要的元素之一,是细胞核酸和蛋白质的组成部分,同时也在能量代谢和骨骼形成中起着重要的作用。
然后是砷。
砷是一种半金属元素,具有金属和非金属元素的一些特性。
它在地壳中以砷化物的形式存在,砷酸盐也是一种常见的矿石。
砷具有较强的毒性,对人类和其他生物有害。
然而,它在医药和农业领域中的一些化合物也有一定的用途。
接下来是锑。
锑是一种典型的金属元素,具有良好的导电性和热导性。
它在地壳中主要以硫化锑的形式存在。
锑的化合物在冶金、制造电池和半导体器件等方面有广泛应用。
最后是钋。
钋是一种放射性元素,也是自然界中含量极稀少的元素之一、它主要以铋矿石中的放射性钋-210的形式存在。
钋的放射性衰变产物被广泛用于科学研究和医学诊断等领域。
氮族元素在自然界中的存在和它们的化学特性对地球的生态平衡和人类的生活都具有重要影响。
例如,氮是生命体中蛋白质和核酸的组成部分,它是植物生长所必需的。
磷则在植物的能量代谢和骨骼形成中扮演着重要角色。
此外,氮和磷也是水体富营养化的主要原因之一、砷和锑的毒性对环境和人类健康构成了一定的威胁,因此对于它们的环境污染和诊断治疗的研究非常重要。



氮族元素氮族元素氮族元素指的是元素周期表第15族元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)等五个元素。
这些元素具有共同的特点和相似的性质,下面将逐一介绍它们的性质和应用。
首先是氮(N)元素,它是地壳中含量最丰富的元素之一,占据空气中78%的体积比例。
氮气是一种无色无味的气体,不可燃不支持燃烧。
它在自然界中主要以氮气(N2)的形式存在,但不能直接被生物利用,大部分生物体需要通过固氮作用将氮气转化为可利用的氨氮或硝态氮。
氮还是DNA和蛋白质等生物分子的组成元素,对维持生命活动有着重要的作用。
磷(P)元素是地壳中丰度较低的元素之一,主要以磷酸盐的形式存在于天然界中。
磷是生物体中的重要元素,是DNA、RNA和ATP等能量分子中的组成部分,对维持生物体的新陈代谢和生长发育起到重要作用。
此外,磷还是农业和工业中的重要原料,广泛应用于生产肥料、洗涤剂、防火剂等。
砷(As)元素是地壳中的稀有元素,存在于矿石、土壤和地下水等环境中。
砷是一种有毒的元素,对大多数生物有害,但也有一些微生物和植物能够耐受砷的毒性。
砷及其化合物在医学和农业上有一定的应用,比如用于治疗白血病和癫痫病等疾病,以及作为杀菌剂和杀虫剂使用。
锑(Sb)元素是一种具有金属和非金属特性的元素,它存在于矿石中,主要由锑矿石中提取得到。
锑有很高的导电性和热导性,在电子工业中得到了广泛应用,例如用于制备电子器件、半导体材料和光学仪器等。
此外,锑化合物还可以用作催化剂和防腐剂。
铋(Bi)元素是一种稀有的金属元素,地壳中含量较低。
铋的熔点非常低,是所有金属中最低的,因此被广泛应用于制备低熔点合金和制备火花塞等。
铋化合物也具有一些特殊的性质,在医学和化工领域中有一定的应用,例如用于制备妇科用药和染料等。
总的来说,氮族元素包括氮、磷、砷、锑和铋等,它们在自然界和人类社会中都具有重要的地位和广泛的应用。
这些元素既是生物体的重要组成元素,也是工业生产和科学研究中的重要原料和催化剂。




高中知识点规律大全《氮族元素》氮族元素是元素周期表中第15族的元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
氮族元素具有共同的电子配置ns2np3,其中n 代表主量子数。
1.氮(N):-原子序数:7- 原子半径:65 pm- 密度:1.25 g/cm³-熔点:-210.1°C-沸点:-195.8°C氮是一种无色、无味、无毒的气体,在常温下存在于大气中。
它是空气中的主要成分,占据了78%的体积比例。
氮具有高度的化学稳定性,因此在自然界中很少以单质形式存在。
氮气可以通过固体氨的热分解或通过空气经过液氮的冷却得到。
氮与氢可以形成氨气(NH3),它是一种无色气体,具有强烈的刺激性气味。
氨气是一种重要的化学试剂,广泛用于农业和工业生产中。
氮还可以与氧形成氮氧化物(NOx),它们是空气污染的主要成分之一2.磷(P):-原子序数:15- 原子半径:100 pm- 密度:1.82 g/cm³-熔点:44.1°C-沸点:280.5°C磷是一种多态元素,有黑磷、红磷和白磷等多种形式。
白磷是最常见和最活泼的形式,它是一种蜡状固体,具有强烈的气味。
白磷在空气中容易燃烧,产生白烟和脱氧酸气。
红磷是一种比较稳定的形态,它不易燃烧。
磷是生物体中的关键元素之一,它在骨骼和牙齿的形成中起着重要作用。
磷还是DNA、RNA和ATP等核酸和能量储存分子的组成成分。
3.砷(As):-原子序数:33- 原子半径:119 pm- 密度:5.776 g/cm³-熔点:817.0°C-沸点:613.0°C砷是一种灰色金属,常形成硫化物矿物,如砷矿。
纯砷以三价形式存在,它具有金属和非金属两类性质。
砷的化合物有毒,并且对人体和环境有害。
砷化氢是一种无色气体,具有强烈的臭酸味。
4.锑(Sb):-原子序数:51-原子质量:121.760- 原子半径:140 pm- 密度:6.687 g/cm³-熔点:630.63°C-沸点:1587°C锑是一种蓝白色的金属,具有良好的导电性和导热性。

元素化学知识总结(6)—氮族元素1.氮和磷[氮族元素]包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第V A族,其代表元素为氮和磷.[氮族元素的原子结构](1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属.[氮气](1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N2 78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3N2 +3H22NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与O2化合生成NO:N2 + O22NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;③在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.性质的比较](1)电闪雷鸣时:N2+O22NO(2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.[光化学烟雾]NO、NO2有毒,是大气的污染物.空气中的NO、NO2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾.因此,NO2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡.[磷](1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿石中.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里(2)单质磷的化学性质:①与O2反应:4P+5O22P2O5②磷在C12中燃烧:2P+3C12(不足量) 2PCl32P+5Cl2(足量) 2PCl5明它们都是由磷元素形成的单质白磷红磷证——[五氧化二磷、磷酸](1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的干燥剂).P 2O 5是酸性氧化物,与水反应:P 2O 5+3H 2O 2H 3PO 4(2)磷酸的性质、用途:磷酸(H 3PO 4)是一种中等强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织等工业.游离态和化合态 只有化合态N 2+O 22NO(易)4P+5O 22P 2O 5(难)N 2 +3H 22NH 3 2P(蒸汽) + 3H 22PH 32.铵盐 [氨](1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH 3的电子式为,结构式为,氨分子的结构为三角锥形,N 原子位于锥顶,三个H 原子位于锥底,键角107°18′,是极性分子. (3)氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH 3分子与H 2O 分子结合成NH 3·H 2O(叫一水合氨).NH 3·H 2O 4+和OH -: NH 3 + H 23·H 2NH 4++ OH -a .氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH 3·H 2O 不稳定,故加热氨水时有氨气逸出:NH 4++ OH -NH 3↑+ H 2Ob .氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH 3、NH 3·H 2O 、H 2O)和3种离子(NH 4+和OH -、极少量的H +).c .氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d .有关氨水浓度的计算:氨水虽然大部分以NH 3·H 2O 形式存在,但计算时仍以NH 3作溶质. ②跟氯化氢气体的反应:NH 3 + HCl = NH 4C1说明 a .当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH 3与盐酸挥发出来的HCl 化合生成的NH 4C1晶体小颗粒.b .氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c .氨气与不挥发性酸(如H 2SO 4、H 3PO 4等)反应时,无白烟生成. ③跟氧气反应: 4NH 3 + 5O 24NO + 6H 2O说明 这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一. (4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂. [铵盐]铵盐是由铵离子(NH 4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水. (1)铵盐的化学性质:①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:a .组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。
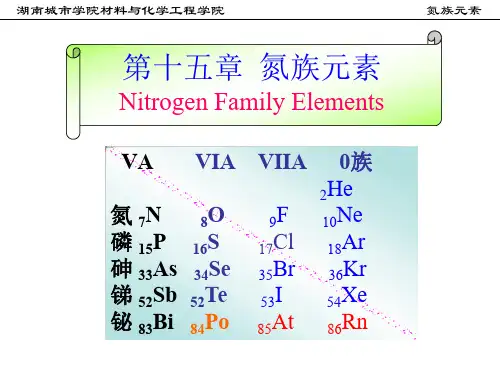
氮族元素概述王振山一、氮族元素通性周期系ⅤA族包括N、P、As、Sb、Bi五种元素称为氮族元素。
氮在地壳中的丰度为0.0046%,氮主要以单质存在于大气中;磷在地壳中的丰度为0.118%,磷主要以磷酸盐形式分布在地壳中;砷、锑、铋是亲硫元素,它们在自然界中主要以硫化物1、原子结构与氧化数⑵、氧化态:①、有获得3个电子成为-3氧化态而达到稀有气体结构的趋势,但要完全夺得3个电子成为-3价离子则困难,只有电负性较大的N和P在个别化合物中能成为-3价离子,如Li3N,Mg3N2,Na3P,Ca3P2等,但只能存在于干态,因N3-,P3-离子半径大,变形性强,遇水会强烈水解生成NH3和PH3。
本族元素与电负性较小的元素化合时,可形成-3氧化态的共价化合物。
②、本族元素与电负性较大元素化合时,主要形成氧化数为+3或+5的化合物,这与共价层电子相关,即前者相当于用3个np电子成键,而后者则用2个ns电子和3个np电子成键。
本族元素从上→下,+5氧化态化合物稳定性递减,而+3氧化态的稳定性递增。
2、性质变化规律N P As Sb Bi单质物态:气固固固固非金属元素准金属元素金属元素I1──────────────────>减小X──────────────────>减小EA1─────────────────>递增,负值减小N在本族中半径最小,电负性最大,价电子层数为2,故具有一些与本族其它元素不同的特性。
如形成化合物时,只有2s、2p轨道可用,故最高配位数为4;r小,故易形成重键。
共价半径(单键)/pm:N,70;O,66;F,64;(双键)/pm:N,60;O,55;F,(54);(叁键)/pm:N,55;O,(51);—与氧族元素及卤素比较⑴、本族元素的金属性更强,同族从上到下非金属性向金属性过渡完整。
⑵、ⅥA、ⅦA族元素均存在8-族数的负氧化态离子,本族则只有N和P两元素在固态下个别化合物中有-3氧化态离子,As,Sb,Bi不形成负离子。
氮族元素氮族元素(Nitrogengroup)是元素周期表ⅤA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种,这一族元素在化合物中可以呈现-3,+1,+2,+3,+4,+5等多种化合价,他们的原子最外层都有5个电子。
最高正价都是+5价。
氮族元素在地壳中的质量分数分别为,氮0.0025%,磷0.1%,砷0.000015%,锑0.000002%,铋0.00000048%。
氮族元素原子结构特点是:原子的最外电子层上都有5个电子,这就决定了它们均处在周期表中第ⅤA族。
它们的最高正价均为+5价,若能形成气态氢化物,则它们均显-3价,气态氢化物化学式可用RH3表示。
最高氧化物的化学式可用R2O5表示,其对应水化物为酸。
它们中大部分是非金属元素。
氮族元素随着原子序数的增加,由于它们电子层数逐渐增加,原子半径逐渐增大,最终导致原子核对最外层电子的作用力逐渐减弱,原子获得电子的趋势逐渐减弱,因而元素的非金属性也逐渐减弱。
比较明显的表现是它们的气态氢化物稳定性逐渐减弱(NH₃>PH₃>AsH₃);它们的最高价氧化物对应水化物的酸性逐渐减弱(HNO₃>H3PO₄>H3AsO₄);另一方面,随着原子序数的增加,原子失去电子的趋势逐渐增强,元素的金属性逐渐增强,砷虽是非金属,却已表现出某些金属性,而锑、铋却明显表现出金属性。
关于氮族元素的化学方程式见下氮气氮气与金属反应:3Mg+N₂——→(点燃)Mg₃N₂大气固氮:N₂+O₂——→2NO2NO+O₂——→2NO₂3NO₂+H2O ——→2HNO₃+NO氨合成氨(人工固氮,工业制氨气):N₂+3H₂—高温高压、催化剂→2NH₃实验室制氨气:2NH4Cl+Ca(OH)₂——→CaCl₂+2NH₃↑+H2O氨气溶于水:NH₃+H2O——→NH₃·H2O氨水受热分解:NH₃·H2O——→NH₃↑+H2O 氨气与盐酸的反应(弱碱性):NH3+HCl——→NH4Cl氨气与硫酸的反应(弱碱性):2NH3+H2SO4——→(NH4)2SO4氨气与氯气的反应(还原性):8NH3+3Cl2——→6NH4Cl+N2 干燥铵盐使用碱石灰(CaO和NaOH的混合物)氨气与氧化铜在加热的条件下反应,生成H20,N2,Cu铵盐NH4Cl——→NH₃↑+HCl↑NH₃+HCl——→NH4Cl(氨气和氯化氢气体相遇有白烟产生)NH4HCO₃——→NH₃↑+H2O+CO₂↑(碳铵要阴天深施的原因)NH4++OH-——→NH₃↑+H2O(铵根离子的检验)硝酸·制备(工业)4NH₃+5O₂—催化剂、△→4NO+6H2O2NO+O₂——→2NO₂3NO₂+H2O——→2HNO₃+NO↑实验室2NaNO₃+H₂SO4—加热→Na2SO4+2HNO₃化学性质(1)·不稳定性4HNO₃——→2H2O+4NO₂↑+O₂↑(2) ·强氧化性Cu+4HNO₃(浓)——→Cu(NO3)₂+2NO₂↑+2H2O3Cu+8HNO₃(稀)——→3Cu(NO3)₂+2NO ↑+4H2OC(灼热)+4HNO₃(浓)——→CO₂↑+4NO₂↑+2H2O2HNO₃+3H₂SO₃=3H₂SO4 +2NO↑+H₂O3)挥发性、(4)酸的通性王水——浓硝酸和浓盐酸按1:3的体积比溶解在Pt、Au中。
第十三章 氮族元素Chapter 13 The Nitrogen Family ElementsNitrogen (N) Phosphorus (P) Arsenic (As) Antimony (Sb) Bismuth (Bi)Electron configuration: n s 2n p 3§13-1 氮及其化合物 Nitrogen and its Compounds一、General properties1.其电负性(electronegativity )仅次于氟(4.0)、氧(3.5) 2.N 的三重键键能大于P 、C 的三重键键能:NN 945kJ·mol -1 ,PP 481kJ·mol -1 ,-CC - 8355kJ·mol -1 ;而N 的单键键能很弱:N N200 kJ·mol -1,C C346kJ·mol -13.氮的氧化数为-3、-1、+1、+3、+5也有-2、+2、+4 4.氮为植物和动物机体蛋白质(proteins )的成份 5.存在:智利硝石(Chile saltpeter):NaNO 3 印度硝石(Indian saltpeter):KNO 3也存在于星云和太阳大气中,天王星,海王星二、Simple Substance1.N 2的MO 表示式:2z 4y ,x 2*s 222s )()()()KK(σπσσ,所以键级为3,显得格外稳定。
N2(g)2N(g) ∆d H m = 945kJ·mol -1 K = 10-120,当T = 3000℃时,N 2的离解度仅为0.1%,但植物根瘤上生活的一些固氮细菌能够在常温常压下把空气中的N 2变成氮化物。
2.许多氮化物的∆f H m >0(吸热),而∆S <0(因为N 2为气体),所以∆r G f 总是大于零,因此氮化物在热力学上不稳定,易分解。
3.在通常条件下,N 2是化学惰性的,在一定条件下,N 2与金属、非金属反应 6Li + N22Li 3N Mg 、Ca 、Sr 、Ba 在炽热温度与N 2直接化合 N 2 + O 2放电2NO N 2 + 3H 22NH 3 (中温,高压,催化剂)4.Preparation:(1) Industry :液态空气分馏(2) Laboratory :NH 4Cl + NaNO 2NaCl + NH 4NO 2 NH4NO 2N 2 + 2H 2O三、Compounds1.[ -3 ] O.S. NH 3及其氮化物(nitride )Na 3N Mg 3N 2 AlN Si 3N 4 P 3N 5 S 4N 4 Cl 3N(1) hydrolysis : Li 3N + 3H 3O 3LiOH + NH 3↑ Cl 3N + 3H 3O 3HClO + NH 3↑ (2) reduction : 2NH 3 + 3CuO N 2↑+ 3Cu + 3H 2O 8NH 3 + 3Br 2(aq)N 2↑+ 6NH 4Br(3) 大分子晶体:AlN 、Si 3N 4、BN 、Ge 3N 4具有高熔点,高强度材料 (4) liquid ammonia: 强的离子化溶剂a .氨的分子轨道式 2non z2y 2x 2s )()()()(σσσσ b .自偶电离 2NH3-++24NH NH acid baseNH 4Cl 、NH 4NO 3在液氨中为强酸, KNH 2、Ba(NH 2)2在液氨中为强碱 Zn(NH 2)2、Al(NH 2)3为amphotericc .能溶解碱金属(Na 、K 、Ca )生成蓝色溶液,这是由于氨合电子的存在引起的蓝色Na + (x + y )NH3+x )Na(NH 3 + e -y )(NH 3d .several types of reactions in liquid ammonia(i) neutralization reaction KNH 2 + NH 4NO 3KNO 3 + 2NH 3 , KOH + HNO 3KNO 3 + H 2O(ii) ammonolysis PCl 5 + 8NH 3PN(NH 2)2 + 5NH 4Cl PCl 5 + 9H 2O(HO)3PO + 5H 3OCl SO 2Cl 2 + 4NH 3SO 2(NH)2 + 2NH 4Cl SO 2Cl 2 + 4H 2O SO 2(OH)2 + 2H 3OCl(iii) substitution 2K + 2NH 32KNH 2 + H 2 , 2K + 2H 2O2KOH + H 2(iv) coordination reaction Zn(NH 2)2 + 2NH 4Cl [Zn(NH 3)4]Cl 2 Zn(OH)2 + 2H 3OCl [Zn(H 2O)4]Cl 2 2KNH 2 + Zn(NH 2)2K 2[Zn(NH 2)4] 2KOH + Zn(OH)2K 2[Zn(OH)4](5) 铵盐(ammonium salts )a .铵盐中酸根的酸性越强,铵盐的稳定性越大,即NH 4I >NH 4Br >NH 4Cl >NH 4Fb .因为+4NH r 约等于+K r ,铵盐的性质与钾盐相似,绝大多数铵盐溶于水且完全电离c .NH 4Cl 可除去金属表面的氧化物,所以NH 4Cl 称为硇砂(sal ammoniac) NH4Cl + 3CuO 3Cu + N 2 + 3H 2O + 2HCld .铵盐的热分解(i) 酸是不挥发的 (NH4)2SO 4NH 3↑+ NH 4HSO 4 (NH4)3PO 43NH 3↑+ H 3PO 4(ii) 酸是挥发性的 NH4Cl NH 3↑+ HCl ↑(iii) 酸根离子有强氧化性 NH 4NO3N 2O + 2H 2O N 2O N 2 +21O 2 NH 4NO2N 2 + 2H 2O(NH 4)2Cr 2O7Cr 2O 3 + N 2 + 4H 2O 2NH 4ClO4N 2 + Cl 2 + 2O 2 + 4H 2O2.[ -2 ] O.S.氮像氧形成过氧化物那样,形成过氮化物,最简单的为N 2H 4肼或联氨(hydrazine或diamide )(1) structure :μ ≠ 0,说明结构不对称 (2) autodissociation 2N 2H4-++3252H N H N K = 2×10-25(3) 是二元弱碱 N 2H 4 + H 2O+52H N +OH -K b1 = 3.0×10-6 +52H N + H 2O +262H N +OH -K b2 = 3.0×10-6 (4) unstable :过渡金属离子的存在会加速N 2H 4的分解,加明胶可以吸附或螯合金属离子N 2H 4Pb 或NiN 2 + 2H 2 3N 2H 4N 2 + 4NH 3(5) 是强还原剂,特别是在OH -介质中 N 2H 4N 2 + 4H + + 4e φ = -0.23VN 2H 4 + 4OH-N 2 + 4H 2O + 4e φ = -1.16V+-++12HH N 5MnO 4424O 16H 4Mn 5N 222+++它与空气混合,可燃烧并放出大量的热,(CH 3)2NNH 2(偏二甲肼)作为火箭燃料 N 2H 4(l) + O 2(g)N 2(g) + 2H 2O(l) ∆c H m = -622kJ·mol -1 N 2H 4 + HNO 2HN 3 (azidic acid) + 2H 2O (6) preparation: 2NH 3 + NaClO N 2H 4 + NaCl + H 2O该反应相当复杂,主要分两步: NH 3 + ClO-NH 2Cl + OH -(快)NH 3 + NH 2Cl + OH -N 2H 4 + Cl -+ H 2O (慢)还有副反应:422H N Cl 2NH +-+++Cl 22NH N 423.[ -1 ] O.S. NH 2OH 羟氨 (hydroxylamine)(1) structure :H O N H H......(2) preparation : HNO 3 + 6[H]NH 2OH + 2H 2O ,即电解中产生的[H]来还原HNO 3(3) properties :a .羟氨是不稳定的白色固体,在15℃左右发生热分解:3NH 2OHNH 3 + N 2 + 3H 2Ob .羟氨是一元碱,碱性小于氨 ( K b = 9.1×10-9 ),其水溶液稳定NH 2OH(aq) + H 2ONH 3OH + + OH -NH HNHH11.2o147 pmc .在H +、OH -中,都是强还原剂,其氧化产物可以脱离反应体系 N 2 + 2H 2O + 2H + + 2e 2NH 2OH A ϕ = -1.87VN 2 + 4H 2O + 2e 2NH 2OH + OH -B ϕ = -3.04V 如:NH 2OH + HNO 32NO + 2H 2O2NH 2OH + 2AgBr N 2 + 2Ag + 2HBr + 2H 2O2NH 2OH + I 2 + 2KOHN 2 + 2KI + 4H 2O在OH -条件下,NH 2OH 也可作为氧化剂,而在H +条件下,几乎不可能成为氧化剂。
NH 2OH + 2H 2O + 2e 2NH 3·H 2O + 2OH -B ϕ = 0.42V NH 3OH + + 2H + + 2e+4NH + H 2O A ϕ = -1.35V如:Na 3AsO 3 + NH 2OH NH 3 + Na 3AsO 4 NH 2OH + H 2O + 2Fe(OH)2NH 3 + 2Fe(OH)3 4.氮的氧化物(The oxides of nitrogen )N 2O (dinitrogen oxide) NO (nitrogen monoxide) N 2O 3 (dinitrogen trioxide) NO 2 (nitrogen dioxide) N 2O 5 (dinitrogen pentoxide) (1) structure :a .(laughing gas)Lewis 结构两个σ键,两个43∏b .NO 一个σ键,一个π键,一个三电子π键 NO ....... 是单电子分子,其分子轨道式为:(1σ)2 (2σ)2 (3σ)2 (4σ)2 (1π)4 (5σ)2 (2π)1反应时较易失去此电子,形成NO +(亚硝酰离子 nitrosyl )c .N 2O 3:Lewis 结构: (不稳定) (不稳定)(不稳定) 实际结构: 四个σ键,一个65∏,或者 43Π d .NO 2:V 型 两个σ键,一个43∏,∠ONO = 134° N 2O 4: 五个σ键,一个86∏,或者 两个43Πe .N 2O 5: 六个σ键,两个43∏ (2) properties :a .N 2O 3 NO + NO 2N 2O 3,是HNO 2的酸酐,极易分解为NO 、NO 2b .NO 2易聚合成无色N 2O 4,即NO 2的单电子占有σ轨道,低于21.15℃完全转化N N O N NO N O N N O 2+O N NO O N N O OO N N O N O N N O O OO N N O186.4pmO N N N O成N 2O 4 2C15042NO O N −−→−︒c .N 2O 5 其固体由+2NO 、-3NO 构成。