空气液相氧化
- 格式:doc
- 大小:66.00 KB
- 文档页数:3


第六章氧化反应从广义上来讲,凡是有机物分子中碳原子失去电子,碳原子总的氧化态增高的反应均称为氧化反应;从狭义上讲,凡使反应物分子中的氧原子数增加,氢原子数减少的反应称为氧化反应。
利用氧化反应除了可以得到各类有机化合物如醇、醛、酮、酸、酯、环氧化物和过氧化物等,还可以制备有机腈和二烯烃等。
有机物的氧化反应都是强放热反应,因此,氧化反应中及时移除反应热是一个很关键的问题。
烃类和其它有机物的氧化反应几乎都是不可逆反应,反应都能进行到底。
有机合成中氧化方法主要有三种,即催化氧化和催化脱氢、化学氧化、电解氧化。
此外,生物氧化在有机合成中的应用也日益受到人们的重视。
生物氧化是一种较缓和的氧化过程。
人类在很早以前就利用微生物进行氧化反应来进行酿酒、制醋。
生物氧化具有高度的选择性,收率高,反应条件温和,三废少等特点。
因此,生物氧化是一种很有发展前景的氧化合成方法。
第一节催化氧化和催化脱氢一、催化氧化在没有催化剂的情况下,有机物在室温下与空气接触,就能发生缓慢的氧化反应,这种现象称为自动氧化。
在实际生产中常常需要使用催化剂,以提高反应的速度和选择性。
在催化剂存在下进行的氧化反就应称为催化氧化。
催化氧化法生产能力大,对环境污染小,且作为氧化剂的空气和氧来源广泛,无腐蚀性。
因此,工业上大吨位产品多采用空气催化氧化法。
氧化反应根据反应温度和反应物聚集状态不同,又可分为液相催化氧化和气相催化氧化反应。
液相催化氧化多在100︒C左右进行反应;气相催化氧化则常在200~400︒C下进行反应。
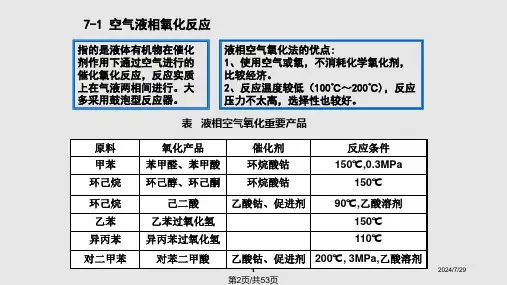
(一)液相空气氧化液相空气氧化是液态有机物在催化剂存在下,通入空气进行的催化氧化反应。
液相空气氧化反应的实质是在气液两相间进行的,大多采用鼓泡型反应器。
1.反应历程液相空气氧化属于自由基反应历程,其反应历程包括链的引发,链的传递和链的终止三个步骤,其中决定性步骤是链的引发。
下面以烃的氧化为例:(1)链引发 烃类R-H 在光照、热及可变价金属盐或自由基引发剂的作用下发生C-H 键的均裂而生成自由基R ⋅。



乙苯空气液相氧化反应历程
乙苯空气液相氧化反应是指将乙苯和空气通过液相反应得到苯乙酮的过程。
该反应通常在合适的催化剂存在下进行,常见的催化剂包括过渡金属盐类(如锰醋酸盐或锰乙酸盐)、钴醋酸盐等。
乙苯空气液相氧化反应历程主要包括以下几个步骤:
1. 氧气和乙苯的吸附:氧气与催化剂表面吸附,乙苯分子在催化剂表面发生吸附。
2. 活化氧的解离:吸附在催化剂表面的氧气分子经过活化,发生解离,生成活性氧物种。
3. 活性氧与乙苯的反应:活性氧物种与吸附在催化剂表面的乙苯分子发生反应,产生苯乙酮和水。
4. 产物的脱附:苯乙酮和水从催化剂表面脱附,进入反应体系中。
5. 催化剂再生:经过一定的时间,催化剂可能会失活,需要通过再生处理使其恢复活性,继续参与反应。
需要注意的是,乙苯空气液相氧化反应是一种复杂的化学反应过程,具体的反应机理和条件会受到催化剂种类、反应温度、反应压力等因素的影响。
因此,在实际应用中,需要进行精确的实验设计和操作控制来实现高效的反应。

催化氧化的发展历程
催化氧化是化学反应中一种重要的过程,它广泛应用于化工、环保、能源等领域。
催化氧化的发展历程经历了多个阶段,本文将简要介绍催化氧化的历程以及液相空气氧化和氧化反应的历程。
一、液相空气氧化历程
液相空气氧化是一种重要的化学反应过程,它是指将液体或固体物料与空气混合,在催化剂的作用下进行氧化反应。
液相空气氧化的历史可以追溯到19世纪末期,当时人们开始研究如何将空气中的氧气转化为具有更高活性的氧化剂。
在20世纪初期,人们发现了铬酸盐和硝酸盐等氧化剂,这些氧化剂在某些情况下可以促进液相氧化反应。
随后,人们又发现了其他一些氧化剂,如高锰酸盐、重铬酸盐等。
这些发现为液相空气氧化的进一步发展奠定了基础。
二、氧化反应的历程
液相中的氧化属于自由基反应,包括三个步骤:链引发、链传递和链终止。
1.链引发
链引发是氧化反应的起始步骤,它是指氧化剂与底物之间相互作用生成自由基的过程。
这个过程中,氧化剂会吸收能量,使电子从底物转移到氧化剂上,从而形成自由基。
2.链传递
链传递是指自由基与底物之间相互作用生成新的自由基和产物
的过程。
这个过程中,自由基会从底物中夺取电子,从而形成新的自由基和产物。
3.链终止
链终止是氧化反应的结束步骤,它是指两个自由基之间相互作用生成产物的过程。
这个过程中,两个自由基会相互结合,从而形成稳定的产物。
综上所述,催化氧化的发展历程经历了多个阶段,人们对于氧化反应历程的认识也在不断深入。
随着科学技术的不断发展,人们将会继续探索新的氧化技术和催化剂,为催化氧化领域的发展做出更大的贡献。

文章标题:偏三甲苯液相空气氧化反应过程的模拟及研究1. 引言偏三甲苯是一种重要的化工中间体,在工业生产中被广泛应用。
其氧化反应过程是一个复杂的工艺过程,对于提高反应效率和产品质量具有重要意义。
本文将从模拟和研究的角度,对偏三甲苯液相空气氧化反应进行深入探讨。
2. 偏三甲苯液相空气氧化反应的基本情况偏三甲苯是一种芳烃化合物,其氧化反应是将其氧化为偏甲酸的过程。
该反应在工业生产中被大量应用,因此对其进行模拟和研究具有重要意义。
3. 模拟方法及研究手段为了更好地了解偏三甲苯液相空气氧化反应过程,我们可以借助计算机模拟和实验研究两种手段进行探索。
计算机模拟可以通过建立反应的动力学模型,仿真反应过程中的各种参数变化,从而加深我们对反应机理的理解。
实验研究也是十分必要的,通过实验数据的收集和分析,可以验证计算模拟的结果,为反应工艺的优化提供重要依据。
4. 偏三甲苯液相空气氧化反应的模拟研究进展目前,关于偏三甲苯液相空气氧化反应的模拟研究已取得了一些重要进展。
通过分子模拟和动力学模型的建立,研究人员可以模拟反应中的各种过程,如反应物的相互作用、活化能的变化等。
这些研究为我们提供了深入探讨反应机理的重要线索。
5. 个人观点及理解在我看来,偏三甲苯液相空气氧化反应是一个具有挑战性的领域,在深入研究中我们可以发现很多有意思的现象和规律。
我认为,通过模拟和研究的手段,我们可以更好地理解反应的本质,为工业生产提供更优秀的反应工艺。
6. 总结偏三甲苯液相空气氧化反应是一个复杂的工艺过程,通过模拟和研究的手段,我们可以更好地了解其机理和规律。
未来的研究中,我们还需要加大实验研究的力度,进一步验证模拟结果,为反应工艺的优化和提高提供更多的依据。
通过本文的全面评估和深度探讨,希望你对偏三甲苯液相空气氧化反应过程有了更深入的理解。
如果有其他需求或疑问,欢迎继续交流讨论。
偏三甲苯液相空气氧化反应是一个涉及多个因素和参数的复杂过程,在工业生产中具有重要的应用价值。



大气中so2的液相氧化研究SO2一种重要的污染物,在大气中广泛存在,其来源主要有:一是燃烧燃料时产生的烟气,二是冶炼行业中用硫酸冶炼法产生的烟气等。
SO2大气之中会对空气质量造成污染,如果尚未被处理就进入大气环境,会增加大气污染物的激烈性,同时会给人们的健康带来很多危害。
因此,研究和控制SO2大气中的污染是至关重要的,其中液相氧化是一种有效的处理手段。
液相氧化是一种把成份缓慢溶解和氧化的过程。
在SO2相氧化处理中,主要采用酸性溶液,将SO2 作为溶解物,然后通过氧化剂,例如氯氧化钠等,将SO2行氧化,最后产生SO3,从而达到减少污染的目的。
在SO2液相氧化的研究过程中,首先要明确SO2物理化学性质,它的氧化和溶解过程受到哪些因素的影响。
这可以通过实验来进行研究和表征,也可以用数值模拟来研究SO2液两相系统的模型和反应动力学。
在实验方面,首先应该了解液相氧化过程中各参数影响,包括SO2解度,溶液pH值,氧化剂的有效性和用量,氧化反应的温度等,这将有助于确定SO2相氧化处理的最佳工艺条件。
当pH值较低时,SO2溶解度较高,而氧化速率也较快;当pH值较高时,SO2溶解度较低,但氧化速率更高;氧化剂的有效性和用量也会影响水溶液浓度,氧化反应的温度可以使溶胶的水溶液浓度降低,这些实验参数对液相氧化反应的影响有一定的研究价值,是探究SO2相氧化处理有效性的基础。
数值模拟方面,主要是有关SO2氧化剂在气液两相系统中反应动力学的研究,运用数值模拟可以更加深入地了解SO2氧化剂相互作用的机理,从而揭示液相氧化过程的动态转变规律。
通过对SO2相氧化的实验研究及数值模拟,可以更全面地掌握SO2相氧化处理的机理,更准确地确定处理工艺条件,以有效控制SO2大气中的污染。
同时,还可以通过设计和采用一些技术开发出新的液相氧化处理技术,以更有效地控制SO2大气污染。
最后,通过对SO2相氧化研究,不仅可以有效地控制SO2怕,而且还可以更好地保护我们的空气质量,为人类的健康和美好的环境提供更多的保障。
偏三甲苯液相空气氧化法反应热偏三甲苯是一种有机化合物,也被称为甲苯异构体之一。
它的化学式为C9H12,结构式为(CH3)3C6H3。
偏三甲苯具有较高的挥发性和溶解性,常用作溶剂、原料和反应中间体。
在许多工业领域中,偏三甲苯的氧化反应是一个重要的过程。
本文将重点讨论偏三甲苯液相空气氧化法反应热。
偏三甲苯液相空气氧化法是一种将偏三甲苯转化为对苯二甲酸的方法。
该反应通常在高温下进行,需要使用氧气作为氧化剂。
反应的化学方程式如下:3(CH3)3C6H3 + 9O2 → 3C6H4(COOH)2 + 9H2O根据方程式可以看出,每个分子的偏三甲苯需要消耗9个氧气分子,生成3个对苯二甲酸分子和9个水分子。
这是一个放热反应,即反应过程中会释放热量。
在实际应用中,偏三甲苯液相空气氧化法反应通常在加热条件下进行。
通过加热反应体系,可以提高反应速率和产率。
反应温度通常在150-180摄氏度之间,这是一个相对较高的温度范围。
在这个温度范围内,偏三甲苯分子的活性较高,有利于反应的进行。
同时,高温条件下也有助于加快氧气分子的扩散速率,提高反应效率。
在反应过程中,除了温度的影响外,反应热也是一个重要的参数。
反应热是指单位时间内反应体系释放或吸收的热量。
对于偏三甲苯液相空气氧化法反应来说,反应热可以通过实验测定得到。
实验中可以使用热量计等设备来测量反应体系的温度变化,并结合热容和质量等参数计算得到反应热。
根据实验数据可以得知,偏三甲苯液相空气氧化法反应热为负值,即反应过程中释放热量。
这是因为该反应是一个放热反应,反应物的化学键在反应过程中被打断,新的化学键形成释放出能量。
反应热的大小与反应物的摩尔数、反应温度以及反应物质的性质等因素有关。
在工业生产中,了解偏三甲苯液相空气氧化法反应热对于控制反应过程和优化生产条件非常重要。
通过合理调节反应温度和控制反应物质的投入量,可以实现高效、安全、经济的生产过程。
总之,偏三甲苯液相空气氧化法反应热是一个重要的参数,在工业生产中具有重要意义。
甲苯液相空气氧化制苯甲酸扩大实验报告
一、实验目的
本次实验的目的是探索用空气氧化法制取苯甲酸的工艺条件。
二、实验原理
苯甲酸的制备常用空气氧化法:空气与甲苯混合通过超声氧化反应,生成氧化产物,然后将氧化产物与强碱反应,最终得到苯甲酸。
三、实验方法
(1)首先将甲苯和氧气按照1:1的比例混合在一容器内,再施加超声波,使甲苯完成高效氧化反应。
(2)将甲苯氧化产物灌入钠基固定床中,然后加入27wt%的碳酸氢钠溶液作为反应剂。
(3)调节反应的温度为70~80℃,碳酸氢钠浓度约为30%,反应时间约为2小时,用大火加热推进反应,气流方向从上往下,以保证产物完全回流。
(4)冷却后,将反应物过滤,用水过滤等方法将反应产物稀释,再经过中和处理,最后经过沉淀分离得到苯甲酸。
四、实验结果
通过本次实验,苯甲酸的收率可达到83%,且其中残留物极低,保证制备的苯甲酸产品质量较高。
五、实验结论
本次实验获得了较高的收率,说明采用空气氧化法制取苯甲酸,其收率高、浩昂极低,属于一种较优的工艺方法。
空气液相氧化
《精细有机合成调研报告》---09化工(1)班烃类的空气液相氧化在工业上可直接制得有机过氧化氢物、醇、醛、酮、羧酸等一系列产品。
一、反应历程
某些有机物在室温下在空气中会发生缓慢氧化,这种现象叫“自动氧化”。
将在实际生产中,为了提高自动为提高自动氧化的速率,需要提高反应温度,并加入引发剂或催化剂。
自动氧化是自由基的链反应,其反应历程包括链的引发、链的传递和链的终止三阶段。
1.链的引发:被氧化物R-H在能量(热能、光辐射和放射线辐射)、可变价金属盐或自由基的作用下,发生C-H键的均裂而生成自由基R•的过程。
R-H→R•+•H
R-H+Co3+→R•+H++Co2+
R-H+•X→R•+HX
R•的生成给自动氧化提供了链传递物。
一般,C-H键的均裂是十分困难的,需要在较高的温度下才能进行。
因此,对于烃的液相空气氧化反应一般采用引发剂或可变价金属催化剂来引发此反应。
加入引发剂是由于在较低温度下就可以均裂而产生活泼的自由基,与被氧化物反应而产生烃基自由基,从而引发反应。
可变价的金属盐类是利用其电子转移而使被氧化物在较低的温度下产生自由基。
2.链的传递:自由基R•与空气中的氧相作用生成有机过氧化氢物和再生成自由基R•的过程。
R•+O2→R-O-O•
R-O-O•+R-H→R-O-OH+R•
3.链的终止:自由基R•和R-O-O•在一定条件下会结合成稳定的化合物,从而使自由基销毁。
也可加入自由基捕获剂以终止反应。
2R•→R-R
R•+R-O-O•→R-O-O-R
所生成的过氧化氢物在反应温度下若稳定,可生成最终产物;若不稳定可分解为醇、醛、酮、酸等产物。
如在金属催化剂存在下会发生分解生成醇、醛、酮、羧酸。
当被氧化烃为R-CH3(伯碳原子)时,在可变价金属存在下,生成醇、醛、酸。
当被氧化是烃类中的仲碳原子或叔碳原子时,分解产物还可以是酮。
二、自动氧化的主要影响因素
1.引发剂和催化剂
可变价金属盐类引发剂的优点是,按照反应式生成的低价金属离子可以被空气中的氧再氧化成高价离子,它并不消耗,能保持持续的引发反应。
在不加入引发剂或催化剂的情况下,R-H 的自动氧化在反应初期进行得非常慢,要经过很长时间才能积累起一定浓度的自由基R • ,使氧化反应能以较快的速率进行下去。
2. 被氧化物的结构
在烃分子中叔C-H 键最易均裂,其次是仲C-H 键,最弱的是伯C-H 键。
叔
碳过氧化氢物和仲碳过氧化氢物在一定条件下比较稳定。
3. 原料质量的影响
由于自由基捕获剂或阻化剂易与自由基结合生成稳定的化合物,而使自由基销毁,造成终止,使自动氧化的反应速率变慢。
因此,在被氧化的原料中不应含有自由基的捕获剂,如酚、胺、醌、烯烃等类化合物。
4. 氧化深度的影响
氧化深度通常以原料的单程转化率来表示。
由于自动氧化反应是自由基反应,往往存在连串副反应和其他的竞争副反应。
随着反应单程转化率的提高,往往会造成目的产物的分解或过度氧化,降低反应的选择性。
三、 空气液相氧化法的优缺点
主要优点:与化学氧化法相比,不消耗价格较贵的化学氧化剂;反应温度较低(100-250℃),反应的选择性好,可用于制备多种类型的产品。
缺点:在较低反应温度下氧化能力有限,由于单程转化率低,后处理操作复杂。
反应液是酸性的,氧化反应器需要用优良的耐腐蚀材料;一般需带压操作。
四、 相应化学品 1. 烷基芳烃的氧化酸解制酚类
最重要的实力是异丙苯的氧化酸解制苯酚。
C H 3
O C H 3C 空气液相氧化 O 2C H 3
C H 3
H C O H
C H 3C O C H 3O H
H +
质子化C C H 3
O C H 3
O +
H 2
-
H 2O
脱水
C
C H 3
C H 3O
+
O C +
C H 3
C H 3H 2O 转位
O C O +H 2C H 3
C H 3
分解
O H
+
C H 3C O C H 3 H
+
异丙苯法生产苯酚成本低,已完全代替曾经使用过的其他生产方法。
苯酚的需要量很
大,副产的丙酮过剩、价格低,又开发成功了丙酮脱水成丙烯,勇于异丙苯的丙酮循环法。
2. 高碳烷烃的氧化制高碳脂肪仲醇
R C H
2R 'O 2,自动氧化
R C H R '
O O H R C H O O H
R '
+
R
C H 2
R '过氧化氢物分解R
C H R '
O H
+
R C R '
+
O H
3 R
CH R'O
O
H
+
H 3BO 3
酯化
水解
R CH O R'
3B
+3H
2O
加入硼酸可以使开始生成的仲烷基过氧化氢物在分解为仲醇时立即与硼酸作用生成
耐热的硼酸酯,从而防止了仲醇的进一步氧化。
3. 环烷烃的氧化制环烷醇/酮混合物 实例是环己烷氧化成环己醇/酮混合物 H
H
H
H
H H H H H H
H H
O 2自动氧化
H
O
H H
H H H H
H
H H H O H 分解
H O H
H H H H
H H H H H
H
+
H H H
H
H
H O H H H
H
根据所用催化剂的不同有三种不同的工业方法:
(1)无催化剂法 即自催化法,用稀释的含氧10%-15%的空气,氧化时得环己基过氧化氢,然后在金属氧化物催化剂存在下加热分解得环己醇/酮混合物,醇/酮摩尔比约1/2,选择性80%-85%。
(2)硼酸催化法 氧化分解时生成的环己醇与硼酸成酯,环己醇脱氢成环己酮的负荷大。
(3)钴盐催化法 控制环己烷转化率4%-6%,醇/酮比约65/35,选择性77%-80%。
目前正在开发中的自动氧化催化剂有:分子筛、均相过渡金属配合物、金属卟啉仿生催化剂、纳米金属氧化物催化剂等。
4. 羧酸的制备
直链烷烃在自动氧化时首先生成仲烷基过氧化氢物,后者再经过一系列复杂反应,
发生C-C 键的断裂,生成两个分子的羧酸。
R
C H 2CH 2R'自动氧化R
CH
CH 2
O
O
R'H
分解氧化R
C
O H
O
+
R'C O O H。