DPPH和ABTS、PTIO自由基清除实验-操作图解-李熙灿-Xican-Li
- 格式:doc
- 大小:976.82 KB
- 文档页数:14

DPPH自由基清除法实验—以香草酸为例【仪器与试剂】1.仪器可见分光光度计;SB3200D超声波清洗机;电子天平(BS110S);BIOHIT单道手动可调移液器(10-100μL、100-1000μL、1000-5000μL);微量比色皿。
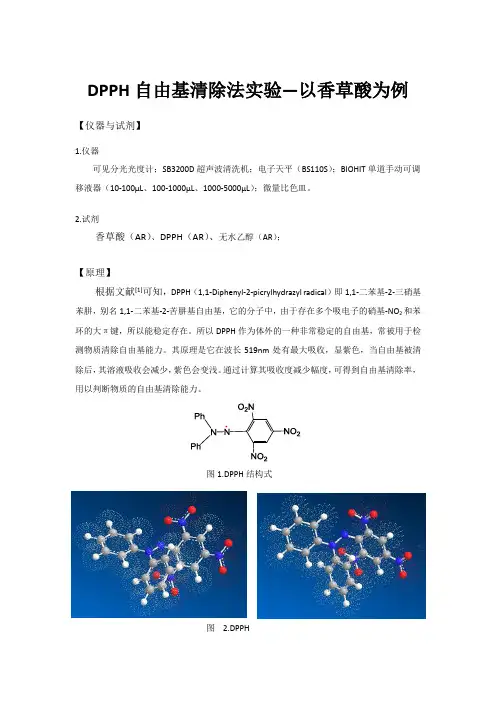
2.试剂香草酸(AR)、DPPH(AR)、无水乙醇(AR);【原理】根据文献[1]可知,DPPH(1,1-Diphenyl-2-picrylhydrazyl radical)即1,1-二苯基-2-三硝基苯肼,别名1,1-二苯基-2-苦肼基自由基,它的分子中,由于存在多个吸电子的硝基-NO2和苯环的大π键,所以能稳定存在。
所以DPPH作为体外的一种非常稳定的自由基,常被用于检测物质清除自由基能力。
其原理是它在波长519nm处有最大吸收,显紫色,当自由基被清除后,其溶液吸收会减少,紫色会变浅。
通过计算其吸收度减少幅度,可得到自由基清除率,用以判断物质的自由基清除能力。
图1.DPPH结构式图 2.DPPH分子模型【实验对象】香草酸(Vanillic acid),学名“4-羟基-3-甲氧基苯甲酸”,分子式为C8H8O4,是酪氨酸、儿茶酚胺的代谢产物,主要以硫酸酯结合型存在于尿中。
香草酸为白蒿的抗菌主要有效成分,广泛存在于胡黄连、高丽参等中药材中,具有抗细菌和抗真菌的作用。
香草酸具有较强的抗氧化活性,是良好的混合型酪氨酸酶抑制剂。
香草酸在结构上咖啡酸、阿魏酸极其相似,它们三者之间又可以作为彼此的代谢物而存在于体内,具有较高的研究意义。
图3.香草酸结构式图4.香草酸分子模型【实验操作】清除DPPH能力检测本实验采用文献[1]的方法,并视情况改动。
大致过程如下:1. DPPH测试液的配置取DPPH 0.5mg溶于约20mL溶剂(无水乙醇、95乙醇或甲醇)中,超声5min,充分振摇,务使上下各部分均匀。
取1mL 该DPPH溶液,在519nm处测A值,使A 在0.9左右。
该DPPH溶液最好避光保存,3.5小时内用完。

DPPH法测定黄苓黄酮的抗氧化活性抗氧化就是任何以低浓度存在就能有效抑制自由基的氧化反应的物质,其作用机理可以是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。
目前对自由基清除剂的研究方法主要有2类,一类是体外模型,另一类是体内模型,其中DPPH法是体外模型中最常用的方法。
DPPH又称1,1-二苯基-2-三硝基苯肼,是一种很稳定的氮中心的自由基,他的稳定性主要来自共振稳定作用的3个苯环的空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。
它的无水乙醇溶液呈紫色,在517nm波长处有最大吸收,吸光度与浓度呈线性关系。
向其中加入自由基清除剂时,可以结合或替代DPPH •使自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价清除自由基的能力。
即通过在517nm波长处检测样品清除DPPH •的效果,来计算抗氧化能力。
实验研究表明,黄苓黄酮中清除DPPH自由基活性的主要成分是黄苓苷[1],黄苓苷中含有羧羟基和酚羟基能与DPPH反应,反应式如下:O2NN02 NO2DPPH与抗氧化剂反应原理材料:DPPH( 1,1-二苯基-2-三硝基苯肼);无水乙醇;仪器:分光光度计1. DPPH贮备液的制备准确称取DPPH试剂3 . 5mg,用无水乙醇溶解,并定量转入10mL容量瓶中,用无水乙醇定容至刻度,取2mL至100ml容量瓶中,摇匀得浓度为0.0178mmol / L DPPH贮备液,置于冰箱中冷藏备用。
2. 试液的制备(只作参考)准确称取5.2mg干燥的黄酮提取物(32.75%),用无水乙醇溶解,并定量转入50ml容量瓶中,用无水乙醇定量至刻度,取10ml至100ml容量瓶中,摇匀得浓度为0.0233mmol/L 试液。
3. DPPH-清除率的测定在10mL比色管中依次加入 4.0mLDPPH溶液和黄酮提取液,再加入无水乙醇至刻度,混匀立即用1cm比色皿在517nm波长处测吸光值(A),吸光值记为Ai,再在温室避光保存30min后测吸光值,记为Aj,对照试验为只加DPPH的乙醇溶液,其吸光值记为Ac。
1ABTS +·溶液的配置方法:实验流程图李熙灿, 2017.10【前言】ABTS +·自由基(亦称ABTS +·自由基离子),并不是一个现成的试剂,无法购买。
只能通过购买粉末状ABTS 二铵盐,便将其氧化,得到ABTS +·自由基。
其反应可表示如下:N SO 3S -NH 4+C 2H 5N NNSSO 3-NH 4+C 2H 5ABTS 二铵盐(MW. 548.7)2,2′-Azino-bis(3-ethylbenzo-thiazoline-6-sulfonic acid diammonium salt)K 2S 2O 8N SO 3S -NH 4+C 2H 5N NNSSO 3-NH 4+C 2H 5- eABTS自由基图1 ABTS 二铵盐被氧化成ABTS +·自由基清除的反应式氧化剂通常是过二硫酸钾(K 2S 2O 8)。
ABTS +·自由基在734nm 处有最大吸收,所以,通常用A 734nm 来表反映ABTS +·自由基的浓度。
具体配制过程如下: 【实验流程图】图3 ABTS +·自由基清除实验流程图【文献】Xican Li, Weijuan Han, Wengqiong Mai, Li Wang. Antioxidant Activity and Mechanism of Tetrahydroamentoflavone in vitro. Natural Product Communications, 2013, 8,787-789. 【说明】1. 不论是用什么稀释,都要保证纯度,否则,有严重干扰.用不纯的水、回收的溶剂、以及质量不过关的“分析纯”试剂,都不行。
2. 到底稀释多少倍?是由A734nm值决定的。
通常在分光光度计中,A734nm值宜设为0.7左右;如是用酶标仪,A734nm值宜设为0.2左右。

DPPH•和ABTS+•自由基清除实验(含PTIO•自由基清除实验):详细说明与疑难解答李熙灿(广州中医药大学中药学院, 2019.7)(以下内容系来源于实验经验及三个参考文献[1]Li, X., Comparative Study of 1,1-Diphenyl-2-picryl-hydrazyl Radical (DPPH•) Scavenging Capacity of the Antioxidant Xanthones Family. Chemistryselect, 2018. 3,13081-13086. [2]Li, X.; Ouyang, X.; Cai, R.; Chen, D. 3’,8”-Dimerization Enhances the Antioxidant Capacity of Flavonoids: Evid ence from Acacetin and Isoginkgetin. 2019, Molecules. 24, 2039. [3]Li, X.C., 2-Phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl3-Oxid e (PTIO•) Radical Scavenging: A New and Simpl e Antioxidant Assay In Vitro. J. Agric. Food Chem., 2017. 65,6288-6297【概述】DPPH•、ABTS+•、PTIO•自由基三者,都是常用的自由基。
概述如下表:12工作液外观紫色墨绿色蓝紫色工作液紫外光谱与最大吸收2004006008000.00.51.01.52.02.53.0吸光度波长/nm519nm(50 μg/mL)2003004005006007008009000.00.51.01.52.0734nm吸光度波长/nm415nm(0.07mM (NH 4)2ABTS+0.03mM K 2S 2O 8)200400600800012吸光度波长/nm557nm(50 μg/mL)检测波长 519 nm 734nm557nm (水溶液)检测原理当A 519 nm 值减少,表明DPPH·被清除。
DPPH法测定黄芩黄酮的抗氧化活性抗氧化就是任何以低浓度存在就能有效抑制自由基的氧化反应的物质,其作用机理可以是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。
目前对自由基清除剂的研究方法主要有2类,一类是体外模型,另一类是体内模型,其中DPPH法是体外模型中最常用的方法。
DPPH又称1,1—二苯基-2—三硝基苯肼,是一种很稳定的氮中心的自由基,他的稳定性主要来自共振稳定作用的3个苯环的空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。
它的无水乙醇溶液呈紫色,在517nm波长处有最大吸收,吸光度与浓度呈线性关系.。
向其中加入自由基清除剂时,可以结合或替代DPPH·,使自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价清除自由基的能力。
即通过在517nm波长处检测样品清除DPPH·的效果,来计算抗氧化能力.实验研究表明,黄芩黄酮中清除DPPH自由基活性的主要成分是黄芩苷[1],黄芩苷中含有羧羟基和酚羟基能与DPPH反应,反应式如下:N N+O2NO2N NO2H+N NHO2NO2NNO2 DPPH与抗氧化剂反应原理材料:DPPH(1,1—二苯基—2—三硝基苯肼);无水乙醇;仪器:分光光度计1.DPPH贮备液的制备准确称取DPPH试剂3.5mg,用无水乙醇溶解,并定量转入10mL容量瓶中,用无水乙醇定容至刻度,取2mL至100ml容量瓶中,摇匀得浓度为0.0178mmol/L DPPH贮备液,置于冰箱中冷藏备用.2.试液的制备(只作参考)准确称取5。
2mg干燥的黄酮提取物(32。
75%),用无水乙醇溶解,并定量转入50ml容量瓶中,用无水乙醇定量至刻度,取10ml至100ml容量瓶中,摇匀得浓度为0.0233mmol/L试液。
3.DPPH·清除率的测定在10mL比色管中依次加入4.0mLDPPH溶液和黄酮提取液,再加入无水乙醇至刻度,混匀立即用1cm 比色皿在517nm波长处测吸光值(A),吸光值记为Ai,再在温室避光保存30min后测吸光值,记为Aj,对照试验为只加DPPH的乙醇溶液,其吸光值记为Ac.按下式计算自由基清除率(K):K(%)=[1-(Ai—Aj)/Ac]*100%试验重复三次,取其平均值作为最后结果。

1、DPPH 自由基清除实验取0.2 mL 样品,加入4 mL 醋酸缓冲溶液、3.8 mL 乙醇和2 mLDPPH,混合均匀后室温避光放置30 min,测定在517 nm 处的吸光度A。
同理,取0.2 mL 样品、4mL 醋酸缓冲溶液和3.8 mL 乙醇,测定在517nm处的吸光度A b。
4 mL 醋酸缓冲溶液、4 mL 乙醇和2 mL DPPH,测定在517 nm 处的吸光度A0。
自由基的清除率=[A0-(A-Ab)]/A0。
2、ABTS 自由基清除实验20 mL 的7 mmol/L ABTS 和352 μL 的140 nmol/L 过硫酸钾混合,在室温、避光条件下静置过夜,形成ABTS+自由基储备液。
该储备液在室温、避光的条件下稳定,使用前用无水乙醇稀释成工作液,要求其在30 ℃、734 nm 波长下的吸光度为0.7±0.02。
加入的提取液0.1 mL、ABTS 工作液5 mL,混合均匀后在室温下避光反应10 min 后,在734 nm 处测定吸光度At。
ABTS 溶液作空白吸光度为Ar,样品0.1 mL、乙醇5 mL 混合均匀吸光度为A0。
ABTS+自由基清除率(%)=[1-(At-A0)/Ar]×100式中:At 为样品的吸光值;Ar 为空白的吸光值。
3、超氧阴离子清除实验采用邻苯三酚自氧化法,取4 mL 0.1 mol/L pH8.2 Tris-HCl 缓冲溶液和蒸馏水2 mL,混匀后在25 ℃水浴中保温20min,然后加入样品溶液2 mL,取出后立即加入在25 ℃预热过的5 mmol/L 邻苯三酚0.5 mL(以10 mmol/L HCL 配制,空白管用10 mmol/L HCL 代替邻苯三酚的HCL 溶液),摇匀后倒入比色皿,325 nm下每隔30 s 测定吸光度,连续测定4 min,计算线性范围内每分钟吸光度的增加。
在加入一定体积样品溶液时,减少蒸馏水的体积。

DPPH自由基清除法/ PTIO自由基清除法李熙灿/Xican Li(广州中医药大学)[文献] Xican Li. 2-Phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl 3-oxide (PTIO•) Radical-scavenging: A New and Simple Antioxidant. Journal of Agricultural & Food Chemistry. 2017, 65, 6288−6297.Xican Li, Tingting Wang, Jingjing Liu, Yul ong Liu, Jun Zhang, Jian Lin, Zhongxiang Zhao, Dongfeng Chen. Effect and mechanism of wedel olactone as antioxidant-coumestan on •OH-treated mesenchymal stem cells. Arabian Journal of Chemistry, 2020,13:184-192.[原理] DPPH(1,1-Diphenyl-2-picrylhydrazyl radical)即1,1-二苯基-2-苦基肼基自由基。
分子中,由于存在多个吸电子的-NO2和苯环的大π键,所以,氮自由基能稳定存在。
N22当DPPH自由基被清除,其最大吸收波长519nm处的吸光度A值随之减小。
DPPH这种稳定的自由基为清除自由基活性的检测提供了一个理想而又简单的药理模型。
[实验步骤]1.1 DPPH测试液的配制取DPPH 1mg溶于约20mL溶剂(乙醇、95乙醇或甲醇)中,超声5min,充分振摇,务使上下各部分均匀。
取1mL 该DPPH溶液,在519nm处测A值,使A=1.2-1.3之间最佳。
该DPPH溶液最好避光保存,3.5小时内用完。
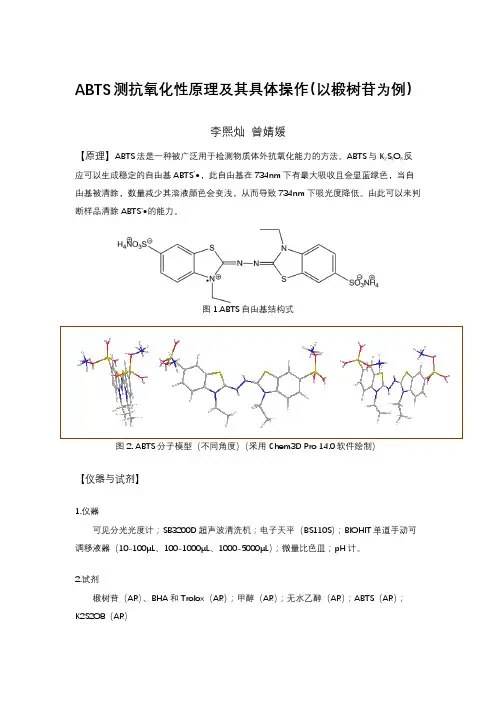
ABTS测抗氧化性原理及其具体操作(以椴树苷为例)李熙灿曾婧媛【原理】ABTS法是一种被广泛用于检测物质体外抗氧化能力的方法。
ABTS与K2S2O8反应可以生成稳定的自由基ABTS+•,此自由基在734nm下有最大吸收且会显蓝绿色,当自由基被清除,数量减少其溶液颜色会变浅,从而导致734nm下吸光度降低。
由此可以来判断样品清除ABTS+•的能力。
图1.ABTS自由基结构式图2. ABTS分子模型(不同角度)(采用Chem3D Pro 14.0软件绘制)【仪器与试剂】1.仪器可见分光光度计;SB3200D超声波清洗机;电子天平(BS110S);BIOHIT单道手动可调移液器(10-100μL、100-1000μL、1000-5000μL);微量比色皿;pH计。
2.试剂椴树苷(AR)、BHA和Trolox(AR);甲醇(AR);无水乙醇(AR);ABTS(AR);K2S2O8(AR)【试验操作】图3. 椴树苷结构式图4. 椴树苷分子模型(不同角度)(采用Chem3D Pro 14.0软件绘制)清除ABTS+·自由基检测实验采用文献[1]的方法,并根据实际情况改动。
操作如下:1 配制溶液[1]取7.4mmol/L ABTS储备液和2.6mmol/L K2S2O8储备液各1mL等体积混合,于室温、避光条件下放置12小时,即得ABTS+·自由基储备液。
先用无水乙醇稀释ABTS+·工作液,使其在734nm波长下的A(吸光度)至0.701(A=0.7±0.02,温度30℃)。
2 实验操作及测定[1]用移液器精确移取ABTS+·工作液800μL、加椴树苷(1mg/mL,无水乙醇溶解)xμL(x=40、70、100、130、160)、无水乙醇(200-x)μL于洁净的试管中,反应体系总体积1000μL,振摇10s、充分混合,静置6min,测定A734nm值。
实验平行检测三次。

PTIO和ABTS自由基的清除实验操作指南(以槲皮素为例)【前言】PTIO和ABTS自由基简介PTIO是与人体内自由基较为相似的氧自由基;而ABTS是氮自由基,虽然主要元素不同,但它们都较为稳定且随着被清除都会造成在特定波长下吸光度减小,所以常被用于检测物质体外抗氧化能力强弱。
本文详细介绍了这两种自由基清除实验的操作方法,并附有实例。
其中,PTIO自由基可以用于检测活性氧的清除能力;而ABTS自由基则适于检测活性氮的的清除能力。
(A)(B)(C)(D)图1.(A)PTIO•自由基结构式(B)ABTS•自由基结构式(C)PTIO分子模型(不同角度)(D)ABTS分子模型(不同角度)(采用Chem3D Pro 14.0软件绘制)【实验方法】1. PTIO自由基清除[1]1.1 溶液的配置PTIO试液:3mg PTIO固体+20mL 甲醇超声,混匀PTIO测试液取80μL PTIO测试液和20μL甲醇(与PTIO测试液中溶剂一致)混匀,在557nm 处测定吸光度,使吸光度保持在0.35±0.01之间。
吸光度偏大或偏小,就调节原PTIO测试液的浓度,使吸光度保持为0.35±0.01。
此吸光度为A0。
样品液:用合适溶剂溶解(一般为95乙醇或水),先配置成10mg/mL的溶液,可适当超声使之完全溶解,混合均匀。
1.2 预实验取80μL的PTIO试液,往其中加少量样品液,加样时,缓慢少量加入,边加边混合,并观察溶液褪色情况,当溶液刚刚好褪色完全,记下此时样品的加样量。
此加样量即为样品最大加样量,在此最大用量基础上,往前设置5个用量使之成为等差数列。
(如,如果最大加样量为20μL,那么对于该样品而言,其用量梯度宜设为0μL、4μL、8μL、12μL、16μL、20μL)注意事项:预实验中可能会遇到样品最大加样量很小(低于10μL),此时应该降低原样品液的浓度,再做预实验。
如果最大加样量低于10μL,可能不会得到很好的量效关系曲线。

羟基自由基(·OH)清除能力测定法的简易操作图解(适用于各种抗氧化剂)文献来源[1] Xican Li. Solvent effects and improvements in the deoxyribose degradation assay for hydroxylradical-scavenging. Food Chemistry, 2013, 141(3):2082-2088.操作图解图1 羟基自由基(·OH)清除能力测定法(脱氧核糖降解法)的实验操作图具体方法1 溶液配制0.2 MKH2PO4溶液: 100mL蒸馏水+2.7218g KH2PO4。
0.2 M Na2HPO4溶液: 500mL蒸馏水+35.814g Na2HPO4·12H2O。
磷酸盐KH2PO4-Na2HPO4缓冲液phosphate buffer(0.2M, pH7.4, 100mL):19mL0.2 MKH2PO4+ 81mL 0.2 MNa2HPO4. (注意:19:81是大概的体积比,具体的比例以pH=7.4为准)。
Na2EDTA溶液:(1mM, 25mL):8.4 mg+25mL蒸馏水。
FeCl3溶液:(3.2mM, 5mL):4.2 mg+5mL蒸馏水。
抗坏血酸溶液:(1.8mM, 50mL):15 mg+50mL蒸馏水。
H2O2溶液:(50 mM,5mL):30 mg 30% H2O2+5mL蒸馏水。
脱氧核糖溶液:(50 mM, 2 mL):15 mg脱氧核糖+2 mL蒸馏水(该用量约可做40个数据) 。
三氯乙酸溶液TCA(10%, 10 mL):1 g + 10 mL蒸馏水。
硫代巴比妥酸溶液TBA:(5%, W/V, 20mL):取1gTBA+20mL蒸馏水+20mgNaOH (临用时配,超声溶解. 该用量可做40个数据) 。
样品溶液:选合适的溶剂(如甲醇、无水乙醇等),先配成1mg/mL的溶液试试。
D P P H自由基清除测定(总2页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--DPPH 法测定黄芩黄酮的抗氧化活性抗氧化就是任何以低浓度存在就能有效抑制自由基的氧化反应的物质,其作用机理可以是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。
目前对自由基清除剂的研究方法主要有2类,一类是体外模型,另一类是体内模型,其中DPPH 法是体外模型中最常用的方法。
DPPH 又称1,1-二苯基-2-三硝基苯肼,是一种很稳定的氮中心的自由基,他的稳定性主要来自共振稳定作用的3个苯环的空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。
它的无水乙醇溶液呈紫色,在517nm 波长处有最大吸收,吸光度与浓度呈线性关系。
向其中加入自由基清除剂时,可以结合或替代DPPH ·,使自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价清除自由基的能力。
即通过在517nm 波长处检测样品清除DPPH ·的效果,来计算抗氧化能力。
实验研究表明,黄芩黄酮中清除DPPH 自由基活性的主要成分是黄芩苷[1],黄芩苷中含有羧羟基和酚羟基能与DPPH 反应,反应式如下:N N +O 2NO 2N NO2H +N NHO 2N O 2NNO 2DPPH 与抗氧化剂反应原理材料:DPPH (1,1-二苯基-2-三硝基苯肼);无水乙醇; 仪器:分光光度计1.DPPH 贮备液的制备准确称取DPPH 试剂3.5mg ,用无水乙醇溶解,并定量转入10mL 容量瓶中,用无水乙醇定容至刻度,取2mL 至100ml 容量瓶中,摇匀得浓度为/L DPPH 贮备液,置于冰箱中冷藏备用。
2.试液的制备(只作参考)准确称取干燥的黄酮提取物(%),用无水乙醇溶解,并定量转入50ml 容量瓶中,用无水乙醇定量至刻度,取10ml 至100ml 容量瓶中,摇匀得浓度为/L 试液。
主要目的:——为了测定样品清除ABTS自由基的能力。
主要原理:——用 K2S2O8与 ABTS 直接生成稳定的阳离子自由基 ABTS+,抗氧化物质与ABTS+发生反应而使反应体系褪色。
实验室签章一、试剂——K2S2O8水溶液——ABTA溶液——乙醇(分析纯)——PBS 溶液二、仪器设备——96孔酶标板——UV-Vis可见多功能酶标仪——移液枪——200 µL量程枪头三、实验方法◆前期准备ABTS储备液(7.4 mmol/L)取ABTS 96 mg,加蒸馏水25 mL。
K 2S2O8储备液(2.6 mmol/L)取K2S2O8378.4 mg,加蒸馏水10 mL。
将5 ml 7.4 mmol/L ABTS储备液与88 µL 2.6 mmoL/L K2S2O8混匀,静置12-16小时,配制成ABTS工作液。
◆ABTS自由基清除法0.4 mL ABTS工作液,用 PBS 溶液稀释,要求在常温下734nm 处吸光值为0.7±0.02。
0.2 mL ABTS+·工作液与 10uL 不同浓度受试物混合,常温避光静置 6min,在 734 nm 波长处测吸光度,平行3次。
ABTS自由基清除能力由下式计算:清除率(%)=[A0-Ai/A]×100%式中: A0为不加样品,加入 ABTS 的吸光度;Ai为加入样品和 ABTS 的吸光度(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。
常见体外抗氧化实验方法(含原理、试剂配制、操作流程、实例分析、英文表述)- 2023-3①DPPH·自由基清除法 2 Array②ABTS·+自由基清除法 5③ FRAP法(铁还原法) 811④过氧自由基(超氧自由基,·O2-)清除法(连苯三酚自氧化法)⑤羟基自由基(·OH)清除法(脱氧核糖法) 14⑥PTIO·自由基清除法(水溶液中) 16⑦ CUPRAC法(铜还原法) 18⑧铁络合能力(Ferrozin法) 20⑨脂质过氧化清除法(亚油酸为底物) 23⑩抗氧化产物的预测26①DPPH·自由基清除法/DPPH法原理:DPPH·(1,1-Diphenyl-2-picrylhydrazyl radical)即α, α-二苯基-β-苦基肼基游离基,由于p-π共轭,所以,氮自由基能稳定存在[1]。
当DPPH自由基被某物质清除,其最大吸收波长519nm处的吸光度A值随之减小;相应地,某物质自由基清除活性增加,其体外抗氧化活性也增加。
实验操作[1]:1.1 DPPH测试液的配置(适用于酶标仪测量,总体积为100μL)取DPPH 2毫克溶于约40mL溶剂(乙醇、95乙醇或甲醇)中,超声5min,充分振摇,务使上下各部分均匀。
取DPPH溶液80μL加入到96孔板中,加95乙醇(或无水乙醇)20μL,稀释混合,测A值,使A=0.20±0.01。
该DPPH溶液避光保存,4h内用完。
(注意:如果是用分光光度计.....,则A=0.6±0.02比较合适)1.2 样品液的配置样品用合适的溶剂溶解,为便于计算,可配成1mg/mL浓度。
溶剂根据样品的极性进行选择,首选95乙醇或无水乙醇,如不溶可用DMSO。
1.3 预试取DPPH溶液80μL,往其中加少量样品液,加样时,先少后多渐加,边加边混合,并观察溶液的褪色情况,当溶液颜色基本褪去时,记下样品的加样量。
DPPH和ABTS、PTIO⾃由基清除实验-操作图解-李熙灿-Xican-LiDPPH?和ABTS+?⾃由基清除实验(含PTIO?⾃由基清除实验):详细说明与疑难解答李熙灿(⼴州中医药⼤学中药学院, 2019.7)(以下内容系来源于实验经验及三个参考⽂献[1]Li, X., Comparative Study of 1,1-Diphenyl-2-picryl-hydrazyl Radical (DPPH?) Scavenging Capacity of the Antioxidant Xanthones Family. Chemistryselect, 2018. 3,13081-13086. [2]Li, X.; Ouyang, X.; Cai, R.; Chen, D. 3’,8”-Dimerization Enhances the Antioxidant Capacity of Flavonoids: Evid ence from Acacetin and Isoginkgetin. 2019, Molecules. 24, 2039. [3]Li, X.C., 2-Phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl3-Oxid e (PTIO?) Radical Scavenging: A New and Simpl e Antioxidant Assay In Vitro. J. Agric. Food Chem., 2017. 65,6288-6297【概述】DPPH?、ABTS+?、PTIO?⾃由基三者,都是常⽤的⾃由基。
概述如下表:⼯作液外观紫⾊墨绿⾊蓝紫⾊⼯作液紫外光谱与最⼤吸收2004006008000.00.51.01.52.02.53.0吸光度波长/nm519nm(50 µg/mL)2003004005006007008009000.00.51.01.52.0734nm吸光度波长/nm415nm(0.07mM (NH 4)2ABTS+0.03mM K 2S 2O 8)2004006008002吸光度波长/nm557nm(50 µg/mL)检测波长 519 nm 734nm557nm (⽔溶液)检测原理当A 519 nm 值减少,表明DPPH·被清除。
ABTS自由基清除/PTIO自由基清除实验:实验流程图2018.4(含ABTS自由基配制方法)图1 ABTS自由基清除实验和PTIO自由基清除实验的流程图【说明】体内(细胞内)的自由基,可以分为两类:活性氧(ROS,Reactive oxygen species)和活性氮(RNS,Reactive nitrogen species)。
ROS主要有羟基自由基·OH,过氧自由基(·O2-),脂质过氧自由基(LOO·)等;RNS主要有一氧化氮(·NO)等。
这些ROS和RNS如果过量堆积,会引起氧化应激,发生各种病变,加速机体衰老。
许多药用植物的提取物,能清除ROS和RNS。
这种清除作用可以缓解氧化应激,故称为抗氧化。
上述提到的RNS 和ROS其实,都是不稳定的(如·OH,·O2-, LOO·,·NO),很难直接用于抗氧化评价实验。
ABTS自由基清除法是最常见的用于评价药用植物或纯化合物的抗氧化活性的一种方法,因为,ABTS+·自由基较稳定,稳定的ABTS+·自由基的甲醇或乙醇溶液呈深紫红色,并在734 nm范围有最大吸收峰。
当向ABTS 自由基溶液中加入自由基清除剂(抗氧化剂)时,成单被配对, ABTS自由基溶液褪色,734nm波长处的吸收值降低,可以用分光光度计测定。
ABTS自由基之所以稳定,由于N原子上那个成单电子,可以与苯环形成p-π共轭。
ABTS +·自由基(亦称ABTS +·自由基离子),并不是一个现成的试剂。
只能通过粉末状ABTS 二铵盐,将其氧化,才能得到ABTS +·自由基。
其反应可表示如下:图2 ABTS 二铵盐被氧化成ABTS +·自由基清除的反应式从结构式中可以看也,其成单电子位于N 原子上,所以,是RNS 而不是ROS 。
所以, 严格讲,ABTS 法只能用于评价RNS 清除水平而不是ROS 清除水平。
DPPH•和ABTS+•自由基清除实验(含PTIO•自由基清除实验):详细说明与疑难解答李熙灿(广州中医药大学中药学院, 2019.7)(以下内容系来源于实验经验及三个参考文献[1]Li, X., Comparative Study of 1,1-Diphenyl-2-picryl-hydrazyl Radical (DPPH•) Scavenging Capacity of the Antioxidant Xanthones Family. Chemistryselect, 2018. 3,13081-13086. [2]Li, X.; Ouyang, X.; Cai, R.; Chen, D. 3’,8”-Dimerization Enhances the Antioxidant Capacity of Flavonoids: Evid ence from Acacetin and Isoginkgetin. 2019, Molecules. 24, 2039. [3]Li, X.C., 2-Phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl3-Oxid e (PTIO•) Radical Scavenging: A New and Simpl e Antioxidant Assay In Vitro. J. Agric. Food Chem., 2017. 65,6288-6297【概述】DPPH•、ABTS+•、PTIO•自由基三者,都是常用的自由基。
概述如下表:工作液外观紫色墨绿色蓝紫色工作液紫外光谱与最大吸收2004006008000.00.51.01.52.02.53.0吸光度波长/nm519nm(50 μg/mL)2003004005006007008009000.00.51.01.52.0734nm吸光度波长/nm415nm(0.07mM (NH 4)2ABTS+0.03mM K 2S 2O 8)200400600800012吸光度波长/nm557nm(50 μg/mL)检测波长 519 nm 734nm557nm (水溶液)检测原理当A 519 nm 值减少,表明DPPH·被清除。
其清除机制主要是氢转移HAT (hydrogen atom transfer) 当A 734nm 值减少,表明ABTS·+被清除。
其清除机制主要是电子转移ET (el ectron transfer)当A 557减少,表明ABTS·+被清除。
其清除机制主要是电子移ET (electron transfer)加质子转移PT (proton transfer)用途主要用于测试一个纯的化合物或者提取物,是否具有抗氧化活性或者活性的强弱。
主要用于测试一个纯的化合物或者提取物,是否具有抗氧化活性或者活性的强弱。
主要用于测试一个纯的化合物或者提取物,是否具有抗氧化活性或者活性的强弱。
通过调节缓冲液的pH 值,可以检测其抗氧化机制。
优势清除速度较快,约30分钟(室温下)。
清除速度较快,约6分钟(室温下)。
(1)水溶性好,与生物相关性强;(2)是氧自由基,能更好地表往ROS 清除水平;(3)抗氧化机制明确:pH 值小于5.0时,为电子转移ET 机制。
当调节pH 值(如pH=5.0,6.0,7.4)时,其清除能力也随之改变,表明与pH 值有关,也就是说与氢离子(质子)浓【实验讲解】1.DPPH•自由基清除实验[1]1.1 DPPH测试液的配置取DPPH固体1mg溶于24mL 95乙醇(或无水乙醇、甲醇)中,超声5min,充分振摇,务使上下各部分均匀。
最好避光保存,5小时内用完。
取1mL上述步骤配置好的DPPH溶液,加0.5mL 95乙醇(或无水乙醇、甲醇)稀释后,使其吸光度为0.6-1.0之间。
若吸光度过大,则继续加溶剂;若吸光度过小,则补加DPPH固体或者原始溶液。
1.2 样品液的配置样品用合适的溶剂溶解,为便于计算,可配成1mg/mL浓度。
溶剂根据样品的极性进行选择,首选甲醇、95乙醇或无水乙醇(尽量与DPPH溶液所用溶剂相同),如不溶可用DMSO。
1.3 预试取DPPH溶液1.0 mL,加0.5mL相应有机溶剂后,往其中加少量样品液。
加样时,先少后多渐加,边加边混合,并观察溶液的褪色情况,当溶液颜色基本褪去时,记下样品的加样量。
如果反应缓慢可在37℃烘箱中放置半个小时。
此加样量即为样品的最大用量,在此最大用量的基础上,往前设置5个用量,使之成等差数列。
【如】在预试过程中,发现加样到500 μL时,DPPH溶液颜色基本褪去,则500 μL为该样品液的最大用量。
则对于该样品而言,其用量梯度宜设为100 μL、200 μL、300 μL、400 μL、500 μL。
A0值:取DPPH溶液1.0 mL到比色皿中,加对应有机溶剂0.5 mL,稀释混合,测A值,此A值为A0(A0须在0.8-1.0之间)。
A值:取(500-x)μL 有机溶剂到比色皿中,加样品液x μL (x是根据1.3预试结果确定样品液的用量),再加DPPH溶液1.0 mL,混合使反应液总体积为1.5 mL。
测A值。
【如】某样品的用量梯度为100 μL、200 μL、300 μL 、400 μL、500 μL,则加样如下:样品液95乙醇(或无水乙醇)DPPH测试液总体积0μL 100μL 500 μL400 μL1.0 mL1.0 mL1.5 mL1.5 mL200μL300 μL 1.0 mL 1.5 mL 300μL200 μL 1.0 mL 1.5 mL 400μL100 μL 1.0 mL 1.5 mL 500μL0 μL 1.0 mL 1.5 mL 1.4 最终测量每测一个用量需要测三个平行数据。
1.5 DPPH•清除率(抑制率)的计算00=100A AA -⨯清除率%(A 0为不加样品时的值;A 为加入样品后的值。
)1.6 使用注意事项 1.6.1 测量前,要先用空白溶剂调零。
1.6.2 将溶液注入比色皿后应当充分摇匀,使颜色均匀分布。
1.6.3 每次使用前后要注意比色皿的清洁。
1.6.4 如果在实验过程中出现A 值大于A 0的情况,则可能是由于样品本身产生的本底吸收所致,此时,应该减去本底吸收的A 值(A 本)。
这个A 本值可以通过,加样品但不加DPPH 的方法测得。
此时的计算公式为:00()=100A A A A --⨯本清除率%1.7 疑难解答问:DPPH 实验测量抗氧化性的原理是什么?答:DPPH 法于1958年被提出,广泛用于定量测定生物试样、分类药物和食品的抗氧化能力。
此法是根据DPPH 自由基有单电子,在519nm 处有一强吸收,其醇溶液呈紫色的特性。
当有抗氧化剂存在时,DPPH 自由基被清除,溶液颜色减淡,其褪色程度与其被清除程度(即吸光度的改变)成定量关系,因而可用分光光度计或酶标仪进行快速的定量分析。
问:DPPH 自由基被清除的机制是什么?答:DPPH 自由基的清除过程主要涉及到氢转移(HAT ),简要过程如下(以1,3,5,8-四羟基氧杂蒽酮为例):问:实验中的溶剂应该怎么确定?答:优先选用甲醇、95乙醇或无水乙醇溶解DPPH固体和样品,若样品难溶于水和醇,再考虑DMSO等溶剂。
值得注意的是,实验中应该尽量保证样品溶液和DPPH溶液使用相同的溶剂。
另两个实验(ABTS+•清除和PTIO•清除)同理。
问:样品的浓度一定要设置成1mg/mL吗?答:不同样品清除DPPH自由基的活性可能相差很大,为了保证结果的准确,应该尽量使样品的五个浓度点对DPPH•清除率均匀分布在0-100%之间,因此1mg/mL只是一个大概数值,实验中要根据预试结果进行调整。
由于1 mg/mL这个数字方便稀释和计算,因此在这里统一写作1mg/mL。
另两个实验(ABTS+•清除和PTIO•清除)同理。
问:测量完成后怎么计算IC50答:IC50值是指清除50%的自由基,所需要的样品的最终浓度。
有两种计算方法。
第一,以实验所得的抗氧化剂浓度为横坐标,清除率为纵坐标,然后计算线性回归方程。
将清除率50%代入方程中求得对应的横坐标值即为IC50值,注意最终结果将三次或三次以上的平行试验取平均值。
第二,通过浓度曲线的图直接读出。
在50%处画一横线,此横线与曲线的模拟线的交点的对应的横坐标,即IC50.另两个实验(ABTS+•清除和PTIO•清除)同理。
问:为什么要用Trolox作为阳性对照?答:维生素E(生育酚)是常见的抗氧化剂。
不过,维生素E难溶于水,而且易变质。
为此,化学家将其结构进行修饰,即得Trolox(化学名称:6-羟基-2,5,7,8-四甲基色烷-2-羧酸)。
Trolox不仅溶于水,而且易溶于有机溶剂,所以,广泛地用作抗氧化剂的阳性对照物。
亦称水溶性维生素E。
为了方便对比评价所测物质的抗氧化能力,通常采用Trolox作为DPPH自由基清除实验的阳性对照品。
另两个实验(ABTS+•清除和PTIO•清除)同理。
问:为什么会出现清除率为负值的情况?答:样品的活性太弱,所以,加入的样品的量较多;如果这个样本身在519nm处有吸收的话,就会产生一个可观的A值,导致A>A0,清除率为负。
问:DPPH•清除率会大于100%吗?答:不可能。
1.8实例茶黄素清除DPPH•量效曲线图(Microcal Origin 绘制):D P P H 清除率 %最终浓度 μg/mL2. ABTS·+自由基清除实验[2] 2.1 溶液配制 2.1.1 ABTS 二铵盐储备液(7.4 mmol/L):取ABTS 二铵盐 3 mg ,加蒸馏水0.735mL 。
(MW =548.7) 2.1.2 过二硫酸钾(K 2S 2O 8)储备液(2.6 mmol/L):取K 2S 2O 8 1mg ,加蒸馏水1.43 mL 。
(MW =270.32) 2.1.3 取0.2mL ABTS 二铵盐储备液和0.2mL K 2S 2O 8储备液混合,黑暗环境下室温放置12小时,用pH7.4磷酸盐缓冲液将混合液稀释10-20倍直至吸 光度为0.70±0.02,此溶液即为ABTS•+自由基工作液。
(注:也可以用95乙醇或无水乙醇,但必须是原装分析纯试剂,回收或重蒸者均不可用。
) 2.2 样品液的配置 样品用合适的溶剂溶解,为便于计算,可配成1 mg/mL 浓度。
溶剂根据样品的极性进行选择,首选95乙醇或无水乙醇,如不溶可用DMSO 。
2.3 预试 取ABTS•+自由基工作液0.8 mL ,往其中加少量样品液,加样时,先少后多渐加,边加边混合,并观察溶液的褪色情况,当溶液颜色基本褪去时,记下样品的加样量。