蛋白过镍柱纯化的原理和步骤
- 格式:doc
- 大小:19.50 KB
- 文档页数:2

蛋白镍柱二次纯化是一种常用的蛋白质纯化技术,其原理是利用镍离子与蛋白质表面的配位键结合,形成镍-蛋白质复合物,从而将蛋白质从复杂的混合物中分离出来。
以下是关于蛋白镍柱二次纯化的一个详细介绍:首先,我们需要了解蛋白镍柱的基本原理和操作步骤。
在操作之前,需要准备所需的试剂和设备,如缓冲液、镍柱、洗脱液、离心机、电导率仪等。
第一步是样品处理。
将待纯化的蛋白质样品进行稀释或浓缩处理,使其达到合适的浓度。
然后将稀释后的样品加入镍柱中,通过恒压泵将缓冲液冲洗柱子,使样品与镍柱结合。
接下来是分离蛋白质的过程。
随着冲洗液的不断流入,镍-蛋白质复合物逐渐被洗脱并进入收集器中。
此时,可以通过电导率仪监测洗脱液的电导率,以确定哪个时间段洗脱的蛋白质纯度最高。
纯化后的蛋白质可以通过凝胶电泳进行检测。
在凝胶电泳中,可以根据蛋白质的分子量大小和位置来确定其纯度。
如果蛋白质纯度不够,可以调整洗脱液的比例或更换新的镍柱进行二次纯化。
在进行蛋白镍柱二次纯化时,需要注意一些关键点。
首先,第一次纯化时,需要选择合适的缓冲液和洗脱液,以确保镍-蛋白质复合物的有效分离。
其次,在第二次纯化时,需要根据第一次纯化的结果和蛋白质的性质进行调整,以确保最佳的纯化效果。
此外,还需要注意镍柱的保存和使用方法,避免长时间暴露在空气中或受到污染。
最后,蛋白镍柱二次纯化完成后,得到的蛋白质样品可用于进一步的研究或应用。
例如,可以将其用于细胞实验、动物实验或临床试验中,以验证其作用机制或评估其疗效。
总之,蛋白镍柱二次纯化是一种有效的蛋白质纯化技术,可用于从复杂的混合物中分离高纯度的蛋白质。
在进行二次纯化时,需要注意关键点的调整和注意事项,以确保最佳的纯化效果。
最终得到的蛋白质样品可用于进一步的研究和应用中,为科学研究和药物开发提供有力支持。

his镍柱纯化蛋白的原理His镍柱纯化蛋白是一种常用的蛋白质纯化方法,其原理是利用镍离子与蛋白质中的组氨酸残基之间的亲和性来实现纯化。
下面将详细介绍His镍柱纯化蛋白的原理及其应用。
在蛋白质纯化过程中,常常需要将目标蛋白从复杂的混合物中分离出来。
His标签是一种常用的蛋白质标签,其序列为(His)n,其中n 通常为6。
His标签在蛋白质表达系统中可以通过基因工程技术与目标蛋白的N或C端融合,从而使目标蛋白具有His标签。
His镍柱纯化蛋白的原理是利用镍离子与His标签之间的亲和性来进行分离纯化。
His标签中的组氨酸残基(His)具有亲和性,可以与镍离子配位形成稳定的络合物。
在纯化过程中,镍柱通常是由氮化镍(Ni-NTA)或者螯合纤维素(Chelating Sepharose)制成。
这些柱子中的镍离子与His标签之间形成络合物,将目标蛋白固定在柱子上,其他杂质则通过洗脱缓冲液被洗脱掉。
His镍柱纯化蛋白的步骤一般包括柱子平衡、样品加载、洗脱和再平衡。
首先,将镍柱用洗脱缓冲液进行平衡,以保证柱子表面的镍离子与缓冲液中的杂质结合。
然后,将待纯化的样品通过柱子,目标蛋白与镍离子形成络合物固定在柱子上,而其他杂质则被洗脱缓冲液冲掉。
接下来,通过改变洗脱缓冲液的条件(如pH值、离子浓度等),使目标蛋白与镍离子的络合物解离,从而实现目标蛋白的洗脱。
最后,通过再平衡缓冲液将柱子恢复到平衡状态,以备下一次使用。
His镍柱纯化蛋白具有一些优点。
首先,His标签广泛应用于不同的表达系统,包括大肠杆菌、酵母、哺乳动物细胞等,因此适用范围广泛。
其次,His标签对目标蛋白的结构和功能没有明显影响,因此纯化的蛋白质具有较高的活性和稳定性。
此外,His镍柱纯化蛋白的操作相对简单,纯化效果较好,可以高效地从复杂的混合物中纯化出目标蛋白。
除了纯化蛋白外,His镍柱还可以用于蛋白质相互作用的研究。
通过将不同蛋白质分别融合His标签,可以将其同时固定在同一根镍柱上,从而实现蛋白质相互作用的检测。

镍柱纯化蛋白的原理
镍柱纯化蛋白的原理是基于镍离子与组成蛋白质的氨基酸残基中的亮氨酸、组氨酸和半胱氨酸之间的特异性相互作用。
这种相互作用可以用于在蛋白质分子混合物中选择性地捕获富含这些亮氨酸、组氨酸和半胱氨酸的目标蛋白质,而对其他蛋白质几乎没有选择性。
镍柱纯化的主要步骤包括:
1. 将镍离子配位到金属柱介质上,形成镍柱。
2. 将目标蛋白质样品与镍柱接触,使目标蛋白质与镍柱表面的镍离子发生相互作用。
3. 通过洗脱步骤,将非特异性结合在镍柱上的蛋白质去除,保留特异性结合的目标蛋白质。
4. 被特异性结合的目标蛋白质可通过改变温度、改变洗脱缓冲液的 pH 值、改变洗脱缓冲液中镍离子的浓度或其他方法来解离。
镍柱纯化蛋白的原理是基于镍离子与目标蛋白质中特定氨基酸残基的配位作用,利用这种特异性相互作用可以实现对目标蛋白质的选择性纯化。
由于镍柱纯化具有高选择性和高亲和力,因此被广泛应用于蛋白质纯化过程中。

镍柱蛋白纯化镍柱蛋白纯化是一种常用的基于亲和层析的蛋白纯化方法,它通过靶蛋白的亲和性与含有Ni2+离子的镍柱发生相互作用,从而实现靶蛋白的分离与纯化。
本文将介绍镍柱蛋白纯化的基本原理、实验步骤以及注意事项。
基本原理镍柱蛋白纯化基于亲和层析的基本原理。
亲和层析是一种根据靶蛋白的化学或生物特性选择性地捕捉分离靶蛋白的方法。
镍柱蛋白纯化利用含有Ni2+离子的亲和层析介质作为捕捉靶蛋白的载体。
由于Ni2+离子与组蛋白中的组氨酸以及其他氨基酸存在较强的亲和力,镍柱中的Ni2+离子能够与靶蛋白中含有组氨酸或其他靠近组氨酸的官能团结合,实现了靶蛋白的分离纯化。
实验步骤镍柱蛋白纯化的实验步骤如下:1.细胞裂解与分离:首先需要将选择的表达靶蛋白的菌株用化学或机械方法破裂,并从细胞裂解液中分离靶蛋白。
2.杂质去除:利用超速离心等手段,去除裂解液中的大量无关蛋白质,以减少后续纯化的杂质。
3.镍柱柱层析:将镍柱填充到层析柱中,使之平衡,然后将分离的靶蛋白通过柱层析,利用其与镍柱中Ni2+离子的亲和力捕捉纯化。
4.洗脱:通过改变缓冲条件(如pH、盐浓度等),使得捕获靶蛋白的镍柱发生变化,最终使其与捕获的蛋白离开。
5.透析:将洗脱得到的靶蛋白透析回目标缓冲液中,以去除与纯化过程中引入的杂质。
注意事项1.掌握柱层析的平衡、清洗和洗脱条件,以避免蛋白质在分离过程中被损坏。
2.需要选择合适的表达菌株、表达载体以及诱导条件,以提高目标蛋白质的表达水平和纯化效率。
3.超速离心过程中,建议在4°C下高速离心,以避免破坏蛋白质结构。
4.纯化过程中需要掌握蛋白质的稳定状态和活性,以确保最终得到的蛋白质具有高纯度和活性。
镍柱蛋白纯化是一种常用的基于亲和层析的蛋白纯化方法,该方法可以高效地从蛋白质混合物中纯化高丰度、高质量的靶蛋白质。
在实验过程中,需要注意掌握柱层析、表达菌株选择、超速离心和掌握蛋白质的稳定状态和活性等方面的技巧,以获得高质量的纯化结果。

镍柱纯化蛋白的原理
镍柱纯化蛋白是一种常用的蛋白纯化方法,它利用镍离子与蛋白质中的组氨酸残基之间的亲和作用来实现对目标蛋白的选择性结合和纯化。
镍柱纯化蛋白的原理主要包括柱填料的选择、蛋白质与镍离子的相互作用、洗脱条件的优化等方面。
下面将详细介绍镍柱纯化蛋白的原理。
首先,柱填料的选择至关重要。
镍柱通常采用的填料是带有螯合镍离子的亲和树脂,如Ni-NTA琼脂糖。
这种填料能够与蛋白质中的组氨酸残基形成配位键,从而实现对目标蛋白的选择性结合。
在选择柱填料时,需要考虑目标蛋白的特性以及实验条件,以确保最佳的纯化效果。
其次,蛋白质与镍离子的相互作用是实现纯化的关键。
蛋白质中的组氨酸残基与镍离子之间存在亲和作用,这种作用是通过非共价键来实现的。
在纯化过程中,目标蛋白与镍离子结合后,非特异性结合的杂质蛋白可以通过洗脱条件的优化来去除,从而实现对目标蛋白的高效纯化。
最后,洗脱条件的优化对于蛋白的纯化效果至关重要。
在选择洗脱条件时,需要考虑目标蛋白与填料的结合强度,以及非特异性结合的杂质蛋白与填料的结合情况。
通常采用梯度洗脱的方法,通过改变洗脱缓冲液的pH值、离子强度或镍离子浓度来实现对目标蛋白的高效洗脱。
总之,镍柱纯化蛋白是一种基于亲和作用原理的蛋白纯化方法,其原理包括柱填料的选择、蛋白质与镍离子的相互作用以及洗脱条件的优化。
通过合理选择柱填料、优化结合和洗脱条件,可以实现对目标蛋白的高效纯化,为蛋白质研究提供了重要的技术支持。

镍柱亲和层析蛋白纯化步骤镍柱亲和层析蛋白纯化步骤镍柱亲和层析蛋白纯化步骤
嘿,朋友们!今天咱们来聊聊镍柱亲和层析蛋白纯化的那些事儿。
这可是个超级有趣又神奇的过程哦!
呢,咱们得把准备工作做好。
就像要出门旅行得先收拾行李一样。
咱们得有新鲜干净的镍柱,还有各种试剂和设备都得准备齐全,别到时候手忙脚乱的。
然后呀,就是处理样品啦。
这样品就像是一群调皮的小孩子,咱们得让它们乖乖听话。
把含有目标蛋白的样品处理好,去除那些杂质和不需要的东西,让咱们的目标蛋白能够更加突出。
等它们接触得差不多了,就得开始清洗柱子啦。
这就像是给柱子洗个澡,把那些没有结合上的杂质都冲掉。
用各种缓冲液慢慢地冲洗,把柱子洗得干干净净的。
在整个过程中,咱们可得时刻盯着,就像看着自己心爱的宝贝一样。
注意观察各种现象,看看颜色有没有变化,流速是不是正常。
要是有啥不对劲的,赶紧想办法解决。
呢,收集到的目标蛋白还得进行检测和分析,看看纯度够不够高,质量好不好。
如果一切都很完美,那咱们就可以欢呼庆祝啦!
怎么样,朋友们,镍柱亲和层析蛋白纯化是不是很有趣呀?只要咱们一步一步认真做,就能得到咱们想要的纯净蛋白,为后续的实验打下坚实的基础!加油吧,小伙伴们!。

镍柱亲和层析的原理和应用1. 简介镍柱亲和层析(Nickel affinity chromatography)是一种常用的蛋白质纯化技朧。
它基于镍离子(Ni2+)与蛋白质中的组氨酸残基的亲和作用,通过有选择性地结合目标蛋白质,从而实现纯化的目的。
2. 原理镍柱亲和层析的原理基于金属离子和蛋白质之间的配位作用。
其主要步骤如下:- 第一步:将镍离子通过某种方法固定在层析树脂上,形成镍柱。
- 第二步:将含有目标蛋白质的混合物(如细胞裂解液)加入镍柱。
- 第三步:目标蛋白质中的组氨酸残基与镍离子发生配位作用,与镍柱发生结合。
- 第四步:通过洗脱步骤,将非特异结合的蛋白质洗脱,使得目标蛋白质获得高纯度。
3. 应用镍柱亲和层析在生命科学领域中有着广泛的应用,以下是一些常见的应用领域:3.1 蛋白质纯化•镍柱亲和层析广泛应用于蛋白质的纯化过程中,尤其适用于具有组氨酸残基的目标蛋白质。
•通过调节洗脱条件,可以实现高纯度的蛋白质获取。
3.2 基因工程•在基因工程领域中,镍柱亲和层析常用于蛋白质表达和纯化的过程中。
•通过融合镍柱亲和标签(如His标签)到目标蛋白质上,可以方便地进行纯化和提取。
3.3 药物研发•镍柱亲和层析在药物研发中也有重要应用。
•在药物筛选和药效评估过程中,可以利用镍柱亲和层析纯化目标蛋白质,进一步了解药物与蛋白质的相互作用机制。
3.4 生化分析•镍柱亲和层析还可用于生化分析。
•通过分离纯化目标蛋白质,可以进一步对其结构、功能进行研究。
3.5 蛋白质相互作用研究•镍柱亲和层析可用于研究蛋白质与其他分子的相互作用。
•通过纯化目标蛋白质和结合物质,可以研究其作用机制以及相互作用的影响因素。
4. 优势和局限性4.1 优势•镍柱亲和层析方法简单、快速,可大量并行操作,适用于高通量纯化。
•镍离子和组氨酸之间的亲和作用具有较高的选择性,可提供高纯度的目标蛋白质。
4.2 局限性•镍柱亲和层析仅适用于具有组氨酸残基的目标蛋白质,不适用于其他类型的蛋白质。

ni柱纯化蛋白原理
柱纯化蛋白是一种常用的蛋白质纯化方法,可以根据蛋白质的特性选择适合的纯化柱。
柱纯化通常包括以下几个步骤:
1. 样品的制备:首先,需要从细胞或组织中提取蛋白质。
这可以通过破碎细胞壁,使用溶解液将细胞或组织中的蛋白质释放出来。
2. 柱填充物的选择:根据蛋白质的特性,选择合适的柱填充物。
柱填充物可以是树脂、凝胶或金属离子,具体选择取决于目标蛋白质的理化性质。
3. 样品加载:将样品加载到柱上。
加载时要确保样品中的杂质尽可能少,以提高纯化效果。
4. 洗脱:根据目标蛋白质的亲和性选择适当的洗脱缓冲液来洗脱非特异结合的蛋白质。
洗脱缓冲液通过改变pH、离子强度
或添加络合剂等方式可以使目标蛋白质从柱上洗脱下来。
5. 储存或进一步分析:经过柱纯化后的蛋白质可以直接用于进一步的实验或储存。
柱纯化蛋白的原理是基于蛋白质与柱填充物之间的相互作用。
柱填充物可以通过静电相互作用、氢键、疏水作用等与蛋白质结合,从而实现蛋白质的分离和纯化。
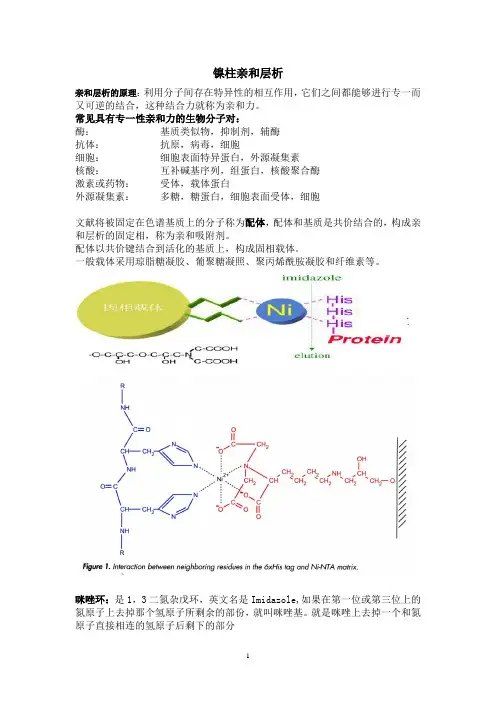
镍柱亲和层析亲和层析的原理:利用分子间存在特异性的相互作用,它们之间都能够进行专一而又可逆的结合,这种结合力就称为亲和力。
常见具有专一性亲和力的生物分子对:酶:基质类似物,抑制剂,辅酶抗体:抗原,病毒,细胞细胞:细胞表面特异蛋白,外源凝集素核酸:互补碱基序列,组蛋白,核酸聚合酶激素或药物:受体,载体蛋白外源凝集素:多糖,糖蛋白,细胞表面受体,细胞文献将被固定在色谱基质上的分子称为配体,配体和基质是共价结合的,构成亲和层析的固定相,称为亲和吸附剂。
配体以共价键结合到活化的基质上,构成固相载体。
一般载体采用琼脂糖凝胶、葡聚糖凝照、聚丙烯酰胺凝胶和纤维素等。
咪唑环:是1,3二氮杂戊环,英文名是Imidazole,如果在第一位或第三位上的氮原子上去掉那个氢原子所剩余的部份,就叫咪唑基。
就是咪唑上去掉一个和氮原子直接相连的氢原子后剩下的部分组氨酸的性质:具有弱疏水性、咪唑环为弱电性。
金属离子:Cu2+、Ni2+、Zn2+、Co2+等过渡金属离子可与N、S和O等供电原子产生配位键,因此可与蛋白质表面的组氨酸(His)的咪唑基、半胱氨酸(Cys)的巯基和色氨酸(Trp)的吲哚基发生亲和结合作用,其中以His的咪唑基的结合作用最强。
过渡金属离子与咪唑基的结合强弱顺序是Cu2+>Ni2+>Zn2+≥Co2+ 。
镍离子:有六个螯合价位,通常将镍柱分为了Ni-NTA和Ni-IDA。
Ni-NTA螯合了四价,剩余两价;而Ni-IDA螯合三价,剩余三价。
因此Ni-IDA Agarose结合作用力要比Ni-NTA Agarose强,在同样条件下Ni-IDA Agarose的载量要比Ni-NTA 高,而且洗脱杂质和目标蛋白所用的缓冲液中咪唑浓度更高;但Ni-NTA 更稳定,耐受更强的还原剂,镍离子更不易脱落。
因此需要根据不同的纯化条件选择纯化所需的镍柱,以达到纯化的最佳效果。
基质:①不溶性的多孔网状结构,渗透性好;②物理和化学稳定性高,有较高的机械强度,使用寿命长;③抗微生物和酶的侵蚀;④最好为粒径均一的球形粒子;⑤具有亲水性,无非特异性吸附;⑥含有可活化的反应基团,利于亲和配体的固定化。

ni柱纯化蛋白原理
Ni柱纯化蛋白原理。
Ni柱纯化蛋白是一种常用的蛋白纯化方法,其原理是利用镍离子与蛋白质中的组氨酸残基之间的亲和作用来实现蛋白的选择性结合和纯化。
在进行Ni柱纯化蛋白时,需要了解其原理和操作步骤,以确保获得高纯度的目标蛋白。
首先,让我们来了解一下Ni柱纯化蛋白的原理。
Ni柱是一种亲和层析柱,其内部填充有带有镍离子的亲和层析介质。
镍离子能够与蛋白质中的组氨酸残基形成配位键,从而实现对蛋白的选择性结合。
一般来说,His-标记的蛋白(含有多个组氨酸残基的蛋白)与Ni柱之间的结合更为稳定,因此Ni柱纯化常常用于纯化His-标记的重组蛋白。
在进行Ni柱纯化蛋白时,首先需要将含有目标蛋白的样品加载到Ni柱中。
然后,通过洗脱缓冲液的流动,非特异性结合的蛋白和其他杂质会被洗脱,而目标蛋白则会与Ni柱上的镍离子发生特异性结合。
最后,通过改变洗脱缓冲液的成分或pH值,可以实现目标蛋白的高效洗脱,从而得到纯度较高的蛋白样品。
需要注意的是,在进行Ni柱纯化蛋白时,样品的pH值、离子
强度、洗脱缓冲液的成分等因素都会对蛋白的结合和洗脱产生影响,因此需要根据具体的情况进行优化。
此外,为了保证蛋白的纯度和
活性,还需要对纯化后的蛋白样品进行适当的储存和处理。
总的来说,Ni柱纯化蛋白是一种简单、快速且高效的蛋白纯化
方法,其原理是利用镍离子与蛋白质中的组氨酸残基之间的亲和作用。
通过了解Ni柱纯化蛋白的原理和操作步骤,可以更好地进行蛋
白的纯化工作,获得高纯度和高活性的蛋白样品。
希望本文对您有
所帮助,谢谢阅读!。

镍柱纯化蛋白的原理及步骤
嘿,朋友们!今天咱来好好聊聊镍柱纯化蛋白这个超酷的事儿!
镍柱纯化蛋白的原理就像是一个精准的“抓捕行动”!你可以想象一下,蛋白就像是一群各具特点的“小家伙”,镍离子呢,就像是一个个有着特殊魔力的“小陷阱”。
那些带有特定标签的蛋白,会像被磁铁吸引一样,乖乖地被镍离子给“抓住”。
比如说,就好像一群小朋友中,只有带着特定标志的小朋友会被特定的游戏区域吸引进去一样!这是不是超级神奇呀?
那镍柱纯化蛋白具体是怎么操作的呢?首先啊,咱得把含有目标蛋白的溶液准备好,这就好比是把“小家伙们”聚集起来。
然后呢,让这个溶液慢慢地流过镍柱,嘿嘿,这时候,那些带有标签的蛋白就会紧紧地被镍柱上的镍离子抓住啦。
这就像是小鱼游进了渔网一样,跑不掉咯!接下来,咱可以用一些特殊的溶液去冲洗镍柱,把那些杂七杂八的蛋白给洗掉,就像把其他不是我们想要的小朋友请出去一样。
最后呢,用一种能让蛋白和镍离子“松开手”的溶液,把我们心心念念的目标蛋白给洗脱下来,哇,大功告成啦!就像终于从游戏区域得到了我们最想要的那个奖品!
总之,镍柱纯化蛋白这个过程真的超级有趣又超有用!大家赶紧去试试看吧!哎呀,我都等不及要再去玩一把这个“蛋白纯化游戏”啦!。
i / 3谋柱蛋白纯化一、 原理镣柱里面含有琼脂糖微球体,在琼脂糖鳌合介质的作用下微球体与N0+ 发生螯合,螯合后的NI2+能与HIS 上的咪醴环发生特殊的相互作用,从而 实现蛋白质的分离。
影响蛋白质/多肽与金属离子螯合力大小的因素主要是 蛋白质表面可结合的氨基酸(种类、数目和分布)、金属离子的种类和密 度、层析条件(PH 、盐的种类和浓度、添加剂等)二、 缓冲液的配制(500ml PH = 7.4)PBr 50ml<Nacl 14.625g20mM 咪醴 1.8gNacl14.625g 100 mM9g 200mM 18g400mM 咪醴 45gBOOmM 咪醴63g 50ml Binding buffer: (5 〜50mM ) Washing buffer: PBNacl5mMA10 mM15 mM20 mM40Mm 50 mM 14.625g 0.45g 0.9g 1.35g 1.8gElution buffer: PBf三、操作步骤此步骤过镰柱的所有溶液、上清蛋白都要先用滤膜过滤,所有液体过镰柱的速度要严格控制2.5ml/min,中间镣柱不能进气泡2、5倍镰柱体积去离子水洗涤,去除空气和20%乙醇(5ml/min)2、5~10倍鎳柱体积Binding buffer平衡3、上蛋白样品4、5倍篠柱体积Wsahing buffer洗脱杂蛋白(HIS标签含有6个组氨酸,结合能力强于含有单个组氨酸的杂蛋白),此步骤设洗脱梯度5、5倍镰柱体积Elutio "buffer洗脱目的蛋白,此步骤设洗脱梯度6、5倍体积去离子水清洗掉缓冲液7、20%乙醇保存于4C。
注意:洗脱可能会把金属离子和蛋白质的复合物一起洗下来四、鎳柱重生(介质使用约3-20次,具体与原料来源、样品体积等有关)1.银柱用去离子水清洗2. 5 倍镣柱体积EDTA 重生镰柱(20 mM PB + 0.5 M NaCI +50 mM EDTA,pH 7.4)3. 5 倍体积Binding buffe「平衡4.5倍体积去离子水清洗5.20倍体积IM NaoH洗涤6.水洗至中性7.5倍柱体积挂镣8・用5倍体积以上的纯水清洗层析柱.去除游离的金属离子9. 20%乙醇保存4C。
His融合蛋白纯化常见问题解答蛋白过镍柱纯化的原理:Ni-NTA纯化介质纯化带有His6-Tag的融合蛋白是目前蛋白纯化中最常使用的一种方法。
Ni柱中的氯化镍或者硫酸镍可以与有HIs(组蛋白)标签的碱性蛋白蛋白结合,组蛋白标签一般是6个组氨酸(碱性氨基酸)。
在蛋白上样后,带有组氨酸标签的蛋白特异性结合到柱子里,其他的杂蛋白流出。
Ni柱中的氯化镍或者硫酸镍也可以与咪唑结合,采用咪唑洗脱,咪唑竞争性结合到硫酸镍上,目的蛋白就被洗脱了,这时候收集穿出液,里面就是目的蛋白,然后透析掉咪唑即可。
上样,清洗,洗脱,基本三个步骤就结束了。
1. His 标签蛋白没有与柱结合:a)可能原因:超声的功率不对(太大,蛋白炭化,太小,蛋白没有释放)解决方法:改变超声功率,并在超声前加入溶菌酶b)可能原因:样品或者是结合缓冲液不正确:解决方法:检测pH 及样品和结合缓冲液的组成份。
确保在溶液中鳌合剂或强还原剂的浓度及咪唑的浓度不是太高。
c)可能原因:组氨酸标签暴露不完全解决方法:在变性条件下( 用4-8 M 脲,或4-6 M 盐酸胍) 进行纯化。
d)可能原因:His标签丢失解决方法1:WB 检查His 是否表达,上游构建,改变His-tag 的位置(C-端或N-端),必要时增加His个数。
解决方法2:孵育的时间不够,降低流速和增加孵育的时间。
解决方法3:改变螯合的金属离子,寻找到最佳的结合金属离子。
Ni2+通常是从宿主细胞蛋白中纯化大多数6×His标记的重组蛋白质的首选金属离子。
也是一般最常用的离子。
蛋白和金属离子之间的结合强度受几种因素影响,包括长度、位置、亲和标记在蛋白的暴露程度、所用离子的类型、以及缓冲液的pH,因此一些蛋白用其他离子可能更容易地进行纯化而不用Ni2+。
2. His 标签蛋白没有被洗脱下来:a)可能原因:洗脱条件太温和(组氨酸标记的蛋白质仍然结合在柱上,结合力较强)解决方法:增加咪唑的梯度洗脱或降低pH 来找出最佳的洗脱条件。
蛋白过镍柱纯化的原理和步骤是什么** Ni柱中的氯化镍可以与有HIs(组蛋白)标签的蛋白结合,也可以与咪唑结合。
步骤是:过柱子前可以选择Ni柱重生,也就是往柱子里倒氯化镍,一个柱长体积就行了,然后平衡柱子,拿你自己的buffer,给蛋白提供最适的环境。
我一般平衡4个柱长,然后蛋白上样,你可以让他自己挂,这样挂柱子的效果好一些,如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差,当然你也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。
挂完之后,按理想来讲,你的蛋白在Ni柱中与Ni就结合了,杂蛋白多数在烧杯里,留下来了,当然肯定有少量杂蛋白也挂上了。
这时候你要梯度洗脱,拿咪唑和你的buffer配,一般从0、20mM、40mM......100mM这样洗脱(当你不知道你的蛋白大概在什么时候出来的时候)我指的是咪唑的终浓度。
咪唑加入之后,会和蛋白争夺与Ni的结合位点,杂蛋白、你的目的蛋白,会在不同的浓度被洗脱下来,洗完之后,你可以用200mM咪唑洗柱子,清理一切蛋白,然后平衡几次(怎么平衡?),是否选择重生你自己定咯~然后放上20%乙醇保存柱子就可以咯~过的蛋白用不同的管子收下,然后SDS-page检测在哪个管子里。
**楼上说的基本对,但基本上里面填料时硫酸镍,因此柱子可以和碱性蛋白结合,组蛋白标签一般是6个组氨酸(碱性氨基酸)。
在蛋白上样后,带有组氨酸标签的蛋白特异性结合到柱子里,其他的杂蛋白流出。
这时候再用咪唑洗脱,梯度洗脱,咪唑竞争性结合到硫酸镍上,目的蛋白就被洗脱了,这时候收集浸出液,那么里面就是你要的目的蛋白,然后透析掉咪唑就行了。
现在的柱子大多是预装柱,也就是不用自己填柱,就是装好镍的傻瓜柱,也不贵,上样,洗脱,基本两个步骤就结束了。
剩下的看你怎么处理了。
可以参考楼上的。
不会再问。
ni柱纯化蛋白原理蛋白质是生物体内重要的大分子有机化合物,它们在细胞的结构和功能中起着至关重要的作用。
在生物医学研究中,需要纯化蛋白质以进行进一步的研究和应用。
ni柱纯化蛋白是一种常用的方法,它利用镍离子与组蛋白中的组氨酸残基之间的亲和力来实现蛋白质的分离和纯化。
下面将介绍ni柱纯化蛋白的原理。
首先,ni柱纯化蛋白的原理基于镍离子与组蛋白中的组氨酸残基之间的特异性亲和作用。
镍离子可以与组蛋白中的组氨酸残基形成配位键,从而实现蛋白质的特异性结合。
在这一过程中,镍离子与组蛋白中的组氨酸残基之间存在着静电作用、范德华力和氢键等相互作用,这些相互作用的结合力使得蛋白质能够与ni柱上的镍离子结合并被捕获下来。
其次,ni柱纯化蛋白的原理还涉及到蛋白质的亲和吸附和洗脱过程。
在ni柱中,蛋白质样品首先经过加载,蛋白质与ni柱上的镍离子发生特异性结合,非特异性结合的杂质被洗脱掉,从而实现蛋白质的亲和吸附。
随后,通过改变洗脱缓冲液的条件,如改变pH值、离子强度或添加螯合剂等,可以实现蛋白质的洗脱,从而得到纯化的目标蛋白质。
最后,ni柱纯化蛋白的原理还包括再生过程。
在蛋白质洗脱后,ni柱需要进行再生以去除残留的蛋白质和其他杂质,从而为下一次使用做准备。
通常通过使用高浓度的酸或碱溶液来实现ni柱的再生,将残留的蛋白质和其他杂质彻底洗脱,使得ni柱恢复到再生前的状态。
总之,ni柱纯化蛋白的原理基于镍离子与组蛋白中的组氨酸残基之间的特异性亲和作用,通过亲和吸附、洗脱和再生等过程实现蛋白质的分离和纯化。
这一方法具有操作简便、纯化效果好、适用范围广等优点,因此在生物医学研究中得到了广泛的应用。
希望以上内容能够帮助您更好地理解ni柱纯化蛋白的原理及其应用。
镍柱子纯化表达蛋白的具体步骤,注意事项1、过柱前的注意事项:a、样品必须澄清、无颗粒物,否则会堵塞柱子、缩短其使用寿命;b、包含体洗涤的最后一步及溶解时所用的Buffer中不能含EDTA、DTT、2ME;c、确保样品及Binding Buffer中有适量的NaCl,以防止杂离子与Ni离子竞争;2、过Ni柱的操作步骤:a、用去离子水洗涤,洗去20%的乙醇、除尽基质中的空气,并能防止下一步中Ni离子沉淀;b、5×柱体积的Charge Buffer(50mM NiSO4)充电;c、5×柱体积的去离子水洗涤,去游离的Ni离子;d、10×柱体积的Binding Buffer(20mM Tris-HCl,0.5M NaCl,5mM咪唑,pH8.0)平衡;e、上样(手工上样,样品体积应根据目的蛋白的浓度来确定);f、20×柱体积的Washing Buffer(20mM Tris-HCl,0.5M NaCl,20-50mM咪唑,pH8.0)洗涤,至无蛋白检出,收集流出液;g、Elution Buffer(20mM Tris-HCl,0.5M NaCl,500-1000mM咪唑,pH8.0)洗脱,每次1ml,应呈现正态分布(两边稀,中间浓);h、10×柱体积的Binding Buffer洗涤。
此时,即可用于纯化同种蛋白,很少需要重新充电。
注:同种蛋白纯化5~10次后,应进行strip和re-charge。
3、柱的清洗与保存:a、去Ni离子:a、5×柱体积的Strip Buffer(20mMTris-HCl,0.5M NaCl,50mM EDTA,pH7.4)洗涤;b、10×柱体积的去离子水洗涤。
b、去沉淀的蛋白质:a、5×柱体积的0.5M NaOH装满柱子,静置0.5~2hr;b、去离子水洗涤,至流出液的pH值为7。
c、保存:20%乙醇洗涤,再加20%乙醇保存于4℃。
蛋白过镍柱纯化的原理和步骤是什么
** Ni柱中的氯化镍可以与有HIs(组蛋白)标签的蛋白结合,也可以与咪唑结合。
步骤是:过柱子前可以选择Ni柱重生,也就是往柱子里倒氯化镍,一个柱长体积就行了,然后平衡柱子,拿你自己的buffer,给蛋白提供最适的环境。
我一般平衡4个柱长,然后蛋白上样,你可以让他自己挂,这样挂柱子的效果好一些,如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差,当然你也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。
挂完之后,按理想来讲,你的蛋白在Ni柱中与Ni就结合了,杂蛋白多数在烧杯里,留下来了,当然肯定有少量杂蛋白也挂上了。
这时候你要梯度洗脱,拿咪唑和你的buffer配,一般从0、20mM、40mM......100mM这样洗脱(当你不知道你的蛋白大概在什么时候出来的时候)我指的是咪唑的终浓度。
咪唑加入之后,会和蛋白争夺与Ni的结合位点,杂蛋白、你的目的蛋白,会在不同的浓度被洗脱下来,洗完之后,你可以用200mM咪唑洗柱子,清理一切蛋白,然后平衡几次(怎么平衡?),是否选择重生你自己定咯~然后放上20%乙醇保存柱子就可以咯~
过的蛋白用不同的管子收下,然后SDS-page检测在哪个管子里。
**楼上说的基本对,但基本上里面填料时硫酸镍,因此柱子可以
和碱性蛋白结合,组蛋白标签一般是6个组氨酸(碱性氨基酸)。
在蛋白上样后,带有组氨酸标签的蛋白特异性结合到柱子里,其他的杂蛋白流出。
这时候再用咪唑洗脱,梯度洗脱,咪唑竞争性结合到硫酸镍上,目的蛋白就被洗脱了,这时候收集浸出液,那么里面就是你要的目的蛋白,然后透析掉咪唑就行了。
现在的柱子大多是预装柱,也就是不用自己填柱,就是装好镍的傻瓜柱,也不贵,上样,洗脱,基本两个步骤就结束了。
剩下的看你怎么处理了。
可以参考楼上的。
不会再问。