第四章 均相酶催化反应动力学
- 格式:pps
- 大小:628.00 KB
- 文档页数:112

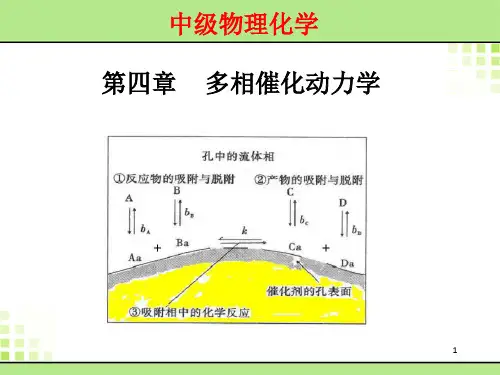









化学反应动力学中的均相催化化学反应动力学是研究反应物转化为产物的速度和反应条件对反应速度的影响的学科。
化学反应的速率决定了许多化学过程的效果和实际应用,例如生产化学物品和控制环境污染等。
其中一个重要的问题是如何提高反应速率,以提高产量和改善反应的效率。
均相催化是一种常见的方法,用于提高反应速率和选择性。
本文将探讨均相催化在化学反应动力学中的应用。
均相催化的基本概念均相催化是指在反应物和催化剂都在相同的物理状态下进行反应的过程。
这意味着,如果反应是在气相中发生的,均相催化剂也必须是气体。
同样地,如果反应物是在液相或固相中,均相催化剂也必须是相同的相态。
这种催化剂通常是低分子量的化合物,如氧化剂、还原剂、酸或碱、过渡金属离子等。
均相催化的本质是通过与反应组分形成复合物或中间体,降低反应活化能,提高反应速率和选择性。
均相催化的条件使用均相催化的条件取决于反应物和催化剂的物理状态。
在气相反应中,均相催化剂必须是气体或与气体相溶的液体。
在液相反应中,均相催化剂必须是液体或溶解于反应性溶剂中的低分子量化合物。
在固相反应中,均相催化剂通常是溶解于反应物所在的溶液中的离子催化剂。
均相催化的机理均相催化的机理通过形成反应物与催化剂形成复合物或中间体来实现。
催化剂提供活性位点吸附反应物,使得反应物间距变小,使反应物之间形成新的化学键。
单个催化周期包括特定的反应物和催化剂的摩尔比和步骤数,这些步骤共同形成一系列中间体和过渡态。
均相催化的应用对于许多不带催化剂的反应,在均相催化剂的存在下,反应速率和选择性明显提高。
以下是一些均相催化反应的例子:氢化反应氢化反应是一种常见的化学反应,可以将不饱和化合物转变为饱和化合物。
例如,苯可以通过催化剂的存在而被还原为环己烷,丙烯可以被转化为丙烷。
催化剂通常是铂、钯或镍等过渡金属离子。
氧化反应氧化反应是将化合物的一部分氧化为更高氧化态的化学反应。
例如,氧化亚氮可以被转化为氮气,亚硝酸可以被转化为硝酸。