原子物理论文(玻尔模型)
- 格式:doc
- 大小:517.28 KB
- 文档页数:10

原子物理学中的玻尔模型与量子力学在原子物理学的发展历程中,玻尔模型和量子力学是两个重要的理论框架。
玻尔模型是早期对原子结构的描述,而量子力学则是更为精确和全面的理论。
本文将从历史、原理和应用等方面探讨玻尔模型和量子力学的关系。
一、玻尔模型的历史与原理玻尔模型是由丹麦物理学家尼尔斯·玻尔于1913年提出的。
当时,原子结构的研究还处于初级阶段,科学家们对原子的内部组成和行为知之甚少。
玻尔通过对氢原子光谱的实验观察,提出了一种新的原子结构模型。
玻尔模型的核心思想是,原子由一个重心核和围绕核运动的电子组成。
电子在不同的轨道上运动,并且只能处于特定的能量状态。
这些能量状态被称为能级,电子在能级之间跃迁时会吸收或释放特定频率的光子。
玻尔模型的成功在于解释了氢原子光谱的特点,尤其是巴尔末系列线的出现。
它为后来的量子力学奠定了基础,并为原子物理学的发展提供了重要的启示。
二、量子力学的兴起与发展随着原子物理学的发展,科学家们逐渐发现玻尔模型存在一些局限性。
例如,它无法解释更复杂的原子结构和光谱现象。
为了更准确地描述原子行为,量子力学应运而生。
量子力学是20世纪20年代以来的一项重大科学成就。
它的基本原理是波粒二象性,即微观粒子既表现出粒子性质又表现出波动性质。
量子力学通过波函数描述粒子的状态,并使用算符来描述物理量的测量和演化。
量子力学的发展为原子物理学带来了巨大的进步。
它不仅能够解释原子光谱的细节,还能够描述原子的能级分布、电子云的形状和原子核的性质等。
量子力学的成功也为其他领域的研究提供了理论基础,如固体物理学、化学和生物学等。
三、玻尔模型与量子力学的关系尽管玻尔模型在原子物理学的发展中扮演了重要角色,但它仍然是一种近似的描述。
相比之下,量子力学是一种更为精确和全面的理论。
玻尔模型中的轨道概念被量子力学中的波函数所取代,而能级的离散性则由量子力学的能级分析所解释。
然而,玻尔模型仍然有其独特的应用价值。

玻尔模型是如何解释原子结构的在探索物质的微观世界中,原子结构一直是科学家们努力研究的重要课题。
而玻尔模型的提出,为我们理解原子结构提供了关键的理论框架。
要理解玻尔模型如何解释原子结构,首先得明白在此之前人们对原子的认识。
最初,人们认为原子就像一个实心的小球,内部结构无从知晓。
随着科学技术的发展,人们发现原子是由带正电的原子核和带负电的电子组成。
但新的问题来了,电子围绕原子核运动的方式究竟是怎样的呢?这时,玻尔模型登场了。
玻尔模型的核心观点是,电子在原子中的运动并不是随意的,而是处于一系列特定的、稳定的轨道上。
这些轨道就像是一条条特定的“高速公路”,电子只能在这些“高速公路”上运行,而不能处于轨道之间的空间。
而且,每个轨道都对应着一个特定的能量值。
当电子处于不同的轨道时,原子就具有不同的能量状态。
为什么电子会这样运动呢?玻尔提出了一个重要的概念——定态。
定态意味着电子在这些特定轨道上运动时,不会向外辐射能量,因此能够保持稳定。
这与经典物理学中加速运动的电荷会辐射能量的观点截然不同。
当电子从一个能量较高的轨道跃迁到一个能量较低的轨道时,就会释放出一定频率的光子,其能量等于两个轨道之间的能量差。
反过来,如果电子吸收了特定频率的光子,就能够从能量较低的轨道跃迁到能量较高的轨道。
举个例子,当我们给一个原子提供适当频率的光时,电子会吸收光子的能量,跃迁到更高的轨道;而当电子自发地从高能轨道回到低能轨道时,就会放出特定频率的光。
这也就解释了为什么原子会发出特定频率的光谱线。
玻尔模型还成功地解释了氢原子的光谱。
在实验中,我们可以观察到氢原子发出的一系列不连续的光谱线。
而玻尔模型通过计算不同轨道之间的能量差,得出的结果与实验观测到的氢原子光谱频率完美吻合。
然而,玻尔模型并不是完美无缺的。
它虽然能够很好地解释氢原子这样的简单原子结构,但对于更复杂的原子,其解释能力就显得有些不足。
比如,玻尔模型无法解释电子在轨道上的运动细节,也不能解释为什么电子会选择特定的轨道。

海南师范大学本科生课程论文题目:玻尔理论的地位与作用姓名:学号:专业:年级:系别:完成日期:指导教师:玻尔理论的地位与作用作者:XXX 指导教师:XXX 教授(XXXXXX学院,海口市,571158)摘要:19世纪末期,就在经典物理理论已被人们认为是“最终理论”的时候,人们发现了一些新的物理现象,例如光电效应,原子的光谱线系等,都是经典物理理论所无法解释的。
1913年丹麦物理学家玻尔(N.Bohr)通过研究氢原子的光谱,提出了“玻尔理论”,在这方面成功的迈出了第一步,实现了问题的突破。
关键词:玻尔理论量子化光谱地位作用The Status and Role of Boulder TheoryWriter:XXX guide teacher:XXXX lecturer(Physics and electronics engineering institute Hainan normal university,Haikou,571158)Abstract:Keywords:Boulder Theory quantization spectrum status function玻尔理论的背景19世纪末,物理学理论在当时看来已经发展到相当完善的阶段。
那是,一般的物理现象都可以从相应的理论中得到说明:物体的机械运动在速度比光速小得多时,准确的遵循牛顿力学的规律;点此现象的规律被总结为麦克斯韦方程;光的现象有光的波动理论,最后也归结到麦克斯韦方程;热现象理论有完整的玻尔兹曼、吉布斯等人建立的统计物理学。
在这种情况下,当时有许多人认为物理现象的基本规律已完全被结论,剩下的工作只是把这些基本规律应用到各种基本问题上,进行一些计算而已。
然而,在随后的研究中,当时被认为“最终理论”的经典理论却遇到了不可克服的困难。
人们发现了很多经典理论所无法解释的物理现象,例如光电效应,原子的光谱线系,黑体辐射等。
在经典力学中关于氢原子模型的理论中,氢原子中原子核带一个单位的正电荷,核外有一个单位的负电荷。

玻尔的量子轨道原子模型【摘要】玻尔的量子轨道原子模型是量子物理学发展的重要里程碑,它对原子结构和光谱的解释起到了重要作用。
本文从玻尔的量子轨道原子模型的基本假设开始介绍,然后探讨了该模型的发展历程和主要内容。
接着分析了实验验证和局限性,指出该模型在解释某些现象时存在一定局限性。
在结论部分总结了玻尔的量子轨道原子模型的重要性和意义,并提出了未来研究的方向,指出可以进一步完善和发展该模型,以更好地理解原子结构和光谱现象。
通过对该模型的深入研究,可以推动量子物理学的发展,拓展我们对自然界的认识。
【关键词】玻尔,量子轨道,原子模型,基本假设,发展历程,主要内容,实验验证,局限性,总结,未来研究方向.1. 引言1.1 玻尔的量子轨道原子模型简介玻尔的量子轨道原子模型是量子物理学的重要里程碑之一,由丹麦物理学家尼尔斯·玻尔于1913年提出。
这一模型是基于爱因斯坦的光电效应和普朗克的量子理论,并与里德堡的光谱定律相联系。
玻尔的模型突破了经典物理学的束缚,引入了量子概念,为原子结构研究开启了全新的篇章。
玻尔的量子轨道原子模型简单明了地描述了电子在原子中的运动状态,通过假设电子围绕原子核以离散的能级运动,且只在特定的轨道上运动。
这一模型为解释氢光谱线的发射和吸收现象提供了合理的解释,并且揭示了原子内部结构的稳定性和量子态的离散性。
玻尔的量子轨道原子模型不仅在原子物理学领域引起了革命性的变革,也为后续量子力学的发展奠定了坚实的基础。
通过对这一模型的深入研究和实验验证,我们可以更好地理解原子内部的微观结构和规律,推动科学技术的进步,为未来的研究和应用提供更多的可能性。
2. 正文2.1 玻尔的量子轨道原子模型的基本假设1. 电子在原子内围绕原子核轨道运动,只在特定的能级上运动,这些能级是离散的。
2. 电子在轨道运动的过程中不发射辐射,也不吸收外界辐射能量。
3. 电子在特定的轨道上运动时,其轨道半径和能量是固定的,不会发生改变。

玻尔模型理解原子的行为规律原子是组成物质的基本单位,人们对原子的认识与理解一直是科学研究的重要内容之一。
在原子结构的解析过程中,玻尔模型提供了一种简化的理论框架,帮助我们更好地理解原子行为的规律。
玻尔模型最早由丹麦物理学家尼尔斯·玻尔在1913年提出,它的核心思想是将原子看作是一个带正电的核心与围绕其运动的电子构成的系统。
根据玻尔模型,电子只能处于特定的能级上运动,且这些能级有确定的能量值。
当电子处于较低的能级时,原子处于稳定的状态;而当电子吸收足够的能量后,会跃迁到较高的能级,从而使原子处于激发状态。
玻尔模型的提出填补了经典物理学无法解释原子稳定性和光谱现象的空白。
根据这个模型,我们可以理解到以下几点关于原子行为的规律。
1. 能级结构:玻尔模型表明,原子的能级是离散的,而不是连续的。
电子只能在特定的能级上运动,并且每个能级都对应着一个特定的能量值。
这解释了为什么原子只能吸收或发射特定能量的光子。
2. 跃迁规律:玻尔模型指出,当电子从一个能级跃迁到另一个能级时,会吸收或释放一个能量等于两个能级之差的光子。
这种能量的差异可以解释物质的光谱现象,例如不同元素的特征光谱线。
3. 稳定性与不稳定性:根据玻尔模型,原子的稳定性与电子在能级上的排布有关。
当电子填满一个能级时,原子呈现出较高的稳定性。
而当电子处于激发态、未满能级或具有不稳定的能级排布时,原子会倾向于通过跃迁释放能量,寻求更加稳定的状态。
玻尔模型虽然具有一定的局限性,不能全面解释原子行为的所有规律,但它为我们对于原子结构和性质的认识提供了重要的指导。
随着科学的不断进步,量子力学等更加精确的理论模型进一步完善了对原子行为的解释。
总结起来,玻尔模型通过将原子看作一个由正电核心和绕核心旋转的电子组成的系统,揭示了电子能级结构、跃迁规律以及原子的稳定与不稳定性等行为规律。
它为我们解释光谱现象、研究元素特征以及理解原子的基本性质提供了重要的概念框架。

原子物理课程论文(设计)过程管理手册(2012 )级论文(设计)题目:玻尔模型学院:物理科学与技术学院专业:科学教育学号: ************ *名:***指导老师姓名及职称:魏代会教授玻尔模型专业:科学教育 学号:201210800091 姓名:项利安 指导老师:魏代会 摘要 原子是物质结构的微小单元,那么原子内部的结构是怎样的呢?从古至今这一直都是困扰着人类的问题。
从道尔顿的实心球模型到汤姆孙的葡萄干面包模型然后到卢瑟福的核式结构模型再到玻尔的氢原子模型最后到现在的电子云模型。
人类对原子内部结构的探索在不断地深入。
而玻尔模型的提出在原子结构研究方面具有重要的意义,在对物质结构的认识史和物理学发展史上是一个重大的成果。
本文从玻尔模型的提出简史、玻尔理论的主要内容、玻尔模型的实验验证三个方面对玻尔模型进行解释。
关键词 玻尔模型,量子化,玻尔理论引言玻尔模型如图1是丹麦物理学家尼尔斯·玻尔于1913年提出的关于氢原子结构的模型。
玻尔在卢瑟福模型的基础上,提出了电子在核外的量子化轨道,解决了原子结构的稳定性问题,很好地解释了氢原子光谱,描绘出了完整而令人信服的原子结构学说。
玻尔理论能准确的推出巴耳末公式,并能纯粹从理论上算出里德伯常数,与实验值非常符合。
玻尔理论是原子结构和原子光谱理论的一个重大进展,对原子物理学产生了深远的影响。
玻尔由于对于原子结构理论的贡献获得诺贝尔物理学奖。
他所在的理论物理研究所也在二三十年代成为物理学研究的中心。
1 玻尔模型的提出简史玻尔模型是建立在物理学三个方面进展的基础上提出的,它们分别是:以黑体辐射的事实发展出来的量子论、以实验为基础的原子核式结构模型、光谱的实验资料和经验规律。
1.1 黑体辐射——量子假说黑体是科学家们假设出的,自然界并不存在的一种物质。
这种物质对什么光都吸收而无反射。
由于冶金学和天文学的需要,大大推动了对热辐射的研究。
而黑体可以撇开材料的具体性质来研究热辐射本身的规律,在热辐射中占据十分重要的地位,从而科学家对黑体辐射的研究渐渐深入。

原子物理学中的玻尔模型与量子力学模型对比分析在原子物理学的发展历程中,玻尔模型和量子力学模型是两个重要的理论框架。
它们分别在不同的时期对原子结构和行为进行了解释和描述。
本文将对这两种模型进行对比分析,探讨它们的异同点以及在实践应用中的优缺点。
玻尔模型是由丹麦物理学家尼尔斯·玻尔于1913年提出的。
该模型基于经典物理学的思想,将原子看作是一个核心和绕核心旋转的电子组成的系统。
根据经典力学的原理,电子在绕核心运动时会受到向心力的作用,从而保持稳定的轨道。
根据玻尔模型,电子只能在特定的轨道上运动,并具有固定的能量。
当电子从一个轨道跃迁到另一个轨道时,会吸收或释放特定的能量,这解释了光谱线的产生。
然而,随着实验数据的积累和科学技术的进步,玻尔模型逐渐暴露出一些无法解释的问题。
例如,根据玻尔模型,电子在轨道上的运动应该是连续的,但实验观测到的光谱线却是离散的。
此外,玻尔模型无法解释电子自旋、电子云等现象,也无法解释复杂原子中的电子排布。
因此,玻尔模型逐渐被量子力学模型所取代。
量子力学模型是20世纪20年代发展起来的一种新的物理学理论。
该模型基于量子力学的原理,将电子视为一种既具有粒子性又具有波动性的粒子。
根据量子力学的波函数理论,电子的位置和能量并非确定的,而是存在一定的概率分布。
量子力学模型通过波函数描述了电子在原子中的可能位置和能量状态。
波函数的平方模值表示了电子在不同位置的概率密度。
相较于玻尔模型,量子力学模型更加完善和准确。
它能够解释光谱线的离散性、电子自旋、电子云等现象,并且能够应用于复杂原子和分子体系的研究。
量子力学模型还引入了一系列的算符和波函数的数学形式,通过求解薛定谔方程来得到电子的能量和波函数。
这为计算原子和分子的性质提供了理论基础。
然而,量子力学模型也存在一些限制和挑战。
首先,量子力学模型的数学形式相对复杂,需要借助高级数学工具进行求解。
其次,量子力学模型对于大尺度和高速度的物体描述不准确,需要引入相对论修正。

波尔原子模型波尔原子模型是关于原子结构的一个重要理论模型,是由丹麦物理学家尼尔斯·波尔于1913年提出的。
该模型成功地解释了许多原子的现象和性质,为后续的原子理论研究奠定了基础。
本文将介绍波尔原子模型的基本原理、发展和应用。
波尔原子模型的基本原理是:原子由中央带电核和围绕核运动的电子组成。
核质量集中在原子核中,电子质量相对较小,运动在核外的轨道上。
根据量子力学的理论,电子只能存在于一定能量的轨道上,并且在跃迁时会发射或吸收特定能量的光子。
波尔通过对氢原子光谱进行研究,发现了许多规律。
他提出了以下几条假设:电子在不同的轨道上运动时,具有不同的能量;电子在轨道上保持稳定的运动,不会辐射能量;电子在不同轨道间跃迁时,会吸收或发射光子,并且吸收或发射的光子能量与电子跃迁的能级差相关。
根据这些假设,波尔建立了波尔原子模型。
他认为,电子在距离原子核较远的轨道上运动时,电子的能量较高;而在距离原子核较近的轨道上运动时,电子的能量较低。
当电子从一个低能级的轨道跃迁到一个高能级的轨道时,会吸收能量;当电子从一个高能级的轨道跃迁到一个低能级的轨道时,会发射能量。
波尔原子模型的提出对解释氢原子的光谱非常有效。
根据波尔的理论,氢原子的光谱可以通过电子的跃迁来解释。
当电子处于基态(最低能级)时,不吸收外部能量,不发射光线,处于稳定状态。
当电子从基态跃迁到激发态时,吸收了特定能量的光子。
而当电子从激发态跃迁回基态时,会发射特定能量的光子。
根据这些跃迁能级和光子能量的关系,可以准确地预测氢原子光谱线的位置和强度。
波尔原子模型的发展并不止于氢原子。
其后续的研究证明了波尔原子模型对其他元素的适用性,特别是单电子离子。
对于多电子原子,波尔原子模型的简化假设无法解释其复杂的光谱现象,因此后来的研究发展出了更加复杂的模型,如量子力学的多电子原子理论。
然而,尽管波尔原子模型存在一些局限性,它仍然为我们理解原子结构和性质提供了一个重要的框架。

原子物理学中的玻尔模型与电子跃迁原子物理学是研究原子及其内部结构和性质的学科。
在这个领域中,玻尔模型和电子跃迁是两个重要的概念。
玻尔模型是丹麦物理学家尼尔斯·玻尔于1913年提出的。
它是一个简化的原子模型,用来描述原子的电子结构。
根据玻尔模型,原子由一个中心的原子核和绕核运动的电子组成。
这些电子在不同的轨道上运动,每个轨道对应着一个特定的能量。
电子在轨道之间跃迁时,会吸收或释放能量,从而产生光谱线。
电子跃迁是指电子从一个能级跃迁到另一个能级的过程。
在玻尔模型中,电子只能在特定的能级之间跃迁,而不能停留在能级之间的过渡态。
当电子从一个较高能级跃迁到一个较低能级时,会释放出能量,产生发射光谱线。
而当电子从一个较低能级跃迁到一个较高能级时,会吸收能量,产生吸收光谱线。
电子跃迁的能量差决定了光谱线的频率和波长。
根据玻尔模型,电子的能级是量子化的,即只能取特定的能量值。
这种量子化的能级导致了光谱线的离散性,即只有特定的波长才能被观察到。
这一观察结果与实验事实相符,为原子物理学的发展提供了重要的理论支持。
玻尔模型的提出对原子物理学的发展起到了重要的推动作用。
它为解释氢原子光谱线提供了简单而有效的方法。
玻尔模型的成功使得人们对原子结构和性质的理解有了重大的突破。
然而,随着实验技术的发展和对原子结构的深入研究,玻尔模型逐渐暴露出其局限性。
玻尔模型无法解释更复杂的原子系统,特别是多电子原子。
在多电子原子中,电子之间存在相互作用,导致能级的分裂和能量的变化。
这使得玻尔模型的简化假设不再适用。
为了更准确地描述原子的电子结构,量子力学的发展成为必然。
量子力学是一种描述微观粒子行为的理论框架。
它建立了一套完整的数学形式,可以描述电子在原子中的行为。
量子力学的发展使得人们能够更准确地计算电子的能级和光谱线。
它的理论基础是波粒二象性,即电子既可以表现出粒子性,又可以表现出波动性。
在量子力学中,电子的能级是通过求解薛定谔方程得到的。
原子结构知识:原子的玻尔模型原子结构是化学中非常重要的一个概念,其研究有助于我们了解化学元素的性质以及化学反应的基本规律。
而原子的玻尔模型,则是原子结构研究中的重要模型之一。
本文将从原子的玻尔模型的背景、基本概念、实验验证、不足之处等几个方面,为读者介绍原子的玻尔模型。
1.背景19世纪以来,化学研究迅速发展,元素周期表的成功制定标志着化学元素分类体系的建立。
然而,化学家们却发现,在周期表中仅仅是依据化学性质和原子质量排列的,与原子的内部结构并没有直接联系。
因此,自20世纪初期,人们开始尝试寻找原子内部结构的线索。
尽管在当时,原子结构还没有完整的解析模型,但是已经存在了一些具体的实验发现。
例如,光谱学家们通过对氢原子发射光谱线的研究发现,氢原子的发射光谱线具有一定的规律性,即光谱线的频率成等差数列分布。
同时,根据带电粒子在电磁场中运动的理论,人们也推测出电子在原子内部必定有一定的轨道运动方式。
基于这些实验数据和物理理论推测,科学家们开始试图构建原子结构的玻尔模型。
2.基本概念原子结构的玻尔模型是一个具有简洁结构的模型。
它假设在中心原子核周围,有一系列状态稳定的电子轨道,供等电子态电子占据。
玻尔模型关于原子的Electronic structure提出了以下一些基本假设:(1)电子运动轨道:电子在原子核周围的运动类似于行星绕着太阳的轨道运动。
它可以在特定的几个轨道(通常用n表示)上运动,每个轨道会有相应的电子能级和半径。
(2)光吸收与发射:根据玻尔模型,电子从低能级向高能级跃迁时,必须吸收一定频率(或波长)的光子,而从高能级向低能级跃迁时,则要发射出一定频率(或波长)的光子。
(3)能级差:玻尔模型认为,电子从一定能级向另一能级跃迁的能级差应当是一个固定值,这个固定值正好等于跃迁所产生的光子的能量。
(4)原子谱线:由于电子跃迁只能在有限的几个能级之间进行,因此在氢原子的电子跃迁中只会产生几条明显的频率分布相同的谱线。
原子物理篇光电效应康普顿散射玻尔模型原子物理篇:光电效应、康普顿散射与玻尔模型光电效应、康普顿散射和玻尔模型是原子物理中的三个重要概念。
它们揭示了光与物质相互作用的本质,对于理解原子结构和电磁波与物质相互作用的机制具有重要意义。
本文将介绍光电效应、康普顿散射和玻尔模型的基本原理以及实际应用。
一、光电效应光电效应是指当光照射到金属表面时,如果光的能量足够大,就能够使金属表面的电子被激发出来,并形成电流。
这个现象首先被爱因斯坦在1905年解释并获得诺贝尔物理学奖。
光电效应提供了证据,证明了光以粒子的形式传播,即光子。
在光电效应中,光子的能量E与频率f满足能量守恒定律E = hf,其中h为普朗克常数。
当光照射金属表面时,光子传递能量给金属中的自由电子,当光子能量大于金属中的准连续带能量(一般称为离域电子)时,电子被激发出来。
该激发过程可以用光电子能动量关系来描述,即E_k = {E_photon - \phi},其中E_k为光电子的动能,E_photon为光子的能量,\phi为金属的逸出功。
光电效应在太阳能电池、光电管等领域有广泛的应用。
太阳能电池利用光电效应将太阳能转化为电能,实现可持续发展。
光电管则根据光电效应的原理,能够将光信号转化为电信号,被广泛应用于光通信和光控制技术中。
二、康普顿散射康普顿散射是指当X射线或γ射线与物质相互作用时,发生散射现象。
康普顿散射的理论由康普顿在1923年提出,并因此获得了诺贝尔物理学奖。
康普顿散射实验证实了光子具有粒子性,并揭示了光子与物质相互作用的一种重要机制。
在康普顿散射过程中,光子与物质中的自由电子相互碰撞,光子会发生散射并且其能量和动量都发生改变。
根据能量守恒定律和动量守恒定律,可以得到康普顿散射的能量和动量变化关系,即\Delta\lambda = \lambda' - \lambda = \frac{{h}}{{m_ec}}(1-cos\theta),其中\Delta \lambda为入射光子波长变化量,\lambda'为散射光子波长,\lambda为入射光子波长,m_e为电子质量,c为光速,\theta为散射角度。
原子物理学中的玻尔模型与波粒二象性玻尔模型与波粒二象性是原子物理学中两个重要的概念。
玻尔模型是最早成功描述原子结构的理论之一,而波粒二象性则是揭示了光和物质的本质,是量子力学的基础概念之一。
一、玻尔模型玻尔模型是基于古典物理学的理论,可以用来描述氢原子的结构。
根据玻尔模型,氢原子的电子以一定的能级在原子核周围绕,每个能级对应一个固定的轨道。
当电子从高能级跃迁到低能级时,会释放出对应的能量,形成光谱线。
玻尔模型的成功在于他能够解释氢原子光谱的发射谱线和吸收谱线,以及研究物质的结构和性质等方面都有很重要的应用。
不过,随着科学技术的发展,它的理论基础不断受到挑战,并被更为精确的量子力学理论所代替。
二、波粒二象性波粒二象性是量子力学的基础概念,描述了微观世界中的粒子具有波动性质,同时波动也同时具备粒子性质。
例如,在双缝干涉实验中,当一个光束通过一系列狭缝后撞击于一个干涉屏上,光的波动性质表现出的干涉条纹是一些亮和暗的条纹,这是由光的波长和路径差决定的。
当把光逐个击打干涉屏上时,也发现光的粒子性质,即每一个光子击打一次干涉屏上就消失了,这种二象性描述了各种相对论物质的基本行为。
三、相互关系波粒二象性与玻尔模型是相互关联的。
量子力学在建立之初难以理解的一个问题就是“为什么电子在原子中不会发出辐射并进入原子核?” 针对这个问题,玻尔最早提出了基本的解释,即限定电子必须行进于某些特定的、不可能是任意的轨道中。
这些轨道不仅存在一定的能量,而且电子在不同的轨道之间跃迁会产生和吸收辐射,这些辐射正好能够与实验结果实现很好地吻合。
这里,我们可以看到玻尔模型提供了电子轨道的概念,而电子轨道就涉及到波粒二象性,因为电子是粒子,而轨道是波函数。
玻尔模型虽然成功解释了一些特定情况下的物理现象,但在更为复杂的情况下已经不能说明实验结果。
波粒二象性则更适用于更复杂的原子的解释,因为它涉及到概率的分布和波的传播性质。
总之,玻尔模型与波粒二象性都是理解和解释原子物理学中一些基本问题的重要概念。
玻尔原子模型解析玻尔原子模型是物理学家尼尔斯·玻尔于1913年提出的一个关于原子结构的理论模型。
该模型通过对氢原子的独立研究,揭示了原子的结构和能级分布,为量子力学的发展奠定了基础。
在本文中,我们将对玻尔原子模型进行解析,探讨其基本原理和对原子结构的贡献。
玻尔原子模型的基本原理是以核心为中心的原子结构。
根据该模型,原子由一个中央的带电核心(通常是一个或多个质子)和围绕核心旋转的电子组成。
电子在不同的轨道上运动,每个轨道对应着特定的能级。
这些能级是量子化的,只有特定的能量值才能被电子占据。
当电子不受外界干扰时,它们会在最低能级上稳定地旋转。
如果电子受到光或热等能量的激发,它们将跃迁到更高的能级。
当电子回到低能级时,会释放出光子,从而产生光谱线。
玻尔原子模型的重要性在于它成功地解释了氢原子光谱现象。
原子的光谱是指当原子受到能量激发时,会发射出一系列离散的光线。
玻尔通过研究氢原子的光谱现象,发现了一些规律。
他观察到,氢原子的光谱线只出现在特定的波长位置,并且呈现出一定的序列和间距关系。
根据这些观察结果,玻尔提出了几个重要结论。
首先,玻尔认为电子在轨道上只能存在于特定的能级。
这些能级之间有固定的能量差,电子只能在这些能级间进行跃迁,不会停留在中间位置。
这一观点被称为量子化条件。
玻尔用了一个很著名的公式,即能级差的大小等于普朗克常数和电子频率乘积。
这个公式成功地解释了氢原子的光谱线的波长、频率和能级之间的关系。
其次,玻尔提出了一个量子数概念,即主量子数、角量子数和磁量子数。
主量子数用来描述电子所处的能级,角量子数用来描述电子在轨道上的角动量,磁量子数用来描述电子在轨道上的磁矩。
这些量子数限制了电子的运动状态,使得它们的运动具有一定的规律性。
最后,玻尔原子模型还对玻尔半径进行了描述。
玻尔半径是电子在轨道上运动时与核心之间的平均距离。
根据玻尔半径的计算公式,玻尔提出了一个关于电子运动稳定性的条件,即电子在轨道上运动时所受到的离心力与库伦引力之间达到平衡。
原子物理学玻尔模型与原子光谱原子物理学是研究原子及其内部结构与性质的学科,玻尔模型是原子物理学中一个重要的模型,而原子光谱是通过光的发射和吸收来研究原子结构的一种方法。
本文将探讨玻尔模型的基本原理与特点,以及原子光谱的应用与意义。
一、玻尔模型的基本原理玻尔模型是根据电子定态理论而提出的,它将原子中的电子视为围绕原子核以固定能量和轨道运动的粒子。
根据该模型,电子在不同轨道上运动,而每个轨道对应着特定的能量水平。
当电子从一个能量较高的轨道跃迁到一个较低的轨道时,会释放出能量,这种能量以光的形式发射出来。
玻尔模型中的关键概念是能级和量子化条件。
每个轨道对应一个能级,而不同能级之间的能量存在固定的差值,称为能级间的能量差。
电子在轨道上的运动遵循量子化条件,即电子只能处于能级所对应的轨道上,而不能处于能级之间的位置。
二、玻尔模型的特点1. 定态和量子化:玻尔模型认为电子在特定轨道上运动,每个轨道对应一个能量水平。
电子的能量是量子化的,只能处于能级所对应的轨道上。
2. 跃迁和辐射:当电子从一个能级跃迁到另一个能级时,会释放或吸收特定的能量。
这种能量以光的形式发射或吸收,形成原子光谱。
3. 能级结构:玻尔模型中的能级结构为之后的量子力学提供了基础。
根据量子力学理论,每个轨道可以细分为不同的亚能级,从而更准确地描述原子的能级结构。
4. 单个电子系统:玻尔模型只适用于单个电子系统,即只考虑一个电子围绕原子核运动的情况。
对于多电子原子,需要使用更复杂的理论模型。
三、原子光谱的应用与意义原子光谱是通过观察原子的发射和吸收光谱来研究原子结构的。
光谱是电磁辐射在不同波长的依次排列,每个元素都有独特的光谱特征,可以通过分析光谱来确定元素的组成和结构。
原子光谱在各个领域都有广泛的应用。
在天文学中,通过观察星体的光谱可以研究宇宙中的元素组成和星体的演化过程。
在化学分析中,利用光谱分析可以确定物质中的元素含量和化学结构。
在材料科学中,利用光谱技术可以研究材料的电子结构和性能。
原子物理发展史范文1897年,英国科学家汤姆逊使用阴极射线管进行实验,发现了阴极射线中的粒子具有负电荷并带有一定的质量。
他将这些粒子称为“电子”,并提出了“李普曼尔汤姆逊模型”,即电子是原子中基本粒子的一部分。
汤姆逊的发现对原子结构的理解产生了深远影响。
在约瑟夫·约瑟夫逊发现电子后不久,成为物理学家的欧内斯特·卢瑟福开始进行了一些实验,以进一步探查原子的内部结构。
在1909年的一系列经典阿尔法粒子散射实验中,他发现了原子中一个极小但非常重的核心,并将其称为“原子核”。
卢瑟福的发现引发了原子物理领域的一场革命,也为之后的科学家提供了强有力的理论基础。
1913年,丹麦物理学家尼尔斯·玻尔提出了经典的玻尔模型,该模型描述了电子在原子周围绕核运动的行为。
根据他的理论,电子只能处于特定的能级上,并且能级之间的跃迁会伴随着能量的辐射或吸收。
玻尔模型为原子光谱以及原子的能级结构提供了重要的解释。
随着原子物理研究的深入,人们对于电子云的性质和原子结构有了更深入的理解。
1926年,奥地利物理学家埃尔温·薛定谔提出了著名的薛定谔方程,该方程用于描述电子在原子中的运动。
这个方程为原子物理提供了一套数学框架,可以更准确地描述微观粒子的行为。
接下来的几十年里,原子物理得到了长足的发展。
英国物理学家詹姆斯·查德威克在1932年发现了中子,从而确认了原子核中存在中子这一概念。
随后,阿尔伯特·爱因斯坦提出了著名的E=mc²公式,揭示了质能等价原理,推动了原子能和核能的研究与应用。
在20世纪中叶,原子爆弹的爆炸引发了对核能利用和核武器扩散的广泛关注。
同时,科学家们也开始研究放射性元素的衰变和核子之间的相互作用。
在20世纪60年代,美国物理学家穆雷·盖尔曼提出了量子色动力学理论,解释了原子核内部粒子之间的相互作用,为高能物理学奠定了基础。
现在,原子物理学已经成为一个庞大而多样的研究领域。
原子物理课程论文(设计)过程管理手册(2012 )级论文(设计)题目:玻尔模型学院:物理科学与技术学院专业:科学教育学号: ************ *名:***指导老师姓名及职称:魏代会教授玻尔模型专业:科学教育 学号:201210800091 姓名:项利安 指导老师:魏代会 摘要 原子是物质结构的微小单元,那么原子内部的结构是怎样的呢?从古至今这一直都是困扰着人类的问题。
从道尔顿的实心球模型到汤姆孙的葡萄干面包模型然后到卢瑟福的核式结构模型再到玻尔的氢原子模型最后到现在的电子云模型。
人类对原子内部结构的探索在不断地深入。
而玻尔模型的提出在原子结构研究方面具有重要的意义,在对物质结构的认识史和物理学发展史上是一个重大的成果。
本文从玻尔模型的提出简史、玻尔理论的主要内容、玻尔模型的实验验证三个方面对玻尔模型进行解释。
关键词 玻尔模型,量子化,玻尔理论引言玻尔模型如图1是丹麦物理学家尼尔斯·玻尔于1913年提出的关于氢原子结构的模型。
玻尔在卢瑟福模型的基础上,提出了电子在核外的量子化轨道,解决了原子结构的稳定性问题,很好地解释了氢原子光谱,描绘出了完整而令人信服的原子结构学说。
玻尔理论能准确的推出巴耳末公式,并能纯粹从理论上算出里德伯常数,与实验值非常符合。
玻尔理论是原子结构和原子光谱理论的一个重大进展,对原子物理学产生了深远的影响。
玻尔由于对于原子结构理论的贡献获得诺贝尔物理学奖。
他所在的理论物理研究所也在二三十年代成为物理学研究的中心。
1 玻尔模型的提出简史玻尔模型是建立在物理学三个方面进展的基础上提出的,它们分别是:以黑体辐射的事实发展出来的量子论、以实验为基础的原子核式结构模型、光谱的实验资料和经验规律。
1.1 黑体辐射——量子假说黑体是科学家们假设出的,自然界并不存在的一种物质。
这种物质对什么光都吸收而无反射。
由于冶金学和天文学的需要,大大推动了对热辐射的研究。
而黑体可以撇开材料的具体性质来研究热辐射本身的规律,在热辐射中占据十分重要的地位,从而科学家对黑体辐射的研究渐渐深入。
维恩在通过实验测得黑体辐射本领R(λ,T)在不同温度T 下,随λ的变化规律后,根据热力学理论得出了频率在(ν,ννd +)之间的辐射能量密度E(ν,T)的经验关系公式,但此公式在低频部分与实验结果有显著偏差。
同样,瑞利和金斯根据经典电动力学和统计物理学导得的公式在高频部分会出现紫外灾难,与实验事实和实际严重不符。
这说明经典物理已经不能完全解释自然界中的所有现象。
黑体辐射问题引爆了物理界的“量子革命”。
1900年普朗克为解释黑体辐射问题发表了著名的量子假说。
他认为电磁辐射的能量交换只能是量子化的,即νnh E =,n=1,2,3,……;这里的h 被称为普朗克常量,是能量量子化的量度。
虽然量子化的概念同经典物理严重背离,但由它而推导出的黑体能量密度的分布公式却能以惊人的精确性与实验结果相符合如图2,弥补了维恩经验公式和瑞利—金斯公式的不足。
因为普朗克的量子说与经典物理的概念是如此之不同,因此在普朗克公式正式提出的五年之中,没有人对其加以理会。
直到1905年,才由爱因斯坦做出了发展,提出光量子说,用νh E =成功的解释了光电效应。
而玻尔模型就是把量子说引入卢瑟福模型而提出的。
下面我们一起来看一下卢瑟福模型的提出。
1.2 卢瑟福模型1909年,卢瑟福的助手盖革和学生马斯顿在用α粒子轰击原子的实验中,发现α粒子在轰击原子时有大约八千分之一的概率被反射回来了。
对于这样可谓是东方夜谭的实验结果,卢瑟福在感到惊讶之余并没有因为它的不可思议而放弃对它的研究,反而在充分接受实验事实的基础上对试验结果进行严谨的理论推理。
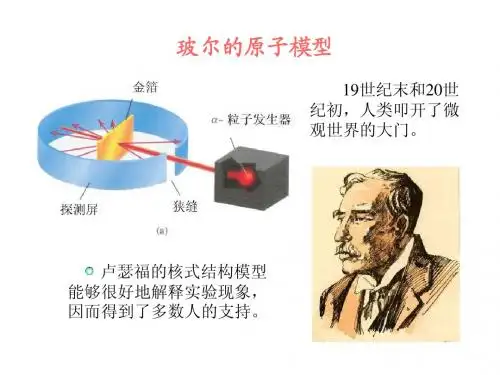
最终于1911年提出了原子的核式结构模型如图3。
他认为原子内的正电荷并不均匀分布在整个原子球内,而是集中在原子的中心,我们可称其为原子核。
原子核在原子中所占的体积只有原子大小的万分之一,但它占有整个原子99.9%以上的质量。
带负电的电子则分布在与原子大小同数量级的封闭轨道上绕核旋转。
卢瑟福的核式结构模型能很好的解释α粒子散射实验中出现的大角散射现象,并且卢瑟福推导出了能用实验验证的卢瑟福公式,实验结果进一步证明了卢瑟福理论的正确性。
但是卢瑟福模型并不是完美无缺的,它不能解释原子的稳定性、同一性和再生性问题。
【1】所以就像普朗克的量子论一样,当时的卢瑟福模型并不为当时的物理学界认可。
从中我们知道有的时候真理掌握在少数人的手中。
当时,年轻的玻尔正在卢瑟福所在的实验室工作,他对卢瑟福模型的优点和不足进行了深入的了解,为他后来提出玻尔模型(氢原子模型)奠定了基础。
1.3 光谱实验材料光谱的实验规律是探索原子内部结构的重要资料,对原子结构理论的发展起了很大的作用。
1913年2月,当玻尔看到氢原子光谱线的经验表达式时,他敏锐的察觉到了原子的发光现象与原子内部结构间的密切联系,从中顿时受到启发。
正如他后来回忆所说的那样:“就在我看到巴耳末公式的那一瞬间,突然一切都清楚,”“就像是七巧板游戏中的最后一块”。
【2】这件事被称为玻尔的“二月转变”。
1885年,瑞士的物理学家巴耳末发现氢原子光谱中可见光区的谱线的波数ν~(波长的倒数)之间的关系可用下列简单公式表示: )121(41~2'2n B -=≡λν,'n =3,4,5,…… (1) 式中B=364.56nm ,是个经验常数。
根据这个公式算得的波长数值在实验误差范围内与测到的数值完全一致,后人称这个公式为巴耳末公式,而将它所表达的一组谱线称为巴耳末系。
之后氢原子光谱的其它谱线系也先后被发现,一个在紫外区,由莱曼发现,还有三个在红外区,分别由帕邢、布拉开、普丰德发现。
这些谱线也像巴耳末系一样可分别用一个简单的公式表达,笔者在这就不一一列出了。
由此可见所有的氢原子光谱线可用一普遍式子来表示:()()'111~2'2n T n T n n R H -=⎥⎦⎤⎢⎣⎡-=≡λν, (2) 这就是在1889年由里德伯提出的里德伯方程。
其中T (n)称为光谱项,B R H 4=为里德伯常量。
表面上如此繁复的光谱线竟然能用这样简单的公式来表示它谱线与波数之间的关系,而结果又与实验事实符合的如此之好。
这说明这个公式深刻的反映了氢原子内在的规律性,为玻尔模型的建立提供了条件。
【3】反之玻尔把量子说引入卢瑟福模型后也揭晓了三十年内未解决的里德伯公式之谜。
1913年7月、9月、11月,经由卢瑟福推荐,《哲学杂志》接连刊载了玻尔的三篇论文,标志着玻尔模型正式提出。
这三篇论文成为物理学史上的经典,被称为玻尔模型的“三部曲”。
【4】2 玻尔模型的主要内容从卢瑟福的原子模型来看,氢原子应具有电荷为+e的原子核和一个电荷为-e 的电子,在氢原子中电子围绕原子核运动。
但是它是怎样运动的?即它的运动规律是什么?并按什么样的规律来改变它的运动状态?与它发射光谱的规律性有何关系?这都是卢瑟福的核式结构模型所没有解决的问题。
玻尔基于卢瑟福的核式结构模型,并结合原子光谱的经验规律和普朗克的量子概念,在1913年对原子结构问题提出了新的假设,完美解释了原子核的外围部分,从而初次成功的建立了一种氢原子的理论。
接下来介绍的便是玻尔模型的主要内容。
2.1 经典轨道以氢原子为例,氢原子中原子核带有一个单位的正电,外边的电子带有一个单位的负电。
如图4按经典力学,质量为m 的电子绕原子核作半径为r 的圆周运动时受到的向心力为:r m F 2υ=,这个力只能由原子核和电子之间的库仑引力来提供,即:r m r Ze 222041υπε= (3) (为了使推得的公式能有普遍的应用,我们以Ze 代表原子核的电荷,对氢Z=1)原子的内部能量由电子的动能和体系的势能构成(原子核暂时作为不动,假设其动能为0)。
由库仑力可求出:势能=r Ze K 2041πε- (4) K 是r=∞时的势能,它的数值可以随意选定。
如果把r=∞时的势能定为零,那么势能=r Ze 2041πε- (5) 由此得到电子在圆周运动中的能量表达式:rZe m E 022421πευ-= 由(3)可得 rZe r Ze r Ze E 24124120220πεπε-=⎥⎦⎤⎢⎣⎡-= (6) 这里能量出现负值,这是由于之前我们把∞=r 时的势能定为零的结果。
由上式可见半径越大的轨道能量越大。
因为r 可以有任意的大小,因而E 值也没有其他任何的限制。
由(3)式可求得电子做圆周运动的频率为3042mrZ r f πεπυ== (7) (6)式与(7)式是根据经典轨道理论以及经典力学和电学的原理推出的,但他们不足以说明原子光谱不连续的事实,也不能说明原子的稳定性。
2.2 定态假设从卢瑟福的核式结构模型中我们知道电子像行星系一样绕原子核作圆周运动。
按照经典理论,电子运动的圆周轨道是可以有任意大小的,也就是说电子绕核运动的半径是可以连续变化的。
但是玻尔对此做了一个硬性规定:电子只能处于一些分立的满足一定条件的轨道上。
而且与在经典的麦克斯韦理论中相反,当电子在定态轨道上绕核运动时,虽然具有加速度,但是不发生辐射。
这就是玻尔的定态假设。
2.3 辐射条件从上一定态条件可知,电子在定态轨道运动时不会发生电磁辐射。
那么在什么情况下会产生辐射呢?对此玻尔做了第二个假设:只有当电子从一个定态轨道跃迁到另一个定态轨道时,电子才会以电磁波的形式放出(或吸收)一个光子的能量(νh )。
这就是玻尔提出的辐射条件。
电子辐射出的能量多少由能级差决定,若用'n E 表示电子的初态能量,n E 表示电子的终态能量,则可写成n n E E h -='ν (8)在前面我们已经知道了氢光谱的经验公式(里德伯公式)为)()(111~'22'n T n T n n R -=⎥⎦⎤⎢⎣⎡-=≡λν, 如果将上式等号左右两边都乘以νh 就可以得到:22'~n hcR n hcR h hc -==νν (9) 比较(8)式和(9)式可得:2n Rhc E n -= (10) (10)式中,R 为经验常数,n 为整数,此式所代表的原子能量只能具有一系列的一定数值,这些数值是彼此分隔的,不能连续变化。
用'n E 和n E 可以将里德伯公式表示为()n nE E hc -=≡'11~λν (11) 根据玻尔的频率条件我们就可以对里德伯公式进行解释,赋予其一定的物理意义:它代表电子从定态'n 跃迁到n 产生的能量差。
由(10)式和(6)式可得:220241n hc R e r H πε= (12) 此式右侧n 是整数,其余是常数,可知与能量联系的电子轨道也是分隔的,它的半径有一定数值,不能连续变化。