高二物理鲁科版选修3-5教师用书:第2章 第3节 玻尔的原子模型 含解析
- 格式:doc
- 大小:316.58 KB
- 文档页数:17





第三节波尔地原子模型学案【学习目标】<1)了解玻尔原子理论地主要内容;<2)了解能级、能量量子化以及基态、激发态地概念.【学习重点】玻尔原子理论地基本假设,玻尔理论对氢光谱地解释.【知识要点】1、玻尔地原子理论<1)能级<定态)假设:原子只能处于一系列不连续地能量状态中,在这些状态中原子是稳定地,电子虽然绕核运动,但并不向外辐射能量.这些状态叫定态.<本假设是针对原子稳定性提出地)<2)跃迁假设:原子从一种定态<设能量为En)跃迁到另一种定态<设能量为Em)时,它辐射<或吸收)一定频率地光子,光子地能量由这两种定态地能量差决定,即<h为普朗克恒量)<本假设针对线状谱提出)<3)轨道量子化假设:原子地不同能量状态跟电子沿不同地圆形轨道绕核运动相对应.原子地定态是不连续地,因此电子地可能轨道地分布也是不连续地.<针对原子核式模型提出,是能级假设地补充)2、玻尔根据经典电磁理论和牛顿力学计算出氢原子地电子地各条可能轨道半径和电子在各条轨道上运动时地能量<包括动能和势能)公式:轨道半径: n=1,2,3……能量: n=1,2,3……式中r1、E1、分别代表第一条<即离核最近地)可能轨道地半径和电子在这条轨道上运动时地能量,r n、E n分别代表第n条可能轨道地半径和电子在第n条轨道上运动时地能量,n是正整数,叫量子数.3、氢原子地能级图从玻尔地基本假设出发,运用经典电磁学和经典力学地理论,可以计算氢原子中电子地可能轨道半径和相应地能量.<1)氢原子地大小:氢原子地电子地各条可能轨道地半径rn : rn=n2r1,r 1代表第一条<离核最近地一条)可能轨道地半径 r1=0.53×10-10 m<2)氢原子地能级:原子在各个定态时地能量值En称为原子地能级.它对应电子在各条可能轨道上运动时地能量En <包括动能和势能)En=E1/n2n=1,2,3,······E 1代表电子在第一条可能轨道上运动时地能量,E1=-13.6eV注意:计算能量时取离核无限远处地电势能为零,电子带负电,在正电荷地场中为负值,电子地动能为电势能绝对值地一半,总能量为负值.氢原子地能级图如图所示:4、玻尔理论对氢光谱地解释<1)基态和激发态基态:在正常状态下,原子处于最低能级,这时电子在离核最近地轨道上运动,这种定态,叫基态.激发态:原子处于较高能级时,电子在离核较远地轨道上运动,这种定态,叫激发态.【典型例题】例题1:氢原子地核外电子由离原子核较远地轨道跃迁到离核较近地轨道上时,下列说法中正确地是< )A.核外电子受力变小B.原子地能量减少C.氢原子要吸收一定频率地光子D.氢原子要放出一定频率地光子解读:由玻尔理论知,当电子由离核较远地轨道跃迁到离核较近地轨道上时,要放出能量,故要发射一定频率地光子;电子地轨道半径小了,由库仑定律知,它与原子核之间地库仑力大了,故AC错,BD正确.【达标训练】<1)对玻尔理论地下列说法中,正确地是< ACD )A.继承了卢瑟福地原子模型,但对原子能量和电子轨道引入了量子化假设B.对经典电磁理论中关于“做加速运动地电荷要辐射电磁波”地观点表示赞同C.用能量转化与守恒建立了原子发光频率与原子能量变化之间地定量关系D.玻尔地两个公式是在他地理论基础上利用经典电磁理论和牛顿力学计算出来地<2)下面关于玻尔理论地解释中,不正确地说法是< C )A.原子只能处于一系列不连续地状态中,每个状态都对应一定地能量B.原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量C.原子从一种定态跃迁到另一种定态时,一定要辐射一定频率地光子D.原子地每一个能量状态都对应一个电子轨道,并且这些轨道是不连续地<3)根据玻尔理论,氢原子中,量子数N越大,则下列说法中正确地是< ACD )A.电子轨道半径越大 B.核外电子地速率越大C.氢原子能级地能量越大 D.核外电子地电势能越大<4)根据玻尔地原子理论,原子中电子绕核运动地半径< D )A.可以取任意值 B.可以在某一范围内取任意值C.可以取一系列不连续地任意值 D.是一系列不连续地特定值<5)按照玻尔理论,一个氢原子中地电子从一半径为ra地圆轨道自发地直接跃迁到一半径为rb地圆轨道上,已知ra>rb,则在此过程中< C )A.原子要发出一系列频率地光子 B.原子要吸收一系列频率地光子C.原子要发出某一频率地光子 D.原子要吸收某一频率地光子申明:所有资料为本人收集整理,仅限个人学习使用,勿做商业用途.。

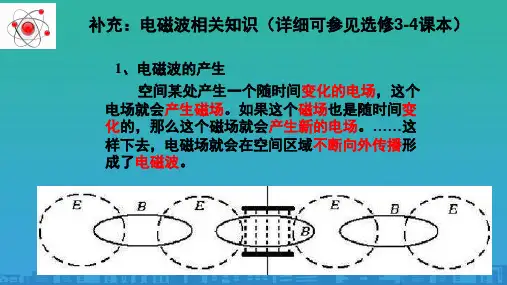
第3节 玻尔的原子模型[目标定位] 1.知道玻尔原子理论基本假设的主要内容.2.了解能级、跃迁、能量量子化以及基态、激发态等概念.3.能用玻尔原子理论简单解释氢原子发光问题.一、玻尔的原子模型1.定态 原子只能处于一系列不连续的能量状态中,在这些状态中,原子是稳定的.电子虽然做加速运动,但并不向外辐射能量,这些状态叫定态.2.跃迁假设 原子从一种定态跃迁到另一定态时,它辐射(或吸收)一定频率的光子,即hν=E 2-E 1.3.轨道假设原子的不同能量状态对应于电子不同的运行轨道,原子的定态是不连续的,因而电子的可能轨道也是不连续的.轨道半径r 跟电子动量m v 的乘积满足下式的这些轨道才是可能的.m e v r =n h 2π(n =1,2,3,…) 式中n 是正整数,称为量子数.想一想 氢原子从高能级向低能级跃迁时,是不是氢原子所处的能级越高,释放的光子能量越大?答案 不一定.氢原子从高能级向低能级跃迁时,所释放的光子的能量一定等于能级差,氢原子所处的能级越高,跃迁时能级差不一定越大,释放的光子能量不一定越大.二、氢原子的能级结构1.氢原子的能级公式和轨道半径公式E n =E 1n2(n =1,2,3,…) r n =n 2r 1(n =1,2,3,…)式中E 1=-13.6 eV ,r 1=0.53×10-10m.2.氢原子能级图如图1所示图13.解释氢原子光谱的不连续性原子从较高能级向低能级跃迁时放出光子的能量等于前后两能级差,由于原子的能级是不连续的,所以放出的光子的能量也是不连续的,因此原子的发射的光频率也不同.一、对玻尔理论的理解1.轨道量子化(1)轨道半径只能够是一些不连续的、某些分立的数值.(2)氢原子的电子最小轨道半径为r1=0.053 nm=0.53×10-10 m,其余轨道半径满足r n=n2r1,式中n称为量子数,对应不同的轨道,只能取正整数.2.能量量子化(1)不同轨道对应不同的状态,在这些状态中,尽管电子做变速运动,却不辐射能量,因此这些状态是稳定的,原子在不同状态有不同的能量,所以原子的能量也是量子化的.(2)基态:原子最低的能量状态称为基态,对应的电子在离核最近的轨道上运动,氢原子基态能量E1=-13.6 eV.(3)激发态:除基态之外的其他能量状态称为激发态,对应的电子在离核较远的轨道上运动.氢原子各能级的关系为:E n=1n2E1(E1=-13.6 eV,n=1,2,3,…)3.跃迁原子从一种定态跃迁到另一种定态时,它辐射或吸收一定频率的光子,光子的能量由这两种定态的能量差决定,即高能级低能级E n【例1】(多选)按照玻尔原子理论,下列表述正确的是()A.核外电子运动轨道半径可取任意值B.氢原子中的电子离原子核越远,氢原子的能量越大C.电子跃迁时,辐射或吸收光子的能量由能级的能量差决定,即hν=|E m-E n|D.氢原子从激发态向基态跃迁的过程,可能辐射能量,也可能吸收能量答案BC解析根据玻尔理论,核外电子运动的轨道半径是确定的值,而不是任意值,A错误;氢原子中的电子离原子核越远,能级越高,能量越大,B正确;由跃迁规律可知C正确;氢原子从激发态向基态跃迁的过程中,应辐射能量,D错误.【例2】氢原子的核外电子从距核较近的轨道跃迁到距核较远的轨道的过程中() A.原子要吸收光子,电子的动能增大,原子的电势能增大B .原子要放出光子,电子的动能减小,原子的电势能减小C .原子要吸收光子,电子的动能增大,原子的电势能减小D .原子要吸收光子,电子的动能减小,原子的电势能增大答案 D解析 根据玻尔理论,氢原子核外电子在离核较远的轨道上运动能量较大,必须吸收一定能量的光子后,电子才能从离核较近的轨道跃迁到离核较远的轨道,故B 错;氢原子核外电子绕核做圆周运动,由原子核对电子的库仑力提供向心力,即:k e 2r 2=m v 2r ,又E k =12m v 2,所以E k =ke 22r.由此式可知:电子离核越远,即r 越大时,电子的动能越小,故A 、C 错;由r 变大时,库仑力对核外电子做负功,因此电势能增大,从而判断D 正确.借题发挥 当氢原子从低能量态E n 向高能量态E m (n <m )跃迁时,r 增大,E k 减小,E p 增大(或r 增大时,库仑力做负功,电势能E p 增大),E 增大,故需吸收光子能量,所吸收的光子能量hν=E m -E n .二、原子能级和能级跃迁的理解1.氢原子能级图如图2所示图2 2.根据氢原子的能级图可以推知,一群量子数为n 的氢原子跃迁到基态时,可能辐射出不同频率的光子数可用N =C 2n =n (n -1)2计算. 3.原子从低能级向高能级跃迁:只能吸收一定能量的光子,即当一个光子的能量满足hν=E 末-E 初时,才可能被某一个原子吸收,而当光子能量hν大于或小于E 末-E 初时都不能被原子吸收;原子从高能级向低能级跃迁,以光子的形式向外辐射能量,所辐射的光子能量恰等于发生跃迁时的两能级间的能量差.【例3】 如图3所示,氢原子从n >2的某一能级跃迁到n =2的能级,辐射出能量为2.55 eV 的光子,问最少要给基态的氢原子提供多少电子伏特的能量,才能使它辐射上述能量的光子?请在图中画出获得该能量后的氢原子可能的辐射跃迁图.图3答案 12.75 eV 跃迁图见解析图 解析 氢原子从n >2的某一能级跃迁到n =2的能级,满足:hν=E n -E 2=2.55 eV E n =hν+E 2=-0.85 eV所以n =4基态氢原子要跃迁到n =4的能级,应提供的能量为ΔE =E 4-E 1=12.75 eV .跃迁图如图所示.借题发挥 (1)如果是一个氢原子,从某一激发态向基态跃迁时,可能发出的不同频率的光子数为n -1.(2)如果是一群氢原子,从某一激发态向基态跃迁时,发出不同频率的光子数为:N =n (n -1)2. 针对训练 如图4所示,1、2、3、4为玻尔理论中氢原子最低的四个能级.处在n =4能级的一群氢原子向低能级跃迁时,能发出若干种频率不同的光子,在这些光子中,波长最长的是( )图4。

玻尔的原子模型知识集结知识元玻尔的原子模型知识讲解玻尔的原子模型1.玻尔原子模型玻尔认为,围绕原子核运动的电子轨道半径只能是某些分立的数值,这种现象叫做轨道量子化;不同的轨道对应着不同的状态,在这些状态中,尽管电子在做变速运动,却不辐射能量,因此这些状态是稳定的;原子在不同的状态中具有不同的能量,所以原子的能量也是量子化的.将以上内容进行归纳,玻尔理论有三个要点:(1)原子只能处于一系列的不连续的能量状态中,在这些状态中原子是稳定的.电子虽然绕核旋转,但并不向外辐射能量,这些状态叫定态.可见,电子如果从一个轨道到另一个轨道,不是以螺旋线的形状改变半径大小的,而是从一个轨道上“跳跃”到另一个轨道上,玻尔将这种现象称为跃迁.2.能级在玻尔模型中,原子的可能状态是不连续的,因此各状态对应的能量也是不连续的.这些能量值叫做能级.各状态的标号1,2,3,……,叫做量子数,通常用n表示.能量最低的状态叫做基态,其他状态叫做激发态,基态和各激发态的能量分别用表示.(1)氢原子的能级.对氢原子而言,核外的一个电子绕核运行时,若半径不同,则对应着的原子能量也不同,若使原子电离,外界必须对原子做功,使电子摆脱它与原子核之间的库仑力的束缚,所以原子电离后的能量比原子其他状态的能量都高.我们把原子电离后的能量记为0,即选取电子离核处于无穷远处时氢原子的能量为零,则其他状态下的能量值就是负的.(2)能级图.氢原子的能级图如图所示.注意:①由能级图可知,由于电子的轨道半径不同,氢原子的能级不连续,这种现象叫能量量子化.②原子的能量包括:原子的原子核与电子所具有的电势能和电子运动的动能.③原子从基态跃迁到激发态时要吸收能量,而从激发态跃迁到基态则以光子的形式向外放出能量.无论是吸收能量还是放出能量,这个能量值不是任意的,而是等于原子发生跃迁的这两个能级问的能量差.Δx=hν,ν为发出光子的频率.④n=1对应于基态,n趋于无穷大,对应于原子的电离.3.光子的发射和吸收(1)能级的跃迁.根据玻尔模型,原子只能处于一系列的不连续的能量状态中,这些状态分基态和激发态两种.其中原子在基态时是稳定的,原子在激发态时是不稳定的,当原子处于激发态时会自发地向较低能级跃迁,经过一次或几次跃迁到达基态.注意:①原子能级跃迁时,处于激发态的原子可能经过一次跃迁回到基态;也可能由较高能级的激发态先跃迁到较低能级的激发态,最后回到基态.一个原子由较高能级回到基态,到底发生了几次跃迁,是不确定的.②物质中含有大量的原子,各个原子的跃迁方式也是不统一的.有的原子可能经过一次跃迁就回到基态,而有的原子可能经过几次跃迁才回到基态.(2)光子的发射.由上式可以看出,能级的能量差越大,放出光子的频率就越高.(3)光子的吸收.注意:由于原子的能级是一系列不连续的值,则任意两个能级差也是不连续的,故原子只能发射一些特定频率的光子,同样也只能吸收一些特定频率的光子.但是,当光子能量足够大时,如光子能量E≥13.6e V时,则处于基态的氢原子仍能吸收此光子并发生电离.4.氢原子核外电子绕核运动的轨道与其能量对应关系在氢原子中,电子围绕原子核运动,如将电子的运动轨道看做半径为r的圆周,则原子核与电子之间的库仑力为电子做匀速圆周运动所需的向心力,那么由库仑定律和牛顿第二定律,有,①电子的动能为;②电子在半径为r的轨道上所具有的电势能为;③原子的总能量就是电子的动能和电势能的代数和,即.④注意:比较可得:例题精讲玻尔的原子模型例1.如图是氢原子的能级示意图。
第三节波尔的原子模型三维教学目标1、知识与技能(1)了解玻尔原子理论的主要内容;(2)了解能级、能量量子化以及基态、激发态的概念。
2、过程与方法:通过玻尔理论的学习,进一步了解氢光谱的产生。
3、情感、态度与价值观:培养我们对科学的探究精神,养成独立自主、勇于创新的精神。
教学重点:玻尔原子理论的基本假设。
教学难点:玻尔理论对氢光谱的解释。
教学方法:教师启发、引导,学生讨论、交流。
(一)引入新课提问:(1)α粒子散射实验的现象是什么?(2)原子核式结构学说的内容是什么?(3)卢瑟福原子核式结构学说与经典电磁理论的矛盾?为了解决上述矛盾,丹麦物理学家玻尔,在1913年提出了自己的原子结构假说。
(二)进行新课1、玻尔的原子理论(1)能级(定态)假设:原子只能处于一系列不连续的能量状态中,在这些状态中原子是稳定的,电子虽然绕核运动,但并不向外辐射能量。
这些状态叫定态。
(本假设是针对原子稳定性提出的)(2)跃迁假设:原子从一种定态(设能量为E n)跃迁到另一种定态(设能量为E m)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即n m E E h -=ν(h 为普朗克恒量)(本假设针对线状谱提出)(3)轨道量子化假设:原子的不同能量状态跟电子沿不同的圆形轨道绕核运动相对应。
原子的定态是不连续的,因此电子的可能轨道的分布也是不连续的。
(针对原子核式模型提出,是能级假设的补充)2、玻尔根据经典电磁理论和牛顿力学计算出氢原子的电子的各条可能轨道半径和电子在各条轨道上运动时的能量(包括动能和势能)公式:轨道半径:12r n r n = n=1,2,3……能 量: 121E nE n = n=1,2,3…… 式中r 1、E 1、分别代表第一条(即离核最近的)可能轨道的半径和电子在这条轨道上运动时的能量,r n 、E n 分别代表第n 条可能轨道的半径和电子在第n 条轨道上运动时的能量,n 是正整数,叫量子数。
第3节 玻尔的原子模型
玻 尔 原 子 模 型
[先填空]
1.卢瑟福的原子核式结构模型能够很好地解释α粒子与金箔中原子碰撞所得到的信息,但不能解释原子光谱是特征光谱和原子的稳定性.
2.玻尔原子理论的主要内容
(1)原子只能处于一系列能量不连续的状态中,这些状态叫作定态.
(2)原子从一种定态跃迁到另一种定态时,吸收(或辐射)一定频率的光子能量h ν,其中h 为普朗克常量,h =6.63×10-34 J ·s ,ν为光的频率.
(3)原子的不同能量状态对应于电子的不同运行轨道.只有电子的轨道半径r 跟电子动量m e v 的乘积满足m e vr =n ·h
2π
(n =1,2,3,…)的轨道才是可能的. [再判断]
1.玻尔理论全面否定了原子的核式结构模型.(×)
2.玻尔认为原子是稳定的,电子绕核旋转但不向外辐射能量.(√)
3.原子跃迁时吸收或辐射光子的能量必须是两能级之差.(√)
[后思考]
请详细阐述原子核式结构模型与经典电磁理论的矛盾.
【提示】电子绕核做圆周运动是加速运动,按照经典理论,加速运动的电荷要不断地向周围发射电磁波,电子的能量就要不断减少,最后电子要落到原子核上,这与原子通常是稳定的事实相矛盾.
[核心点击]
1.轨道量子化:轨道半径只能够是一些不连续的、某些分立的数值.
氢原子各条可能轨道上的半径r n=n2r1(n=1,2,3,…)
其中n是正整数,r1是离核最近的可能的轨道半径,r1=0.53×10-10 m.其余可能的轨道半径还有0.212 nm、0.477 nm…不可能出现介于这些轨道半径之间的其他值.这样的轨道形式称为轨道量子化.
2.能量量子化
(1)电子在可能轨道上运动时,虽然是变速运动,但它并不释放能量,原子是稳定的,这样的状态也称之为定态.
(2)由于原子的可能状态(定态)是不连续的,具有的能量也是不连续的.这样的能量值,称为能级,能量最低的状态称为基态,基态最稳定,其他的状态叫作激发
态,对氢原子,以无穷远处为势能零点时,其能级公式E n=1
n2
E1(n=1,2,3,…)
其中E1代表氢原子的基态的能级,即电子在离核最近的可能轨道上运动时原子的能量值,E1=-13.6 eV.n是正整数,称为量子数.量子数n越大,表示能级越高.
(3)原子的能量包括:原子的原子核与电子所具有的电势能和电子运动的动能.
3.跃迁:原子从一种定态(设能量为E2)跃迁到另一种定态(设能量为E1)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,
高能级E m 发射光子hν=E m-E n
吸收光子hν=E m-E n低能级E n.
可见,电子如果从一个轨道到另一个轨道,不是以螺旋线的形式改变半径大小的,而是从一个轨道上“跳跃”到另一个轨道上.玻尔将这种现象叫作电子的跃迁.
1.关于玻尔的原子模型理论,下面说法正确的是( )
A.原子可以处于连续的能量状态中
B.原子的能量状态是不连续的
C.原子中的核外电子绕核做加速运动一定向外辐射能量
D.原子中的电子绕核运转的轨道半径是连续的
【解析】根据玻尔原子理论:电子轨道和原子能量都是量子化的,不连续的,处于定态的原子并不向外辐射能量,可判定B是正确的.
【答案】 B
2.(多选)根据玻尔理论,下列关于氢原子的论述正确的是( )
A.若氢原子由能量为E n的定态向能量为E m的低能级跃迁,则氢原子要辐射的光子能量hν=E m-E n
B.电子沿某一轨道绕核运动,若圆周运动的频率为ν,则其发光的频率也是νC.一个氢原子中的电子从一个半径为r a的轨道自发地直接跃迁到另一半径为r b的轨道,已知r a>r b,则此过程原子要辐射某一频率的光子
D.氢原子吸收光子后,将从高能级向低能级跃迁。