各国药典微生物方法对比
- 格式:doc
- 大小:11.51 KB
- 文档页数:3

中国药典2015版无菌检查法与美、欧、日药典的差异分析与讨论潘友文(罗氏/基因泰克,美国南旧金山,94080)2016年07月29日摘要目的:分析中国药典2015版无菌检查法与美、欧、日药典无菌检查法的之间的差异性,为评价不同药典中无菌检查法的等效性提供参考。
方法:对无菌检查法的主要实验步骤和参数进行一对一比较,对有差异的步骤和参数进行科学论证和评价。
结果:中国药典2015版无菌检查法与美、欧、日药典无菌检查法的主要参数和步骤是一致的,但中国药典无菌检查法还需要做阳性对照和厌氧需氧菌的额外培养。
并且,中国药典用大肠埃希菌代替美、欧、日药典中的铜绿假单胞菌参与无菌检查法的适用性试验。
结论:各药典的无菌检查法是等效的。
在不影响方法等效性的前提下,中国药典2015版无菌检查法在阳性对照和培养方法上还可以进一步简化。
关键词:无菌检查法;中国药典;美国药典;欧洲药典;日本药典Gap Assessment and Discussion on Sterility Tests in Chinese Pharmacopoeia 2015, United States Pharmacopoeia, European Pharmacopoeia, and Japanese PharmacopoeiaYouwen Pan (Genentech, a Member of Roche, South San Francisco, USA 94080)Abstract Objective:Gap assessment and discussion on the sterility test methods in Chinese Pharmacopoeia 2015 edition (CP2015), United States Pharmacopoeia (USP), European Pharmacopoeia (EP), and Japanese Pharmacopoeia (JP). Method:The test procedures and key parameters in the sterility test methods in different pharmacopoeia were compared step by step and the differences were identified. The identified differences are scientifically evaluated for their impact to the equivalence of the methods. Result:The sterility test method in CP2015 is largely harmonized with that in USP, EP and JP except for a few differences. Positive control and extra incubation bacteria are required in CP2015 only, and Escherichia coli is used in method suitability test in CP2015 while Pseudomonas aeruginosa is used in USP/EP/JP. Conclusion:The Sterility Test Methods in CP2015, USP, EP, and JP are equivalent. The method in CP2015 could be simplified more without compromising the validity, accuracy and reliability of the method.Key words:sterility test;Chinese Pharmacopoeia 2015;United States Pharmacopoeia;European Pharmacopoeia; Japanese Pharmacopoeia无菌检查法是用于检查药典规定的无菌物品是否被微生物污染的检测方法。

鲎试剂-LAL,中国药典和美国药典的内毒素检测要求鲎试剂是从栖生于海洋的节肢动物“鲎”的兰色血液中提取变形细胞溶解物,经低温冷冻干燥而成的生物试剂,专用于细菌内毒素检测。
鲎试验法是国际上至今为止检测内毒素最好的方法,它简单﹑快速﹑灵敏﹑准确,因而被欧美药典及我国药典定为法定内毒素检查法,并已被世界各国所采用。
目前国际上销售的鲎试剂有两种,一种称美洲鲎试剂(Limulus Amebocyte Lysate),缩写为LAL,由美国生产;另一种称东方鲎鲎试剂(Tachypleus Amebocyte Lysate),缩写为TAL。
实验证明:美洲鲎试剂-LAL比东方鲎试剂LAL更纯洁,检测效果更好。
TAL检查内毒素有很多方法,目前应用最广泛的是凝胶法,此外还有动态浊度法﹑显色基质法,比色法等。
其用途有以下几方面:1. 药检:用于注射药品﹑放射性药物﹑生物制品﹑注射器及生产工艺流程中的内毒素检测;2. 临床:用于检测病人各种体液中的内毒素含量;3. 其他:用于检测水或食品中的内毒素含量。
2005年版中国药典《细菌内毒素检查法-鲎试剂法》(鲎试剂-LAL法)本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶法结果为准。
细菌内毒素的量用内毒素单位(EU)表示。
细菌内毒素国家标准品系自大肠杆菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度和标定细菌内毒素工作标准品的效价。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于试验中鲎试剂灵敏度复核、干扰试验及设置的各种阳性对照。
凝胶法细菌内毒素检查用水系指内毒素含量小于0.015EU/ml的灭菌注射用水。
定量测定用的细菌内毒素检查用水,其内毒素的含量应小于0.005EU/ml。

姓名:徐涛学号:14211020462 专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。


15版药典与10版药典微生物区别一、微生物计数法1、计数方法(1)平皿法(15版包含平皿法、涂布法)(2)薄膜过滤法(3)MPN法(最可能数法)新增2、计数培养基适用性检查(1)菌种及菌液的制备15版药典新增PH7.0无菌氯化钠-蛋白胨缓冲液可以作为稀释液,0.9℅无菌氯化钠同样可以使用。
金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌增菌由营养肉汤培养基或营养琼脂培养基改为胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基。
白色念珠菌增菌由改良马丁培养基或改良马丁琼脂培养基改为沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养基,培养温度由23~28℃改为20~25℃。
黑曲霉增菌由改良马丁琼脂斜面培养基改为沙氏葡萄糖琼脂培养基或马铃薯葡萄糖琼脂培养基,培养温度由23~28℃改为20~25℃。
(2)培养基适用性检查10年药典判断依据:被检培养基上的菌落平均数不小于对照培养基上的菌落平均数的70℅,且菌落形态大小与对照培养基上的菌落一致。
15年药典判断依据:被检固体培养基上的菌落平均数与对照培养基上的菌落平均数的比值应在0.5~2范围内,且菌落形态大小与对照培养基上的菌落一致;被检液体培养基管与对照培养基管比较,试验菌应生长良好。
3、供试品计数方法适用性试验(1)供试液的制备10年药典制备方法特点:稀释液为PH7.0无菌氯化钠蛋白胨缓冲液分类:液体供试品,固体、半固体或黏稠性供试品,需用特殊方法制备供试液的供试品(非水溶性供试品、膜剂供试品、肠溶及结肠溶制剂供试品、气雾剂喷雾剂供试品、贴膏剂供试品、具抑菌活性的供试品)。
15年药典制备方法特点:稀释液为PH7.0无菌氯化钠蛋白胨缓冲液,或PH7.25磷酸盐缓冲液,或胰酪大豆胨液体培养基分类:水溶性供试品,水不溶性非油脂类供试品,油脂类供试品,需用特殊方法制备供试液的供试品(膜剂供试品、肠溶及结肠溶制剂供试品、气雾剂喷雾剂供试品、贴膏剂供试品)(2)抗菌活性的去除或灭活15年药典方法比10年药典少了离心沉淀法4、供试品检查(1)检验量10年药典:一般应随机抽取不少于检验用量(两个以上最小包装单位)的3倍量供试品。
它山之石------ USP29“微生物限度检查法”供大家学习参考,我认为USP29内确实有许多值得我们学习的东西,但在编辑《中国药典》时也要考虑到我国实际情况,本着真正能提高药品质量的目的,如一味地照抄照搬别人的东西,就会出现看看药品标准确实是上去了,体面、拿的出去,但在实际应用时不适宜操作,反而降低了对药品质量的控制。
我认为2005年版、2010年版的《中国药典》微生物限度检查法就是如此,2005版药典执行后就开始需要进行药品的验证工作,相同的药品不同的厂家之间要验证;既是同一厂家由于生产原料厂家的改变也要验证,因此各厂家之间出现了五花八门的都称已经验证的检验方法,有的说该方法可行,有的又说该方法不行,天知道这些验证方法的可信度?同时又出台了执行药典通知:以后未经验证的检品不能下“微生物限度检查符合规定”的结论。
我国有这么多的药品生产厂家,作为我国药品的监督检验单位,对药品检验来说怎样去验证,每做一个检品都去验证,这样的工作量现实吗?到今天药典还没有一个对具体样品经验证后较科学的检验方法或指导性方法。
我认为现行的“微生物限度检查”法参照USP的方法对具体的样品验证,并按经验证后的方法进行检验,这确实有利于微生物的检出率,提升药品检验标准。
但应分步进行:可先放在“药典附录指导性原则”内,然后再要求药品生产企业对自己生产的品种进行验证并报地市级以上药品检验所对该方法再次进行检验审核后,再报药典会汇总、审核,在《中国药典》具体品种项下写入检验方法后再开始实施。
目前这一步到位的做法,已从2005年版药典实施开始到2010年版的《中国药典》实施,效果到底怎样?我想:从有关专业杂志的相关文章内也可知一、二。
<61> 微生物限度检查本章所提供的检测程序用于测定包括原料药及制剂在内的各种药品中需氧菌数量以及不含有指定的微生物。
如果已有充分的证据证明某种自动化的方法可以给出与本章所提供的方法等效的或更好的实验结果,可以用该方法替代本章所提供的方法。
各国药典微生物方法对比
本篇文章旨在比较各国药典中微生物检测方法的不同之处。
微生物检测对于保证药品的质量和安全至关重要,各国药典都提供了相应的指导和标准。
然而,由于各国的文化、法律和技术差异,各国的药典在微生物检测方法上存在一定的差异。
以下将以中括号内的内容为主题,详细介绍各国药典中微生物方法对比。
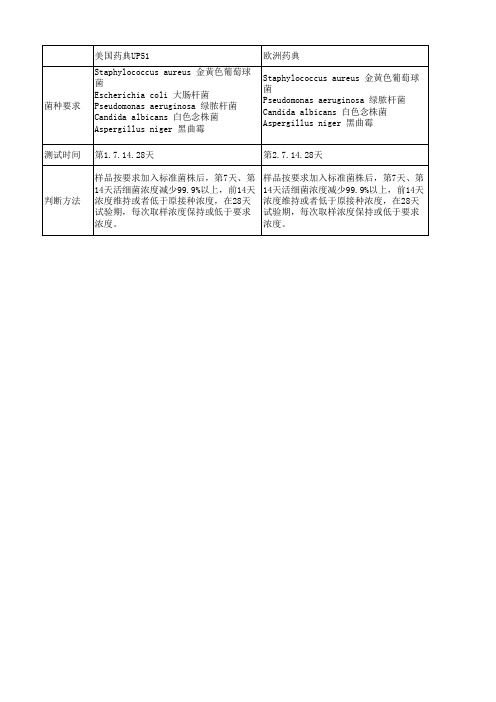
[美国药典(USP)微生物方法]
美国药典(USP)是全球最主要的药典之一,其微生物检测方法有着广泛的应用。
USP推荐的微生物方法主要基于美国食品药品监督管理局(FDA)的要求,主要包括细菌计数、限度测试和特定微生物检测。
其方法的特点在于简单易行、结果可靠且易于验证。
其中,细菌计数方法主要采用菲斯特计数法或冷凝液计数法。
而在限度测试方面,则主要采用的方法是逐级稀释、涂布法和培养法。
USP还明确规定了一些特定微生物的检测方法,如大肠菌群、铜绿假单胞菌和金黄色葡萄球菌等,其检测方法主要依赖于PCR技术和传统的培养法。
[欧洲药典(Ph. Eur.)微生物方法]
欧洲药典(Ph. Eur.)是欧洲地区药典的统一标准,其微生物方法与美国
药典存在一定的差异。
Ph. Eur.对微生物检测也有着详细的规定,包括细菌计数、限度测试和特定微生物检测。
在细菌计数方面,Ph. Eur.主要采用薄膜过滤法或蔗糖凝胶法。
而在限度
测试方面,Ph. Eur.则主要采用稀释平板法、滚珠法和过滤膜方法。
与USP 不同的是,Ph. Eur.也明确规定了一些特定微生物的检测方法,如霉菌和
酵母菌等。
这些检测方法涵盖了PCR技术、酶联免疫吸附试验(ELISA)和传统的培养法。
[中国药典(ChP)微生物方法]
中国药典(ChP)是中国主要的药典标准,其微生物方法也存在一定的特点。
ChP的微生物检测主要分为总菌落计数、限度测试和特定微生物检测。
与美欧药典不同的是,ChP对微生物检测方法的规定相对较为简洁。
在细菌计数方面,ChP主要采用的方法有薄膜过滤法、落下法和滚珠法等。
而在限度测试方面,ChP则主要采用的方法有稀释平板法、过滤法和膏状法。
特定微生物的检测方法包括了一些重要的致病菌,如大肠菌群、金黄色葡萄球菌和酵母菌等。
这些方法主要依赖于生物化学试剂盒和PCR技术。
不同国家的药典在微生物检测方法上存在一定的差异主要是因为法律要求、技术水平和文化背景等的不同。
但无论使用哪种方法,确保药品的微生物质量和安全是最重要的。
因此,了解不同国家药典中微生物检测方法的不同之处,可以帮助我们更好地理解和应用这些方法,以保障公众的用药安全。
综上所述,美国药典、欧洲药典和中国药典中的微生物检测方法存在一定的差异。
这些差异主要体现在细菌计数、限度测试和特定微生物的检测方法上。
了解这些差异可以帮助我们更好地选择和应用适合自身需求的微生物检测方法,确保药品的质量和安全。