显微镜直接计数法
- 格式:doc
- 大小:33.00 KB
- 文档页数:1

显微镜直接计数法实验报告实验报告:显微镜直接计数法一、实验目的本实验旨在通过显微镜直接计数法,测定微生物样品中细胞的数量,以了解其生长和繁殖情况,为生物工程、生物医学、环境科学等领域的研究提供依据。
二、实验原理显微镜直接计数法是一种通过显微镜直接观察并计数样品中微生物数量的方法。
该方法具有操作简便、快速等优点,适用于测定样品中微生物的数量和生长情况。
通过显微镜直接计数法,可以观察到微生物的形态、大小、分布等情况,从而对其生长环境、生长状况等进行评估。
三、实验步骤1.样品制备:将待测样品进行适当稀释,使微生物细胞分散均匀。
2.显微镜观察:将样品滴加到显微镜载玻片上,用盖玻片固定,调整显微镜焦距,观察并计数微生物的数量。
3.计数方法:采用直接计数法,即直接观察并计数样品中的微生物数量。
对于压在盖玻片下的细胞,可以通过轻轻移动盖玻片进行观察和计数。
4.数据记录:记录每个样品中微生物的数量,并计算平均值。
同时记录观察到的细胞形态、大小、分布等情况。
5.结果分析:根据实验数据,分析微生物的生长情况、繁殖速度等。
四、实验结果及数据分析1.实验数据(见附表1)附表1:显微镜直接计数法实验数据2.数据分析通过附表1的数据,我们可以得出以下结论:(1)样品A中微生物的数量较少,而样品B、C、D中微生物的数量较多。
这表明不同样品中微生物的数量存在差异。
(2)在相同稀释倍数下,观察到的细胞数越多,计数结果越准确。
因此,选择合适的稀释倍数对于准确测定微生物数量至关重要。
在本实验中,选择100倍和1000倍作为稀释倍数,可以较为准确地测定微生物数量。
(3)通过对比不同样品在同一稀释倍数下的计数结果,可以得出不同样品中微生物的生长情况。
例如,样品B和D在1000倍稀释下的计数结果较高,说明这两个样品中微生物的生长情况较好。
而样品A和C在100倍稀释下的计数结果较低,说明这两个样品中微生物的生长情况较差。
(4)根据实验数据,可以进一步分析微生物的生长规律和繁殖速度。

显微镜直接计数法原理
显微镜直接计数法是一种用于测定溶液中微粒数量的方法,其原理是通过显微镜观察溶液中的微粒并进行直接计数。
这种方法适用于微粒浓度较低的溶液。
在进行显微镜直接计数之前,需要将待测溶液适当稀释,以保证在显微镜下观察到的微粒较为分散,不会产生严重的重叠。
然后,取少量稀释好的溶液放置在显微镜下的玻片上,利用显微镜进行观察和计数。
在显微镜观察过程中,可以使用目视计数法或者计数仪来进行微粒数量的计数。
目视计数法是通过直接观察显微镜视野中的微粒数量来进行计数,但这种方法需要操作人员具备一定的经验和技巧,否则容易产生误差。
计数仪则是通过将显微镜和计数器结合在一起,使用计数仪的软件进行自动计数,可以提高计数的准确性和效率。
在进行显微镜直接计数时,需要注意减小观察误差。
例如,应该避免在显微镜下对颗粒悬浮物的快速移动进行计数,应尽量保持视野稳定。
此外,还要随机选择计数视野,以确保样本的代表性。
显微镜直接计数法不仅可以用于测定溶液中的微粒数量,还可以用于观察微粒的形状、大小和分布情况。
但是,由于此方法需要借助显微镜进行观察,操作相对繁琐,且对于微粒浓度较高的溶液不适用。
因此,在实际应用中,常常需要结合其他测量方法来进行微粒数量的确定,以提高准确性和可靠性。

利用血球计数板在显微镜下直接计数,是一种常用的微生物计数方法。
此法的优点是直观、快速。
将经过适当稀释的菌悬液(或孢子悬液)放在血球计数板载玻片与盖玻片之间的计数室中,在显微镜下进行计数。
由于计数室的容积是一定的(㎜3),所以可以根据在显微镜下观察到的微生物数目来换算成单位体积内的微生物总数目。
由于此法计得的是活菌体和死菌体的总和,故又称为总菌计数法。
血球计数板,通常是一块特制的载玻片,其上由四条槽构成三个平台。
中间的平台又被一短横槽隔成两半,每一边的平台上各刻有一个方格网,每个方格网共分九个大方格,中间的大方格即为计数室,微生物的计数就在计数室中进行。
计数室的刻度一般有两种规格,一种是一个大方格分成16个中方格,而每个中方格又分成25个小方格,共400小格;另一种是一个大方格分成25个中方格,而每个中方格又分成16个小方格,总共也是400小格。
所以无论是哪种规格的计数板,每一个大方格中的小方格数都是相同的。
每一个大方格边长为1㎜,则每一大方格的面积为1㎜2,盖上盖玻片后,载玻片与盖玻片之间的高度为㎜,所以计数室的容积为㎜3。
其计算方法如下:1.16×25的计数板计算公式细胞数/ml=(100小格内的细胞数/100)×400×1000×稀释倍数2.25×16的计数板计算公式细胞数/ml=(80小格内的细胞数/80)×400×1000×稀释倍数器材酵母菌悬液,血球计数板,显微镜,盖玻片,无菌毛细管等。
操作步骤1.稀释:将酵母菌悬液进行适当稀释,菌液如不浓,可不必稀释。
2.镜检计数室:在加样前,先对计数板的计数室进行镜检。
若有污物,则需清洗后才能进行计数。
3.加样品:将清洁干燥的血球计数板盖上盖玻片,再用无菌的细口滴管将稀释的酵母菌液由盖玻片边缘滴一小滴(不宜过多),使菌液沿缝隙靠毛细渗透作用自行进入计数室,一般计数室均能充满菌液。

显微镜直接计数法实验报告一、实验目的1、了解显微镜直接计数法的原理和应用。
2、掌握血细胞计数板的使用方法。
3、学会对细胞进行计数,并计算细胞浓度。
二、实验原理显微镜直接计数法是利用血细胞计数板在显微镜下直接计数细胞的一种方法。
血细胞计数板是一块特制的厚玻璃片,板上有四个槽构成三个平台。
中间的平台又被一短横槽隔成两半,每半边上面刻有一个方格网。
方格网上刻有 9 个大方格,其中只有中间的一个大方格为计数室。
计数室的刻度一般有两种规格,一种是一个大方格分成 16 个中方格,而每个中方格又分成 25 个小方格;另一种是一个大方格分成 25 个中方格,而每个中方格又分成 16 个小方格。
但无论哪种规格,每个大方格的边长均为 1 毫米,盖上盖玻片后,计数室的容积是固定的。
因此,在计数时,只要测定一定体积的样品在计数室中所占的方格数,就能计算出样品中的细胞数量。
三、实验材料与设备1、材料酵母菌悬液2、设备显微镜血细胞计数板盖玻片吸管擦镜纸四、实验步骤1、准备血细胞计数板用酒精棉球擦拭计数板和盖玻片,然后用擦镜纸擦干。
将盖玻片盖在计数板上。
2、制备酵母菌悬液用无菌吸管吸取适量的酵母菌培养液,加入一定量的无菌生理盐水,充分混匀,制成适宜浓度的酵母菌悬液。
3、加样用吸管吸取酵母菌悬液,从盖玻片边缘滴一小滴(不宜过多),使菌液自行渗入计数室,注意不可有气泡产生。
4、计数静置片刻,待酵母菌细胞全部沉降到计数室底部后,将血细胞计数板置于显微镜载物台上。
先用低倍镜找到计数室,再换高倍镜进行计数。
计数时,对于压在方格线上的细胞,只计上线和左线的细胞。
5、计算统计五个中方格中的细胞总数,然后按下式计算:每毫升菌液中的细胞数=五个中方格中的细胞总数 × 5 × 10000 ×稀释倍数五、实验结果与分析1、实验结果经过计数,五个中方格中的细胞总数为_____个。
本次实验所使用的酵母菌悬液稀释倍数为_____倍。


显微镜直接计数法实验报告显微镜直接计数法实验报告引言:显微镜直接计数法是一种常用的实验方法,用于测量微生物的数量和浓度。
通过直接观察显微镜下的视野,并进行计数,可以得出微生物的数量。
本实验旨在通过显微镜直接计数法,研究不同样本中微生物的数量和浓度变化。
实验材料和方法:1. 高倍显微镜2. 干净的载玻片和盖玻片3. 滴管和移液器4. 无菌培养基5. 不同样本(例如水样、土壤样本等)实验步骤:1. 准备工作:将载玻片和盖玻片用酒精擦拭干净,确保无菌状态。
2. 取一滴待测样本,滴在载玻片上。
3. 将盖玻片轻轻压在载玻片上,使样本均匀分布。
4. 将载玻片放在显微镜下,使用高倍镜观察。
5. 随机选择一个视野,计数视野中的微生物数量。
6. 移动显微镜的平台,选择下一个视野,继续计数。
7. 重复步骤6,直到计数足够多的视野。
8. 计算平均值,并根据视野的大小和显微镜的倍数,计算出微生物的数量和浓度。
实验结果:经过实验,我们得到了不同样本中微生物的数量和浓度数据。
例如,在水样中,我们观察到每个视野中的微生物数量平均为50个,视野的面积为0.01 mm²,显微镜的倍数为400倍。
因此,水样中微生物的数量为50个/0.01 mm² * 400 = 200,000个/mm²。
通过类似的计算,我们可以得出其他样本中微生物的数量和浓度。
讨论与分析:通过显微镜直接计数法,我们可以快速获得微生物的数量和浓度数据。
然而,这种方法也存在一些限制。
首先,由于显微镜的视野有限,我们只能观察到局部区域的微生物数量,可能无法代表整个样本的情况。
其次,显微镜直接计数法对于微生物形态和大小的要求较高,较小或较大的微生物可能无法准确计数。
此外,样本的准备和操作也可能影响到实验结果的准确性。
结论:显微镜直接计数法是一种常用的实验方法,用于测量微生物的数量和浓度。
通过观察显微镜下的视野,并进行计数,可以得出微生物的数量。


显微镜直接计数法名词解释
显微镜直接计数法是一种常用的微生物计数方法,它通过显微镜直接观察和计数样品中的细胞或微生物数量。
这种方法的具体步骤是,首先将少量待测样品的悬浮液置于一种特别的具有确定面积和容积的载玻片上(血球计数板),然后在显微镜下直接计数每个格子内的细胞或微生物数量,最后根据格子面积和体积推算出单位体积内的细胞或微生物数量。
显微镜直接计数法的优点包括操作简单、结果直观、可以测定所有形态的细胞或微生物、结果准确、误差小等。
然而,这种方法也存在一些缺点,例如不能区分细胞或粒子的死亡或活性、容易产生误差、需要经验丰富的操作者进行操作、需要时间和劳动力成本高等。
在应用显微镜直接计数法时,需要注意以下几点:首先,样品的稀释比例要适当,以避免细胞或微生物聚集在一起而影响计数结果;其次,要选择合适的血球计数板,根据需要选择不同的规格;最后,在计数过程中要遵守规定的计数规则,以确保结果的准确性和可靠性。
总之,显微镜直接计数法是一种简单、快速、直观的微生物计数方法,适用于各种实验室和科研机构的使用。
在使用该方法时,需要注意操作步骤和注意事项,以保证结果的准确性和可靠性。


实验10 细菌计数返回目录一、显微镜直接计数法【原理】显微镜直接计数法是将小量待测样品的悬浮液置于一种特别的具有确定面积和容积的载玻片上(又称计菌板),于显微镜下直接计数细菌的一种简便、快速、直观的方法。
该法适用于各种单细胞菌体的纯培养悬浮液,目前国内外常用的计菌板有:血细胞计数板、Peteroff-Hauser计菌板以及Hawksley计菌板等,血球计数板适用于菌体较大的酵母菌或霉菌孢子的计数,后两种计菌板适用于一般细菌的计数。
这几种计数板的原理和部件相同,只是细菌计数板较薄,盖玻片和载玻片之间的距离只有0.02mm,可以使用油镜观察。
而血球计数板较厚,不能使用油镜。
这里介绍血球计数板方法计数酵母菌数量。
血球计数板是一块特制的厚型载玻片,载玻片上有4条槽所构成的3个平台。
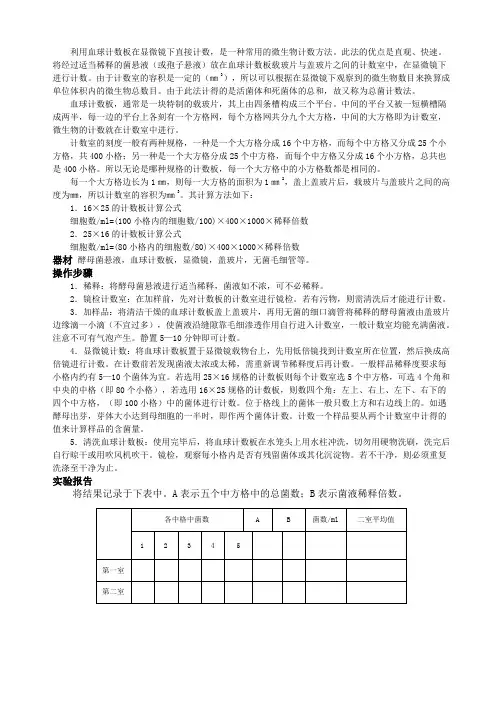
中间的平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各有一个计数区,计数区的刻度有两种:一种是一个大方格分为16个中方格(四角的四个大方格),每个中方格又分25个小方格;另一种是一个大方格分成25个中方格(中央的一个大方格),而每个中方格又分成16个小方格,即计数区都由400个小方格组成(图1-3-12)。
图1-3-12 血细胞计数板构造计数区(一个大方格)边长为1mm,则计数区的面积为l mm2,每个小方格的面积为1/400mm2。
盖上盖玻片后,计数区的高度为0.1mm,所以计数区的体积为0.1mm3,每个小方格的体积为l/4000mm3。
使用血球计数板计数时,先要测定每个小方格中微生物的数量,再换算成每mL菌液(或每g样品)中微生物细胞的数量。
已知:1ml体积=10mm×10mm×10mm=1000mm3所以:1ml体积应含有小方格数为1000mm3/(1/4000mm3)=4×106个小方格。
因此:每ml菌悬液中含有细胞数=4×106×每个小格中细胞平均数×菌液稀释倍数。
显微镜直接计数法流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!显微镜直接计数法是一种常用的微生物计数方法,以下是其详细流程:1. 准备工作:确保显微镜处于正常工作状态,镜头清洁,光源充足。
血球计数板计数法
利用血球计数板在显微镜下直接计数,是一种常用的微生物计数方法。
此法的优点是直观、快速。
将经过适当稀释的菌悬液(或孢子悬液)放在血球计数板载玻片与盖玻片之间的计数室中,在显微镜下进行计数。
由于计数室的容积是一定的(0.1㎜3),所以可以根据在显微镜下观察到的微生物数目来换算成单位体积内的微生物总数目。
由于此法计得的是活菌体和死菌体的总和,故又称为总菌计数法。
血球计数板,通常是一块特制的载玻片,其上由四条槽构成三个平台。
中间的平台又被一短横槽隔成两半,每一边的平台上各刻有一个方格网,每个方格网共分九个大方格,中间的大方格即为计数室,微生物的计数就在计数室中进行。
计数室的刻度一般有两种规格,一种是一个大方格分成16个中方格,而每个中方格又分成25个小方格,共400小格;另一种是一个大方格分成25个中方格,而每个中方格又分成16个小方格,总共也是400小格。
所以无论是哪种规格的计数板,每一个大方格中的小方格数都是相同的。
每一个大方格边长为1㎜,则每一大方格的面积为1㎜2,盖上盖玻片后,载玻片与盖玻片之间的高度为0.1㎜,所以计数室的容积为0.1㎜3。
其计算方法如下:
1.16×25的计数板计算公式
细胞数/ml=(100小格内的细胞数/100)×400×1000×稀释倍数
2.25×16的计数板计算公式
细胞数/ml=(80小格内的细胞数/80)×400×1000×稀释倍数
器材酵母菌悬液,血球计数板,显微镜,盖玻片,无菌毛细管等。
操作步骤
1.稀释:将酵母菌悬液进行适当稀释,菌液如不浓,可不必稀释。
2.镜检计数室:在加样前,先对计数板的计数室进行镜检。
若有污物,则需清洗后才能进行计数。
3.加样品:将清洁干燥的血球计数板盖上盖玻片,再用无菌的细口滴管将稀释的酵母菌液由盖玻片边缘滴一小滴(不宜过多),使菌液沿缝隙靠毛细渗透作用自行进入计数室,一般计数室均能充满菌液。
注意不可有气泡产生。
静置5—10分钟即可计数。
4.显微镜计数:将血球计数板置于显微镜载物台上,先用低倍镜找到计数室所在位置,然后换成高倍镜进行计数。
在计数前若发现菌液太浓或太稀,需重新调节稀释度后再计数。
一般样品稀释度要求每小格内约有5—10个菌体为宜。
若选用25×16规格的计数板则每个计数室选5个中方格,可选4个角和中央的中格(即80个小格),若选用16×25规格的计数板,则数四个角:左上、右上、左下、右下的四个中方格,(即100小格)中的菌体进行计数。
位于格线上的菌体一般只数上方和右边线上的。
如遇酵母出芽,芽体大小达到母细胞的一半时,即作两个菌体计数。
计数一个样品要从两个计数室中计得的值来计算样品的含菌量。
5.清洗血球计数板:使用完毕后,将血球计数板在水笼头上用水柱冲洗,切勿用硬物洗刷,洗完后自行晾干或用吹风机吹干。
镜检,观察每小格内是否有残留菌体或其化沉淀物。
若不干净,则必须重复洗涤至干净为止。
实验报告
将结果记录于下表中。
A表示五个中方格中的总菌数;B表示菌液稀释倍数。