实验三微生物生长曲线的测定
- 格式:docx
- 大小:45.63 KB
- 文档页数:4

测定细菌生长曲线一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时;2.学习液体培养基的配制以及接种方法;3.反复练习无菌操作技术;4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5.掌握利用细菌悬液混浊度间接测定细菌生长的方法;二、实验原理将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示,其计算公式为:G=(t2-t1)/[(lgW1-lgW2)/lg2]式中t2和t1为所取对数期两点的时间,W1和W2分别为对应时间测得的细胞含量或OD。
三、实验器材大肠杆菌,枯草杆菌菌液及平板;培养基(100mL/250mL三角瓶×10瓶/大组):牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支),无菌1000ul吸头若干,无菌5000ul吸头若干,比色皿10个及共用参比杯一个,培养箱3台,722s分光光度计;四、实验步骤1.活化菌种将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种6人大组分为3个小组,按表1接种。

微生物生物化学实验技术微生物生物化学实验技术是一门涉及微生物和生物化学的实验技术学科,其研究内容包括微生物的生长特性、代谢途径、原生态功能等方面。
在实验室中,通过一系列实验手段和技术手段,可以研究微生物的生物化学过程,揭示微生物在环境中的作用和影响。
一、菌种的保存和鉴定在微生物生物化学实验技术中,首先需要进行菌种的保存和鉴定工作。
菌种的保存是为了长期保存某种微生物,以备后续实验使用。
常见的保存方式包括在琼脂培养基上制备菌斑、制备冻干粉末或低温冷冻保存等。
而菌种鉴定则是为了确保所使用的微生物种属准确,常见的鉴定方法包括形态学观察、生理生化特性检测、分子生物学技术等。
二、微生物生长曲线的绘制和分析微生物生长曲线是研究微生物生长和繁殖规律的重要手段。
利用实验技术,可以通过不同培养条件下不同时间点的菌液浓度进行测定,从而得到微生物生长曲线。
通过绘制生长曲线并进行数据分析,可以了解微生物在不同生长阶段的生长速率、最大生长速率、最大生长速率等参数。
三、微生物代谢产物的检测和分析微生物代谢产物是微生物在代谢过程中产生的各种物质,包括有机酸、氨基酸、酶等。
通过实验技术,可以对微生物代谢产物进行检测和分析,了解微生物的代谢途径和代谢产物的种类及含量。
常见的检测方法包括高效液相色谱法、气相色谱-质谱联用法等。
四、微生物酶活性的测定和应用微生物酶是微生物体内产生的一种特殊蛋白质,具有催化作用。
通过实验技术,可以对微生物酶的活性进行测定,了解酶的催化特性和反应底物的种类。
此外,微生物酶在生物化学工程、食品工业、医药等领域有着广泛的应用,通过研究微生物酶的活性和性质,可以进一步开发和利用其潜在的应用价值。
五、微生物工程技术的发展趋势随着现代科学技术的不断发展,微生物工程技术也在不断更新和完善。
新兴的技术包括代谢工程、系统生物学、合成生物学等,将为微生物生物化学实验技术的发展带来新的契机和挑战。
同时,微生物生物化学实验技术在环境保护、资源利用、新药开发等方面具有广阔的应用前景,将为人类社会的可持续发展做出重要贡献。

微⽣物典型⽣长曲线知识点:微⽣物⽣长曲线情境:灭菌技术任务:微⽣物⽣长曲线课程:⾷品微⽣物技术微⽣物⽣长曲线⼤肠杆菌⼀个细胞重约10 –12克,平均20分钟繁殖⼀代。
24⼩时后:4722366500万亿个后代,重量达到:4722吨48⼩时后:2.2 ×10 43个后代,重量达到2.2 ×10 25 吨相当于4000个地球的重量!微⽣物⽣长曲线细菌接种到定量的液体培养基中,定时取样测定细胞数量,以培养时间为横座标,以菌数为纵座标作图,得到的⼀条反映细菌在整个培养期间菌数变化规律的曲线。
⼀条典型的⽣长曲线可分为:延滞期、对数期、稳定期和衰亡期。
(1)延滞期将少量菌种接⼊新鲜培养基后,在开始⼀段时间内菌数不⽴即增加,或增加很少,⽣长速度接近于零,也称迟缓期、适应期。
特点:细胞形态变⼤或增长,例如巨⼤芽孢杆菌,在迟缓期末,细胞的平均长度⽐刚接种时长6倍。
⼀般来说处于迟缓期的细菌细胞体积最⼤细胞内RNA,尤其是rRNA含量增⾼,合成代谢活跃,核糖体、酶类和ATP的合成加快,易产⽣诱导酶。
对外界不良条件反应敏感。
迟缓期出现的原因:微⽣物接种到⼀个新的环境,暂时缺乏分解和催化有关底物的酶,或是缺乏充⾜的中间代谢产物等。
为产⽣诱导酶或合成中间代谢产物,就需要⼀段适应期。
在⽣产实践中缩短迟缓期的常⽤⼿段:(1)通过遗传学⽅法改变种的遗传特性使迟缓期缩短;(2)利⽤对数⽣长期的细胞作为种⼦;(3)尽量使接种前后所使⽤的培养基组成不要相差太⼤;(4)适当扩⼤接种量(2)对数⽣长期以最⼤的速率⽣长和分裂,细菌数量呈对数增加,细菌内各成分按⽐例有规律地增加,表现为平衡⽣长。
特点:对数⽣长期的细菌个体形态、化学组成和⽣理特性等均较⼀致,代谢旺盛、⽣长迅速、代时稳定,所以是研究微⽣物基本代谢的良好材料。
它也常在⽣产上⽤作种⼦,使微⽣物发酵的迟缓期缩短,提⾼经济效益。
影响微⽣物增代时间(代时)的因素:1)菌种,不同的微⽣物或菌株的不同代时也不同2)营养成分,在营养丰富的培养基中⽣长代时短3)营养物浓度,⽣长速率与营养物浓度呈正⽐4)温度,⽣长速率与培养温度呈正相关在细菌个体⽣长⾥,每个细菌分裂繁殖⼀代所需的时间为代时,在群体⽣长⾥细菌数量增加⼀倍所需的时间称为倍增时间。

竭诚为您提供优质文档/双击可除细菌生长曲线的测定实验报告篇一:细菌生长曲线实验九测定细菌生长曲线[实验目的]1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。
3.学习液体种子和固体种子的不同接种方法和注意事项。
4.利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]1.实验材料(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml三角瓶x4瓶/大组),配方:牛肉膏5g,蛋白胨10g,nacl5g,葡萄糖10g,加水至1000ml,ph7.5。
2.实验仪器取液器(5000μl,1000μl,200tμl各一支);培养箱.摇床,722s分光光度汁;1000μl无菌吸头100个;5000μl 无菌吸头2(:细菌生长曲线的测定实验报告)个;1ml或4ml 玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图91)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测oD550或oD620或oD600或oD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。


典型的微生物生长曲线包括四个时期:调整期、对数期、稳定期、衰亡期。
1、调整期特点:生长速率常熟为零、菌体粗大、RNA含量增加、代谢活力强、对不良环境的抵抗能力下降。
成因:微生物刚刚接种到培养基之上,其代谢系统需要适应新的环境,同时要合成酶、辅酶、其他代谢中间代谢产物等,所以此时期的细胞数目没有增加。
2、对数期特点:生长速率最快、代谢旺盛、酶系活跃、活细菌数和总细菌数大致接近、细胞的化学组成形态理化性质基本一致。
成因:经过调整期的准备,为此时期的微生物生长提供了足够的物质基础,同时外界环境也是最佳状态。
3、稳定期特点:活细菌数保持相对稳定、总细菌数达到最高水平、细胞代谢产物积累达到最高峰、是生产的收获期、芽孢杆菌开始形成芽孢。
成因:营养的消耗使营养物比例失调、有害代谢产物积累、PH值EH值等理化条件不适宜。
4、衰亡期特点:细菌死亡速度大于新生成的速度、整个群体出现负增长、细胞开始畸形、细胞死亡出现自溶现象。
成因:主要是外界环境对继续生长越来越不利、细胞的分解代谢大于合成代谢、继而导致大量细菌死亡。
根据微生物的生长曲线可以明确微生物的生长规律,对生产实践具有重大的指导意义。
故根据对数期的生长规律可以得到培养菌种时缩短工期的方法:接种对数期的菌种,采用最适菌龄,加大接种量,用与培养菌种相同组成的培养基。
有如,根据稳定期的生长规律,可知稳定期是产物的最佳收获期,也是最佳测定期,通过对稳定期到来原因的研究还促进了连续培养原理的提出和工艺技术的创建。
微生物生长曲线的测定OD-Monitor振荡比浊法---一种在线实时自动非接触测定细菌生长曲线的新方法细菌生长曲线根据不同的要求有多种测定方法,测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
比浊法测定原理由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。



引言:微生物培养是微生物学研究中的基础实验技术,通过培养和繁殖微生物可以方便地获取大量的微生物细胞,为微生物学研究、工业生产以及医学诊断提供了重要的手段和依据。
本文将介绍微生物培养的操作步骤和注意事项,帮助读者掌握正确的培养技巧并避免常见的操作错误。
概述:微生物培养操作的目的是为了利用适当的营养条件提供给微生物生长所需的营养物质、温度和pH条件,并且维持适当的氧含量和无菌状态。
在进行微生物培养实验前,需要准备培养基、无菌工具和培养设备,并熟悉培养操作的基本原理和注意事项。
正文:一、选择合适的培养基1.了解微生物的营养需求:不同的微生物对营养物质的需求不同,如碳源、氮源、微量元素等。
了解微生物的营养需求是选择合适的培养基的前提。
2.选择适当的培养基类型:常见的培养基类型包括富养基、平衡盐基和选择性培养基等。
根据实验目的和微生物特性选择合适的培养基类型。
3.调整培养基的pH值:对于不同的微生物,其最适生长的pH 值有所差异。
在制备培养基时,需调整pH值到适宜范围。
4.添加适量的固化剂:常用的固化剂有琼脂、洋菜粉等,添加适量的固化剂有助于培养基的凝胶化。
5.培养基的无菌处理:制备好的培养基需要高温高压灭菌,以确保培养基的无菌状态。
二、准备培养设备和无菌工具1.烧杀法灭菌无菌器具:包括试管、烧杀针、培养皿等容器,在进行培养前,需要将这些容器进行高温高压灭菌处理,以确保其无菌。
2.使用无菌技术:在进行微生物培养操作时,需要掌握无菌技术,如洗手消毒、穿戴无菌手套、操作台面无菌处理等,以避免污染。
三、培养操作步骤1.取出无菌培养基:在无菌条件下,将培养基倒入无菌容器中,如试管、培养皿等。
2.加入适量的微生物菌液:从已经纯化和鉴定的微生物菌液中取出适量的菌液,通过吸管、针头等无菌工具加入到培养基中。
3.均匀混合微生物菌液和培养基:使用无菌技术将微生物菌液和培养基充分均匀混合,以保证微生物的均匀分布。
4.完成培养器具的封闭:将加入微生物菌液的培养器具盖好,并用无菌膜或橡皮塞封口,防止外界细菌的侵入。
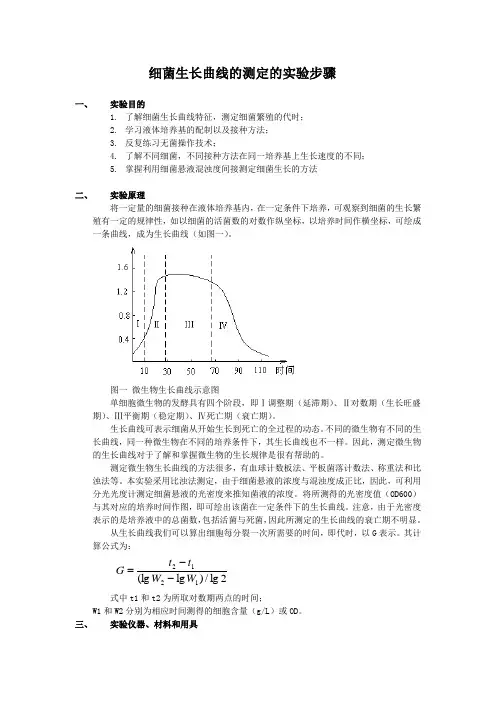
细菌生长曲线的测定的实验步骤一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1.实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。

实验日期:2017.11.1 实验班级:生物技术指导教师:张建丽姓名:高熹学号:1120152430测定细菌生长曲线一.实验目的1.通过对大肠杆菌生长曲线的测定,了解细菌生长的特点,综合训练微生物实验的基本实验技能。
2.巩固培养基的配制、灭菌、仪器的包扎、倒平板。
3.掌握用比浊法测定细菌的生长曲线。
二.实验原理将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,一定时间测定培养液中的菌量,以菌量的数量作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、生长期、稳定期和衰亡期。
将每一种一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期、对数生长期、稳定期和衰亡期四个阶段。
延迟期:又叫调整期。
细菌接种至培养基后,对新环境有一个短暂适应过程(不适应者可因转种而死亡)。
此期曲线平坦稳定,因为细菌繁殖极少延迟期长短因素种、接种菌量、菌龄以及营养物质等不同而异,一般为1~4小时。
此期中细菌体积增大,代谢活跃,为细菌的分裂增殖合成、储备充足的酶、能量及中间代谢产物。
对数生长期:又称指数期。
此期生长曲线上活菌数直线上升。
细菌以稳定的几何级数极快增长,可持续几小时至几天不等(视培养条件及细菌代时而异)。
此期细菌形态、染色、生物活性都很典型,对外界环境因素的作用敏感,因此研究细菌性状以此期细菌最好。
抗生素作用,对该时期的细菌效果最佳。
稳定期:该期的生长菌群总数处于平坦阶段,但细菌群体活力变化较大细菌浓度达到最大即环境最大容纳量。
由于培养基中营养物质消耗、毒性产物(有机酸、过氧化物等)积累PH下降等不利因素的影响,细菌繁殖速度渐趋下降,相对细菌死亡数开始逐渐增加,此期细菌增殖数与死亡数渐趋平衡。
细菌形态、染色、生物活性可出现改变,并产生相应的代谢产物如外毒素、内毒素、抗生素、以及芽孢等。
知识点:微生物生长曲线情境:灭菌技术任务:微生物生长曲线课程:食品微生物技术微生物生长曲线大肠杆菌一个细胞重约10 –12克,平均20分钟繁殖一代。
24小时后:4722366500万亿个后代,重量达到:4722吨48小时后:2.2 ×10 43个后代,重量达到2.2 ×10 25 吨相当于4000个地球的重量!微生物生长曲线细菌接种到定量的液体培养基中,定时取样测定细胞数量,以培养时间为横座标,以菌数为纵座标作图,得到的一条反映细菌在整个培养期间菌数变化规律的曲线。
一条典型的生长曲线可分为:延滞期、对数期、稳定期和衰亡期。
(1)延滞期将少量菌种接入新鲜培养基后,在开始一段时间内菌数不立即增加,或增加很少,生长速度接近于零,也称迟缓期、适应期。
特点: 细胞形态变大或增长,例如巨大芽孢杆菌,在迟缓期末,细胞的平均长度比刚接种时长6倍。
一般来说处于迟缓期的细菌细胞体积最大细胞内RNA,尤其是rRNA含量增高,合成代谢活跃,核糖体、酶类和ATP的合成加快,易产生诱导酶。
对外界不良条件反应敏感。
迟缓期出现的原因:•微生物接种到一个新的环境,暂时缺乏分解和催化有关底物的酶,或是缺乏充足的中间代谢产物等。
为产生诱导酶或合成中间代谢产物,就需要一段适应期。
在生产实践中缩短迟缓期的常用手段:(1)通过遗传学方法改变种的遗传特性使迟缓期缩短;(2)利用对数生长期的细胞作为种子;(3)尽量使接种前后所使用的培养基组成不要相差太大;(4)适当扩大接种量(2)对数生长期•以最大的速率生长和分裂,细菌数量呈对数增加,细菌内各成分按比例有规律地增加,表现为平衡生长。
•特点:对数生长期的细菌个体形态、化学组成和生理特性等均较一致,代谢旺盛、生长迅速、代时稳定,所以是研究微生物基本代谢的良好材料。
它也常在生产上用作种子,使微生物发酵的迟缓期缩短,提高经济效益。
影响微生物增代时间(代时)的因素:1)菌种,不同的微生物或菌株的不同代时也不同2)营养成分,在营养丰富的培养基中生长代时短3)营养物浓度,生长速率与营养物浓度呈正比4)温度,生长速率与培养温度呈正相关在细菌个体生长里,每个细菌分裂繁殖一代所需的时间为代时,在群体生长里细菌数量增加一倍所需的时间称为倍增时间。
微生物生长曲线生长量测定法体积测量法:又称测菌丝浓度法。
通过测定一定体积培养液中所含菌丝的量来反映微生物的生长状况。
方法是,取一定量的待测培养液(如10毫升)放在有刻度的离心管中,设定一定的离心时间(如5分钟)和转速(如5000 rpm),离心后,倒出上清夜,测出上清夜体积为v,则菌丝浓度为(10-v)/10。
菌丝浓度测定法是大规模工业发酵生产上微生物生长的一个重要监测指标。
这种方法比较粗放,简便,快速,但需要设定一致的处理条件,否则偏差很大,由于离心沉淀物中夹杂有一些固体营养物,结果会有一定偏差。
称干重法:可用离心或过滤法测定。
一般干重为湿重的10-20%。
在离心法中,将一定体积待测培养液倒入离心管中,设定一定的离心时间和转速,进行离心,并用清水离心洗涤1-5次,进行干燥。
干燥可用烘箱在105 ℃或100℃下烘干,或采用红外线烘干,也可在80℃或40℃下真空干燥,干燥后称重。
如用过滤法,丝状真菌可用滤纸过滤,细菌可用醋酸纤维膜等滤膜过滤,过滤后用少量水洗涤,在40C下进行真空干燥。
称干重发法较为烦琐,通常获取的微生物产品为菌体时,常采用这种方法,如活性干酵母(activity dry yeast, ADY),一些以微生物菌体为活性物质的饲料和肥料。
比浊法:微生物的生长引起培养物混浊度的增高。
通过紫外分光光度计测定一定波长下的吸光值,判断微生物的生长状况。
对某一培养物内的菌体生长作定时跟踪时,可采用一种特制的有侧臂的三角烧瓶。
将侧臂插入光电比色计的比色座孔中,即可随时测定其生长情况,而不必取菌液。
该法主要用于发酵工业菌体生长监测。
如我所使用UNICO公司的紫外-可见分光光度计,在波长600nm 处用比色管定时测定发酵液的吸光光度值OD600,以此监控的生长及诱导时间。
菌丝长度测量法:对于丝状真菌和一些放线菌,可以在培养基上测定一定时间内菌丝生长的长度,或是利用一只一端开口并带有刻度的细玻璃管,到入合适的培养基,卧放,在开口的一端接种微生物,一段时间后记录其菌丝生长长度,借此衡量丝状微生物的生长。
请教霉菌生长曲线测定方法我要测定霉菌的生长曲线,但是细菌那种测定方法好象不行,请高人指点,用称量细胞干重的方法试试:)1.抽虑取菌丝体,105度干燥5小时测干重。
2.实验下比浊法测定看看能行的不?3.抽虑取菌丝体,105度干燥5小时测干重。
不止五小时,是直道恒重!:)4.用OD值法!分时间段取样,测OD值。
5.测OD值法,分时间段取样,测OD值,XY坐标轴做点划线。
理论上应该是抛物线。
6.用称量细胞干重的方法试试:)7.干重法用过,误差好大8.楼上的各位,一看就是没有做过霉菌的,呵呵。
霉菌一般长到十几小时后就结球或者结团了,OD600几乎就跟水一样的,主要的细胞都在球或团里面。
然后这个球和团的分布也很不均匀,除非把整个摇瓶都称了。
上罐的时候,不说取的不均匀,你根本就没有办法把那些东西从罐里面取出来。
我也头疼这个事情,一般都没法测。
如果有高手,帮忙想想办法。
9.菌丝体称重法,比较合适。
测OD值法,分时间段取样,测OD值,XY坐标轴做点划线。
理论上应该是抛物线。
10.黄曲霉是丝壮真菌啊,用OD值法可行吗,用什么波长呢,黄曲霉是丝壮真菌啊,用OD值法可行吗,用什么波长呢,11.用重量法测定菌丝生物量,如果开始误差很大,建议1多做平行,2加大接种量。
尤其是刚开始的几个小时生物量比较小,测定相对误差很大,实验要更细心一些,菌丝离心或过滤之后要将上面附着的培养基冲洗干净,另外在烘干时也要注意,烘箱顶容易生锈,有时一些小渣滓很容易掉下来如果掉进样品中会引起很大误差,最好用带盒子的容器承载12.首先讨论测定吸光度的问题。
我培养过曲霉属(包括黑曲霉、黄曲霉、米曲霉、塔宾曲霉、棘孢曲霉、黄柄曲霉、亮白曲霉等)、青霉属(包括草酸青霉、嗜松青霉等),枝状枝孢霉种,根霉属,木霉属,还有很多没有鉴定过的真菌,超过一千株,发现除非是污染了细菌,不然真菌在液体培养(180rpm)时菌丝长了之后都会相互纠结成球或块状,所以测定OD值不能反映真菌的生长时期。
细菌生长曲线的测定1 目的1.1 了解细菌生长曲线特点及测定原理1.2 学习用比浊法测定细菌的生长曲线2 原理将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。
这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。
因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。
3 材料3.1菌种大肠杆菌3.2培养基肉膏蛋白胨培养基3.3 仪器和器具721分光光度计,比色杯,恒温摇床,无菌吸管,试管,三角瓶。
4 流程种子液→标记→接种→培养→测定5 方法5.1种子液制备取大肠杆菌斜面菌种1支,以无菌操作挑取1环菌苔,接入肉膏蛋白胨培养液中,静止培养18h作种子培养液。
5.2标记编号取盛有50mL无菌肉膏蛋白胨培养液的250mL三角瓶11个,分别编号为0、1.5、3、4、6、8、10、12、14、16、20h。
5.3接种培养用2mL无菌吸管分别准确吸取2mL种子液加入已编号的11个三角瓶中,于37℃下振荡培养。
然后分别按对应时间将三角瓶取出,立即放冰箱中贮存,待培养结束时一同测定OD 值。
5.4生长量测定将未接种的肉膏蛋白胨培养基倾倒入比色杯中,选用600nm波长分光光度计上调节零点,作为空白对照,并对不同时间培养液从0h起依次进行测定,对浓度大的菌悬液用未接种的牛肉膏蛋白胨液体培养基适当稀释后测定,使其OD值在0.10.~0.65以内,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。
实验三微生物生长曲线
的测定
Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】
实验三微生物生长曲线的测定
一、实验目的目的
1、了解细菌生长曲线特点及测定原理
2、学习用比浊法测定细菌的生长曲线?
二、实验原理
将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。
这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。
因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。
三、实验材料
1、菌种
2、培养基:肉膏蛋白胨培养基
3、仪器和器具
721分光光度计,比色杯,恒温摇床,无菌吸管,试管,三角瓶。
4、流程
种子液→标记→接种→培养→测定
四、实验步骤
1、种子液制备
取细菌菌种1支,以无菌操作挑取1环菌液,接入肉膏蛋白胨培养液中,培养18h作种子培养液。
2、标记编号
取盛有30mL无菌肉膏蛋白胨培养液的三角瓶6个,分别编号为0、4、8、12、16、20。
3、接种培养
用2mL无菌吸管分别准确吸取1mL种子液加入已编号的6个三角瓶中,于37℃下振荡培养。
然后分别按对应时间将三角瓶取出测定OD 值。
4、生长量测定
将未接种的肉膏蛋白胨培养基倾倒入比色杯中,选用600nm波长分光光度计上调节零点,作为空白对照,并对不同时间培养液从0h起依次进行测定,对浓度大的菌悬液用未接种的牛肉膏蛋白胨液体培养基适当稀释后测定,使其OD值在.~以内,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。
五、实验结果与分析
以上述表格中的时间为横坐标,OD600?值为纵坐标,绘制细菌的生长曲线。