4.3.1 二氧化硫和三氧化硫
- 格式:pptx
- 大小:1.27 MB
- 文档页数:30


高一化学必修1第四章第三节硫和氮的氧化物〔第1课时 二氧化硫和三氧化硫〕编写人: 谢肇明审核人:许丰娟高一_____班第____组编号_____姓名_________小组评价______教师评价_______ 【学习目标】1、了解单质硫和二氧化硫的物理性质;了解可逆反响的概念。
2、掌握二氧化硫的主要化学性质;了解三氧化硫的化学性质。
【学习重点】二氧化硫的主要化学性质。
【使用说明】本学案需1课时完成。
课前请阅读教材89-91页并完成【预习自学】一、单质硫: 1、硫〔俗称〕:色固体〔晶体〕, 溶于水, 溶于酒精,溶于二硫化碳〔CS 2〕。
硫在自然界以态和态存在。
2、硫的原子构造,硫是比拟活泼的非金属单质,常见化合价为,你能说出其代表物吗?。
硫在反响中即表现氧化性又表现复原性。
3、硫的化学性质:〔1〕氧化性 S+Fe =FeS 2Cu+S =Cu 2S 结合氯气与铁、铜的反响比拟氯和硫的氧化性〔2〕复原性;S+O 2====二、二氧化硫和三氧化硫 1、二氧化硫 〔1〕物理性质SO 2是色、有的有气体,容易,易于水〔1体积水可溶解40体积〕。
密度比空气,收集SO 2用方法。
〔2〕二氧化硫的化学性质:写出以下反响的化学方程式。
SO 2 与 H 2O 的反响 (酸性氧化物)SO 2 与 O 2 的反响SO 2 与 NaOH 的反响(酸性氧化物) 2、三氧化硫〔1〕物理性质:标准状况下.....为无色、易挥发的晶体..℃℃。
〔2〕化学性质:属于酸性氧化物 SO 3 + H 2O ——SO 3 + CaO ——SO 3 + C a (O H )2 ——3、二氧化硫的主要来源; 含还硫物质的燃烧在煤、石油和某些金属矿物中含硫或硫的化合物在燃烧或冶炼时,会生成SO 2,这是大气中SO 2的主要来源[思考]怎样闻SO 2气体?[合作探究]〖实验探究1〗完成课本P90“实验4-7〞,思考交流课本P91“学与问〞。

第二章非金属及其化合物第三节硫和氮的氧化物(第一课时硫和硫的氧化物)【学习目标】1.通过思考交流、阅读讨论、问题探究,进一步熟悉硫单质在自然界的存在及重要的物理和化学性质。
2.通过演示实验、思考交流、分析探究,从硫、二氧化硫的属类及硫元素化合价角度认识硫及二氧化硫的性质、用途,体会性质决定用途的核心理念。
3.通过对比分析,结合真实情境中的应用实例或通过实验探究,理解SO2的酸性、漂白性及强还原性。
知道三氧化硫的物理性质及化学性质,并能正确书写相关化学方程式。
【学习重点】二氧化硫的化学性质【学习难点】二氧化硫性质的实验设计及原理探究【自主学习】旧知回顾:1.同种元素不同价态的物质,处于最高价态时只具有_氧化性;处于最低价态时只具有_还原性;处于中间价态时既有氧化性又有还原性。
如:S2-具有还原性,S具有既有氧化性又有还原性_,SO2具有既有氧化性又有还原性,Na2SO3具有既有氧化性又有还原性,SO3具有氧化性(填〝氧化性〞、〝还原性〞)。
2.酸性氧化物是指能与碱反应,并且只生成盐和水的氧化物。
酸性氧化物具有一些的通性,如:CO2+2NaOH+=_H2O+Na2CO3_;CO2+Ca(ClO)2 +H2O= CaCO3↓+2HClO等。
新知预习:1.自然界中游离态的硫存在于火山喷口附近或地壳的岩层里,化合态的硫主要以硫化物和_硫酸盐形式存在。
2.硫的氧化物有二氧化硫和三氧化硫两种,均为酸性氧化物。
二氧化硫中硫元素为 +4价,因此二氧化硫既具有氧化性,又具有还原性。
【同步学习】情景导入:阅读教材P89的图4-19,观看视频—硫及二氧化硫。
思考空气质量报告指标有哪些?为什么要把这两种物质作为空气质量报告的内容,这就是本节课要探讨的问题。
活动一、硫的存在和性质1.阅读思考:阅读教材P89页—90页内容,思考硫元素在自然界的存在形态是什么?【温馨提示】(1)游离态:存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
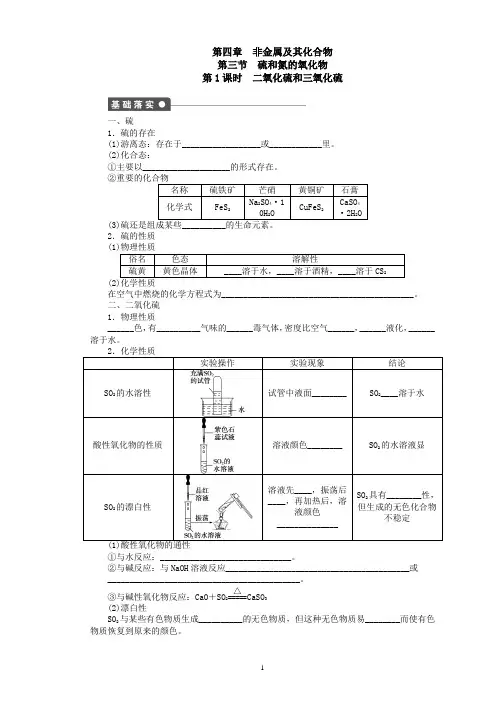
第四章 非金属及其化合物 第三节 硫和氮的氧化物 第1课时 二氧化硫和三氧化硫一、硫1.硫的存在(1)游离态:存在于__________________或____________里。
(2)化合态:①主要以____________________的形式存在。
(3)2.硫的性质 在空气中燃烧的化学方程式为____________________________________________。
二、二氧化硫 1.物理性质 ______色,有__________气味的______毒气体,密度比空气______,______液化,______溶于水。
①与水反应:______________________________。
②与碱反应:与NaOH 溶液反应__________________________________________或 ____________________________________________。
③与碱性氧化物反应:CaO +SO 2=====△CaSO 3 (2)漂白性SO 2与某些有色物质生成__________的无色物质,但这种无色物质易________而使有色物质恢复到原来的颜色。
(3)还原性SO2中的硫元素为______价,处于硫元素的中间价态,既有________性又有________,一般表现为________性。
3.用途(1)用于________纸浆、毛、丝、草帽辫等。
(2)用于____________。
三、三氧化硫SO3是一种酸性氧化物,具有酸性氧化物的通性。
1.与水反应生成硫酸________________________________________________________________________ 2.与碱性氧化物反应生成盐SO3+CaO===___________________3.与碱反应生成盐和水SO3+Ba(OH)2===______________________________知识点1 硫的存在与性质1.关于硫的叙述正确的是( )A.硫的非金属性较强,所以只以化合态存在于自然界中B.分离黑火药中的硝酸钾、木炭和硫黄要用到二硫化碳、水及过滤操作C.硫与金属或非金属反应时均作氧化剂D.硫的两种单质之间的转化属于物理变化2.下列说法,不正确的是( )A.硫是一种淡黄色的能溶于水的固体B.硫在自然界中既有化合态又有游离态C.硫与铁反应生成硫化亚铁D.硫在空气中燃烧产物是二氧化硫知识点2 二氧化硫的氧化性与还原性3.下列反应中,SO2表现氧化性的是( )A.2SO2+O22SO3B.SO2+H2O===H2SO3C.2H2S+SO2===3S↓+2H2OD.SO2+2H2O+Cl2===H2SO4+2HCl4.SO2溶于水后,所得溶液的性质是( )A.有氧化性,无还原性,无酸性B.有氧化性,有还原性,有酸性C.有还原性,无氧化性,无酸性D.有还原性,无氧化性,有酸性知识点3 二氧化硫的漂白性5.二氧化硫能使下列溶液褪色,是利用二氧化硫漂白性的是( )A.氯水 B.溴水C.品红溶液 D.酸性KMnO4溶液6.下列说法,正确的是( )A.SO2能使品红溶液、溴水和酸性KMnO4溶液褪色均是因为SO2具有漂白性B.SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质,可增强漂白效果C.活性炭也能使有色物质褪色,是利用了碳单质具有还原性,使有色物质发生了还原反应D.SO2使品红溶液褪色,将褪色后的溶液加热,溶液又重新变为红色知识点4 二氧化硫的酸性氧化物的性质7.能够用于鉴别SO 2和CO 2的溶液是( ) A .澄清的石灰水 B .品红溶液 C .紫色石蕊试液 D .氯化钡溶液 知识点5 三氧化硫的性质8.下列对于SO 2和SO 3的叙述,正确的是( ) A .都是既有氧化性,又有还原性B .都是酸性氧化物,其水溶液都是强酸C .都可使品红溶液褪色,加热时红色又能再现D .都能与碱溶液反应【答案】基础落实一、1.(1)火山喷口附近 地壳的岩层 (2)①硫化物和硫酸盐 (3)蛋白质 2.(1)不微 易 (2)S +O 2=====点燃SO 2二、1.无 刺激性 有 大 易 易 2.从左至右,从上至下:上升 易 变红色 酸性 变红 褪色 恢复红色 漂白 (1)①H 2O +SO 2 H 2SO 3 ②2NaOH+SO 2===Na 2SO 3+H 2O NaOH +SO 2===NaHSO 3 (2)不稳定 分解 (3)+4 氧化 还原性 还原 3.(1)漂白 (2)杀菌消毒三、1.SO 3+H 2O===H 2SO 4 2.CaSO 4 3.BaSO 4↓+H 2O 对点训练1.B [元素在自然界中的存在形式虽然与化学活泼性有关,但不能把非金属性强弱作为判断依据。




第三节 硫和氮的氧化物 第1课时 二氧化硫和三氧化硫[知 识 梳 理]一、硫(S)【自主思考】1.试管壁上有硫附着时应如何洗涤?提示 硫易溶于二硫化碳而难溶于水,故可用CS 2洗涤。
2.已知反应:Fe +S=====△FeS ,结合Fe 与Cl 2的反应思考S 和Cl 2的氧化性有何差异? 提示 Fe 与Cl 2的反应生成高价态化合物FeCl 3,Fe 与S 的反应生成低价态化合物FeS ,说明氯气的氧化性强于硫。
二、二氧化硫和三氧化硫 1.二氧化硫(SO 2)(1)物理性质(2)化学性质SO 2⎩⎨⎧与H 2O 反应:SO 2+H 2O H 2SO3漂白性:SO 2能与某些有色物质生成不稳定的无色物质与O 2反应:2SO 2+O 2催化剂△2SO 3(3)SO 2的用途①漂白纸浆、毛、丝、草帽辫等; ②用于杀菌消毒。
2.三氧化硫三氧化硫具有酸性氧化物的通性,主要反应如下: SO 2⎩⎪⎨⎪⎧与H 2O :SO 3+H 2O===H 2SO 4与碱性氧化物(CaO ):SO 3+CaO===CaSO 4与碱[Ca (OH )2]:SO 3+Ca (OH )2===CaSO 4+H 2O【自主思考】3.书写SO 2与H 2O ,SO 2与O 2反应的化学方程式时需要注意什么问题? 提示 上述两反应都是可逆反应,在书写化学方程式时必须注意用“”表示。
4.将SO 2通入BaCl 2溶液中,会有沉淀生成吗?若是Ba(OH)2溶液有没有沉淀呢? 提示 没有;有。
[效 果 自 测]1.判断正误,正确的打“√”,错误的打“×”。
(1)自然界中不存在游离态的硫单质。
( )(2)S 能氧化Fe ,使Fe 生成+3价铁的化合物。
( )(3)S 在空气中燃烧生成SO 2,在过量的纯O 2中燃烧生成SO 3。
( ) (4)SO 2和CO 2可用澄清石灰水鉴别。
( )(5)SO 2使品红溶液褪色是因为SO 2具有强氧化性。

