碘
- 格式:doc
- 大小:102.00 KB
- 文档页数:7

碘参与构成的物质或结构碘是元素周期表中的一种化学元素,原子序数为53,原子量为126.9、它是一种非金属元素,常见的同位素有127和129、碘在常温常压下为深紫色的固体,具有金属光泽。
下面将介绍碘参与构成的一些物质和结构。
1.碘分子(I2):最简单的碘化合物就是由两个碘原子构成的碘分子。
在常温下,碘分子是深紫色固体,蒸发时形成具有强烈橙色蒸气的升华物。
2.硃状碘(I4):由四个碘原子形成的分子,呈深红色晶体。
硃状碘作为一种有机化学试剂,常用于氧化反应和催化剂合成中。
3.碘酸(HIO3):碘参与构成的一种无机化合物,其结构中含有一个碘原子和三个氧原子。
碘酸是一种强氧化剂,并具有广泛的应用,如药物和染料的合成等。
4.碘化钾(KI):由一个碘原子和一个钾原子组成。
碘化钾常用于诊断甲状腺功能异常以及制备碘溶液。
5.碘化银(AgI):由一个碘原子和一个银原子组成。
碘化银是一种光敏化合物,常用于摄影中作为胶片的感光层。
6.碘化铅(PbI2):由一个碘原子和两个铅原子组成。
碘化铅是一种重要的钙钛矿太阳能电池材料,具有良好的光电转化效率。
7.碘代苯(C6H5I):由一个碘原子和一个苯环组成。
碘代苯是一种有机化合物,在有机合成中广泛用作芳香化合物的保护基和反应试剂。
8.碘代苯甲酸(C6H5COOH):在苯环上添加碘原子的有机化合物。
碘代苯甲酸是一种有机酸,常用于催化酯酸的羟化反应。
9.碘代丙酮(CH3COCH2I):由碘代丙酮酸的一个碘原子和一个丙酮酸的酮基团组成。
碘代丙酮是一种有机化合物,可以用作酮和羧酸的防护基和反应试剂。
10.聚碘化物(I2n):由多个碘原子形成的链状结构。
聚碘化物是有机化合物中的一种重要催化剂,常用于催化反应中的烯烃异构化和加氢反应等。
除了以上提到的物质和结构,碘还可以与其他元素和化合物形成更多的化合物和结构。
这些物质和结构在化学合成、医药、摄影等领域发挥着重要作用。
碘的化学性质和反应机制使得它在有机和无机化学中具有广泛的应用和研究价值。

碘元素简介:物质类别:无机物-单质-非金属,化学式:I2,常温下状态:固体单质碘呈紫黑色晶体,密度4.93 克/厘米3。
相对原子质量126.9。
熔点113.5℃,沸点184.35℃。
化合价-1、+1、+3、+5和+7。
电离能10.451电子伏特。
具有金属光泽,性脆,易升华。
有毒性和腐蚀性。
易溶于乙醚、乙醇、氯仿和其他有机溶剂,也溶于氢碘酸和碘化钾溶液而呈深褐色。
可与大部分元素直接化合,但不象其他卤素反应那样剧烈,碘的典型有机反应有:芳香族化合物的亲电子置换,形成芳基碘化物;邻近羰基官能团的碳原子的碘化作用;碘(I)在跨越不饱和烃的多重键上的加成反应。
但难溶于水,由于歧化反应的结果,所得棕黄色得溶液显酸性。
在水溶液中,需要强的还原剂才能使碘还原(成I-)。
碘单质遇淀粉会变蓝色。
碘单质是紫黑色,有光泽的固体。
加热时,碘升华为漂亮的紫色蒸气,这种蒸气有刺激性气味。
碘可以和大多数元素形成化合物,但是它不如其它卤素(F,Cl,Br)活泼,位于碘之前的卤素可以从碘化物中将碘置换出来。
碘具有类似金属的特性。
碘易溶解在氯仿、四氯化碳、二硫化碳等有机溶剂,并形成美丽的紫色溶液,但微溶于水(但如果水中含碘离子会使其溶解度增大:(I-)+(I2)==(I3-))。
碘的化合物在有机化学中十分重要,另外在医药和照相方面的用途也很广泛。
缺乏碘会导致甲状腺肿大。
碘单质遇到淀粉会显深蓝色,这是碘的特征之一。
和同族卤素气体一样,碘蒸汽有毒,所以取用碘的时候,应尽量在通风橱中操作。
碘主要用于制药物、染料、碘酒、试纸和碘化合物等。
碘酒就是用碘、碘化钾和乙醇制成的一种药物,棕红色的透明液体,有碘和乙醇的特殊气味原子体积:25.74(立方厘米/摩尔)碘在自然界中的丰度是不大的,但是一切东西都含有碘,不论坚硬的土块还是岩石,甚至最纯净的透明的水晶,都含有相当多的碘原子。
海水里含大量的碘,土壤和流水里含的也不少,动植物和人体里含的更多。
自然界中的海藻含、智利硝石和石油产区的矿井水中也含碘都较高。

碘消毒的原理
碘是一种元素,化学符号为I。
碘在水中溶解度很大,而在空气中极不稳定,容易被氧化。
空气中的氧气可以与碘反应生成碘化氢。
碘化氢是无色气体,有刺激性气味,有强氧化性,有剧毒。
碘是一种强氧化剂,具有极强的漂白能力,可以氧化水中的色素、有机物和胶体等物质。
通常情况下,碘可以用于水、海水、河水等的消毒;也可用于土壤消毒;还可用于动植物体表及体表分泌物的消毒。
碘伏是一种新型的含碘消毒剂,对细菌、病毒有较强的杀灭作用。
其作用机理是:它能与细菌、病毒等微生物表面的蛋白质和核酸中的糖基结合成新的物质,使之变性凝固而被杀死。
碘是一种无色透明液体,在水中溶解度很大,稳定性很好。
在空气中容易被氧化成碘化氢和碘单质。
碘化氢具有强氧化性,能将细菌、病毒等微生物表面上的蛋白质和核酸氧化成双缩脲结构而凝固。
—— 1 —1 —。

碘的三种性质及用途碘是一种重要的化学元素,具有多种性质和广泛的用途。
下面将详细介绍碘的三种性质及其在不同领域的应用。
首先,碘是一种化学元素,具有物理性质和化学性质。
物理性质方面,碘是一种深紫黑色晶体,具有金属光泽。
在常温下,碘为固态,熔点为113.5摄氏度,沸点为184.35摄氏度。
化学性质方面,碘具有良好的化学活性,属于卤素元素家族。
它与氧、氢、卤素等元素能发生反应,生成各种化合物,并且容易与其他物质形成络合物。
这些性质使得碘在许多领域有着广泛的应用。
其次,碘的一种重要性质是其具有良好的消毒能力。
碘具有很强的杀菌作用,能够有效地杀灭各种细菌、病毒和寄生虫。
由于这种性质,碘广泛应用于医药领域和卫生领域。
碘可以用于制备消毒液、抗菌剂、创伤护理用品等,用于消毒手术器械、表面、伤口等。
此外,碘也被用于净化水源,能够有效去除水中的细菌和病毒,保证饮用水的安全性。
另外,碘还具有重要的应用价值。
碘可用于制造光敏材料,光敏材料是一种利用光的作用而发生化学变化的物质。
碘的化学性质使其适合用于制备这类材料。
例如,碘和银的反应可以生成碘化银,碘化银是一种常用的光敏材料,广泛应用于摄影、打印等领域。
此外,碘还可以作为染料和指示剂来使用。
碘具有良好的溶解性,可以溶解在许多溶剂中,溶解后的碘呈现出紫色,这种性质使得碘广泛应用于染料和指示剂的制备。
除了以上两种性质和应用,碘还具有一种重要的特性是其在人体中起着重要的作用。
碘是合成甲状腺激素的重要元素。
甲状腺激素是人体内一种关键的代谢物质,它对人体的生长发育和代谢调节起着重要作用。
如果机体缺乏碘,会导致甲状腺功能减退,引发甲状腺肿大和甲亢等疾病。
为了预防碘缺乏病,碘在食盐中普遍添加作为碘化钾或碘化钠的形式。
这样可以使得人体摄取足够的碘,维持甲状腺的正常功能。
此外,碘还有一些其他的应用,如在化学工业中可用于制备有机碘化合物,用于有机合成反应;在冶金工业中可用于提取金属铅、锡、银等;在电子工业中可用于制备碘化铜等电子材料。

关于碘的小知识碘是一种化学元素,化学符号为I,原子序数为53。
它是一种非金属元素,在自然界中以无机盐的形式存在。
碘具有一些特殊的性质和重要的生物学功能,因此对于人类和动物的健康至关重要。
以下是关于碘的一些小知识。
1. 碘的发现和历史碘最早是由法国化学家贝尔纳·库尔图瓦(Bernard Courtois)在1811年发现的。
他在从海藻中提取盐的过程中,偶然发现了一种紫色气体,这就是碘。
碘的名称来自于希腊语的“iodes”,意为紫色。
2. 碘的性质碘是一种深紫色晶体,具有金属光泽。
在常温下,碘是固体,但当加热时可以蒸发成紫色气体。
碘在水中不溶,但可以溶解在一些有机溶剂中,如醚和酒精。
碘具有强烈的刺激性气味,可以刺激眼睛和呼吸道。
3. 碘的生物学功能碘在人体和动物体内起着重要的生物学功能。
碘是甲状腺激素的重要组成部分,包括甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine)。
这些激素对于人体的生长发育、代谢调节和神经系统功能具有重要影响。
4. 碘的缺乏症碘缺乏症是全球最常见的营养缺乏症之一。
缺乏碘会导致甲状腺功能减退,进而引起甲状腺肿大(俗称为“瘰疬”或“大脖子病”)。
甲状腺肿大是由于甲状腺增生来补偿甲状腺激素合成所需的碘不足。
碘缺乏症还会影响儿童的智力发育,严重时可能导致智力低下和神经系统损害。
5. 碘的摄入途径人体无法自行合成碘,需要通过食物摄入。
海产品(如海鱼、海带、海藻等)是碘的主要来源,因为海洋中含有丰富的碘。
此外,一些土壤和水源中也含有一定量的碘。
为了预防碘缺乏症,许多国家会在食盐中添加碘化钠,以增加人体对碘的摄入。
6. 碘的推荐摄入量根据世界卫生组织(WHO)的建议,成年人每天的碘摄入量应为150微克。
孕妇和哺乳期妇女的碘需求量略高一些。
儿童的碘需求量随年龄增加而增加。
7. 碘的过量摄入虽然碘对人体健康非常重要,但过量摄入碘也会有副作用。
长期过量摄入碘可能导致甲状腺功能亢进,引起心悸、体重减轻、焦虑等症状。
碘 - 理化性质物理性质碘是一种紫黑色有光泽的片状晶体,原子序数53,自然界存在的同位素是74个中子的碘127。
碘具有较高的蒸气压,在微热下即升华,纯碘蒸气呈深蓝色,若含有空气则呈紫红色,并有刺激性气味。
碘易溶于许多有机溶剂中,例如氯仿(CHCl3)、四氯化碳(CCl4)。
碘在乙醇和乙醚中生成的溶液显棕色。
碘在介电常数较小的溶剂(如二硫化碳、四氯化碳)中生成紫色溶液,在这些溶液中碘以分子状态存在。
碘在水中的溶解度虽然很小,但在碘化钾KI或其他碘化物溶液中溶解度却明显增大。
物理属性物质状态固态密度 4.933×103kg/m³熔点386.85 K (113.7 °C, 236.66 °F)沸点457.4 K (184.3 °C, 363.7 °F)临界点819 K, 11.7 MPa原子属性原子量126.90447 g/mol晶体结构orthorhombic电负性 2.66原子半径140 pm计算值115 pm价电子排布[Kr] 4d 5s 5p电子在每能级的排布2, 8, 18, 18, 7质子53中子76化学性质碘的化学性质不如同族元素F2、Cl2、Br2活泼,但在化学反应中它也可以表现出由-1到+7的多种氧化态,它的化学性质可以概括为以下几个方面。
碘能溶于碘化物中是因为I2与碘离子生成了错离子(I3 )。
I2 + I → I3 在这个平衡中,溶液里总有单质碘的存在,因此许多碘化钾溶液的性质与碘溶液相同。
碘分子会与淀粉生成蓝黑色错合物,但碘离子(I )则否。
碘与金属的反应:一般能与氯单质反应的金属(除了贵金属)同样也能与碘反应,只是反应活性不如氯单质。
例如碘单质常温下可以和活泼的金属直接作用,与其他金属的反应需要在较高的温度下才能发生。
I2 + 2Na → 2NaI。
碘与非金属的反应:一般能与氯单质反应的非金属同样也能与碘的单质反应,由于碘单质的氧化能力较弱,反应活性不如氯,所以需要在较高的温度下才能发生反应。
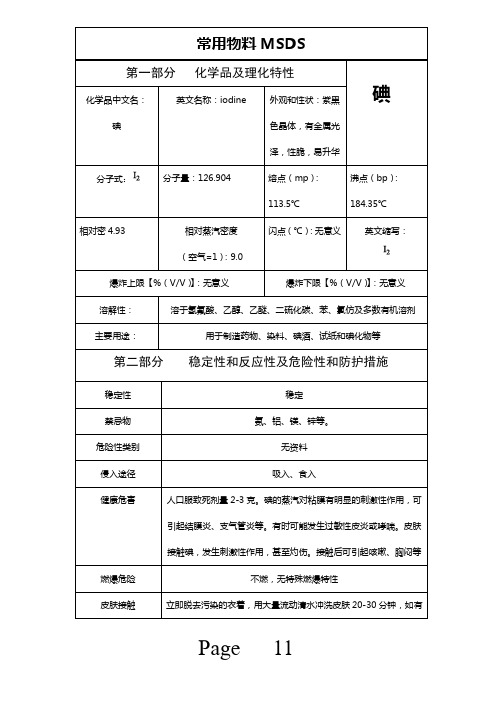
理化性质及危险、有害特性一览表标识中文名:碘英文名:iodium 危险类别:分子式:I2分子量:126.9 UN编号:1888 危货编号:RTECS号: CAS号:67-66-3理化性质物质状态、外观、气味:呈紫黑色晶体具有金属光泽,性脆,易升华。
有毒性和腐蚀性熔点(℃):113.5℃溶解性:易溶于乙醚、乙醇、氯仿和其他有机溶剂,也溶于氢碘酸和碘化钾溶液而呈深褐色沸点(℃):184.35℃相对密度(水=1):.93 克/立方厘米饱和蒸汽压(KPa):13.33(10.4℃) 相对密度(空气=1):临界温度(℃):燃烧热(KJ/mol):无意义临界压力(MPa):最小引燃能量(mJ):燃烧爆炸危险性及消防燃烧性:燃烧分解产物:。
闪点(℃):无意义聚合危害:爆炸极限(体积分数%):稳定性:引燃温度(℃):禁忌物:危险特性:和同族卤素气体一样,碘蒸汽有毒,所以取用碘的时候,应尽量在通风橱中操作。
爆炸性气体的分类、分级、分组火灾危险性分级:爆炸危险类别:最大爆炸压力(MPa):灭火方法:消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服,在上风向灭火。
灭火剂:雾状水、二氧化碳、砂土。
健康危害与防护工作场所职业接触限值(mg/m3)职业毒性危害等级侵入途径MAC:PC-TWA:PC-STEL:健康危害主要作用于中枢神经系统,具有麻醉作用,对心、肝、肾有损害。
急性中毒:吸入或经皮肤吸收引起急性中毒。
初期有头痛、头晕、恶心、呕吐、兴奋、皮肤湿热和粘膜刺激症状。
以后呈现精神紊乱、呼吸表浅、反射消失、昏迷等,重者发生呼吸麻痹、心室纤维性颤动。
同时可伴有肝、肾损害。
误服中毒时,胃有烧灼感,伴恶心、呕吐、腹痛、腹泻。
以后出现麻醉症状。
液态可致皮炎、湿疹,甚至皮肤灼伤。
慢性影响:主要引起肝脏损害,并有消化不良、乏力、头痛、失眠等症状,少数有肾损害及嗜氯仿癖。
防护措施工程控制:密闭操作,局部排风。
呼吸系统防护:空气中浓度超标时,应该佩戴直接式防毒面具(半面罩)。
碘质量标准
1.外观
碘的外观应呈深紫色晶体,具有金属光泽,纯度较高的碘应呈现为无色透明的晶体。
2.纯度
碘的纯度应不低于99.5%。
纯度越高,其颜色越深。
纯度较低的碘可能呈现为浅紫色或淡黄色。
3.溶解性
碘可以溶于酒精、乙醚、丙酮等有机溶剂,但不溶于水。
在溶解过程中,应观察是否有沉淀或杂质产生。
4.稳定性
碘在常温下稳定,但在光照、高温或与空气中的氧气接触时易发生分解。
为保证碘的稳定性,应将其存放在阴凉干燥的地方,避免阳光直射。
5.含水量
碘中含水量应低于0.5%。
过多的水分会导致碘在储存和使用过程中变质。
6.灼烧残渣
灼烧碘的残渣应呈黑色或深棕色,这是由于碘在高温下被氧化所致。
残渣的多少反映了碘的纯度和生产工艺。
7.微生物限度
碘中应无微生物污染。
使用前应进行微生物限度检查,以确保产品质量和安全性。
8.重金属含量
碘中重金属含量应符合相关标准规定。
重金属含量过高会对人体健康产生负面影响,因此应严格控制重金属含量。
9.砷含量
碘中砷含量也应符合相关标准规定。
砷是一种有毒物质,其含量过高会对人体健康产生负面影响。
因此,在生产过程中应严格控制砷的引入和含量。