家兔呼吸运动调节
- 格式:doc
- 大小:154.50 KB
- 文档页数:4

实验家兔呼吸运动的调节【目的】1、观察血液中化学因素(PCO2、PO2、和〔H+〕)改变对家兔呼吸运动(呼吸频率、节律、幅度)的影响,初步探讨其作用部位,并分析机制。
观察迷走神经在家兔呼吸运动调节中的作用,初步探讨其机制。
2、掌握气管插管术和神经血管分离术。
【材料和方法】1、材料家兔;手术台,手术器械;20ml和1ml注射器,橡皮胶管;装有CO2的气袋;生理盐水,氨基甲酸乙酯,乳酸;呼吸换能器,微机生物信号采集处理器系统2、方法2.1 实验系统连接及参数设置用胶管连接流量头与气管插管,流量头连接呼吸流量换能器。
用胶管连接呼吸换能器测压口和气管插管,呼吸换能器输出线接微机生物信号处理系统。
启动系统软件,在系统软件窗口设置仪器参数。
2.2手术准备“⊥”形剪口,用纱布将气管切口及气管里的血液和分泌物擦净,气管插管由剪口处向肺端插入,插时应动作轻巧,避免损伤气管黏膜引起出血,用一粗棉线将插管口结扎固定,另一棉线在切口的头端结扎止血。
2.3实验观察【结果】1、增加无效腔后,PaCO2↑+PaO2↓呼吸加快加深2、增加吸入气中二氧化碳分压,PaCO2↑呼吸加快加深,肺通气量增大3、增加血液中的〔H+〕,呼吸运动加深加快4、切断双侧迷走神经,呼吸运动变慢变深5、电刺激迷走神经后,可使呼吸明显变浅变快【讨论】1、增大呼吸无效腔对呼吸运动的影响增加气道长度后家兔呼吸张力增加,呼吸频率增加。
增加气道长度等于增加无效腔,增加无效腔使肺泡气体更新率下降,效果促使O2分压下降,CO2分压上升,刺激中枢和外周化学感受器引起呼吸运动加深加快;另外,气道加长使呼吸气道阻力增大,减少了肺泡通气量,反射性呼吸加深加快;增加家兔气道长度可使家兔通气量增加,呼吸频率加快。
2、增加吸入气中二氧化碳分压对呼吸运动的影响吸入高浓度CO2后家兔通气量明显增加,呼吸频率加快,呼吸运动加深加快。
用增加吸入CO2来增大气道阻力,实际上是在正常的呼吸中忽然阻断整个呼吸系统和外界的联系。

家兔呼吸运动的调节实验报告总结一、引言家兔呼吸运动的调节是生理学中一个重要且复杂的研究课题。
通过实验探究家兔呼吸运动的调节机制,不仅可以更深入地了解呼吸系统的功能,还有助于揭示人类呼吸系统的生理和病理特点。
本实验旨在通过调节不同呼吸节律和环境条件来观察家兔呼吸运动的变化,从而探索呼吸运动的调节机制。
二、实验目的1. 了解家兔呼吸运动的基本特征和调节机制。
2. 观察家兔呼吸运动在不同呼吸节律和环境条件下的变化。
3. 探究家兔呼吸运动的调节机制。
三、实验方法1. 实验动物:健康家兔。
2. 实验仪器:生物信号采集系统、呼吸运动测定仪等。
3. 实验步骤:1) 采集基础值:记录家兔在自由呼吸状态下的呼吸频率和潮气量。
2) 调节呼吸节律:通过呼吸运动测定仪调节家兔的呼吸节律,观察呼吸运动的变化。
3) 调节环境条件:改变家兔所处环境的温度、湿度等条件,观察呼吸运动的变化。
四、实验结果1. 基础值记录:家兔自由呼吸状态下,呼吸频率为25次/分,潮气量为200ml/次。
2. 调节呼吸节律:当将家兔的呼吸节律调至较快时,呼吸频率明显增加,而潮气量减少;当呼吸节律调至较慢时,呼吸频率减少,而潮气量增加。
3. 调节环境条件:在较高温度和湿度条件下,家兔呼吸频率增加,潮气量减少;在较低温度和湿度条件下,家兔呼吸频率减少,潮气量增加。
五、实验讨论1. 家兔呼吸运动的调节机制是复杂多样的,受到呼吸中枢、化学感受器和周围感受器的共同调节。
2. 调节呼吸节律和环境条件对家兔呼吸运动的影响是明显的,反映了呼吸系统对外界环境的适应性和调节性。
六、实验总结本实验通过调节家兔呼吸节律和环境条件,观察了呼吸运动的变化,并探讨了家兔呼吸运动的调节机制。
从实验结果可以看出,家兔呼吸运动受到多种因素的影响,是一个复杂的生理过程。
深入探究家兔呼吸运动的调节机制,有助于我们更好地理解呼吸系统的功能和生理特点,对于进一步研究人类呼吸系统的生理和病理特点具有重要意义。

第1篇一、实验目的1. 观察并记录不同条件下家兔呼吸运动的变化,包括呼吸频率、节律和通气量。
2. 探究血液中化学因素(PCO2、PO2、H+)对呼吸运动的影响及调节机制。
3. 分析迷走神经在家兔呼吸运动调节中的作用和机制。
4. 学习气管插管术和神经血管分离术。
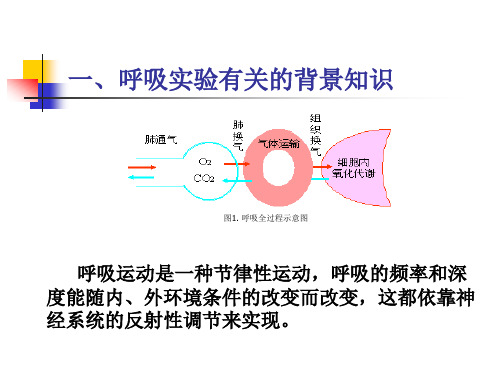
二、实验原理呼吸运动是指在中枢神经系统的控制下,通过呼吸肌的节律性运动使胸廓节律性地扩大或缩小。
呼吸运动不仅受中枢神经系统的控制,还受到一些理化因素(如代谢产物、药物、肺的扩张与缩小等)的调节。
这些理化因素可通过化学敏感呼吸反射、肺牵引反射等途径直接或间接地作用于中枢神经系统,调节呼吸运动。
三、实验对象与材料1. 实验对象:家兔(雌雄不限,体重约2.5kg)2. 实验材料:BL-420多通道生理信号采集系统、电刺激器、兔手术台、哺乳动物手术器械、气管插管、注射器、棉线、纱布、3%戊巴比妥钠、3%乳酸、钠石灰、气囊、CO2、胶皮管。
四、实验步骤1. 麻醉与固定:使用3%戊巴比妥钠溶液进行家兔麻醉,待动物麻醉成功后,将其固定在兔手术台上。
2. 气管插管:在颈部切开皮肤,暴露气管,插入气管插管,连接气囊,确保呼吸道的通畅。
3. 神经血管分离:在颈部切开皮肤,暴露迷走神经和颈动脉,用棉线将迷走神经与颈动脉分离。
4. 连接生理信号采集系统:将气管插管与BL-420多通道生理信号采集系统连接,记录呼吸频率、节律和通气量。
5. 观察与记录:a. 基础呼吸运动:观察并记录家兔在正常条件下的呼吸频率、节律和通气量。
b. CO2吸入:将家兔置于含有CO2的密闭环境中,观察并记录呼吸运动的变化。
c. N2吸入:将家兔置于含有N2的密闭环境中,观察并记录呼吸运动的变化。
d. 迷走神经切断:切断家兔的迷走神经,观察并记录呼吸运动的变化。
五、实验结果与分析1. 基础呼吸运动:家兔在正常条件下的呼吸频率约为60次/分钟,节律规则,通气量稳定。
2. CO2吸入:吸入CO2后,家兔的呼吸频率明显加快,呼吸加深,通气量增加。


实验数据分析1.正常的家兔呼吸曲线由图可知,本组选取的家兔自身呼吸频率较快,幅度加大,后续增强呼吸的因素作用不是十分明显。
2.接空气气囊的家兔呼吸曲线图2.接空气气囊的家兔呼吸曲线曲线由图可知,改接空气气囊后,家兔呼吸幅度和频率均未出现太大变化。
3.接CO2气囊的家兔呼吸曲线CO2图3.接CO2气囊的家兔呼吸曲线由图可知,接CO2气囊后,家兔呼吸曲线幅度增大,频率加快。
这是因为CO2是调节呼吸运动最重要的生理性因素,不但对呼吸有很强的刺激作用,而且对维持延髓呼吸中枢正常兴奋活动是必须的。
当呼入气体中CO2浓度升高,血液中CO2浓度随之升高,CO2透过血脑屏障使脑脊液的CO2浓度也升高。
CO2与水反应生成H 2CO3,随后水解成HCO3-和H+,由H+刺激延髓化学感受器,间接作用于呼吸中枢,通过一系列调控使得呼吸作用加强。
此外,当CO2浓度增高时,还刺激主动脉体和颈动脉体的外周化学感受器,反射性地使呼吸加深加快。
4.接N2气囊的家兔呼吸曲线图4.接N2气囊的家兔呼吸曲线由图可知,接N2气囊后,家兔呼吸曲线幅度略有增大。
这是因为吸入纯N2时,因吸入气体中缺乏O2,肺泡气O2浓度下降,导致动脉血中O2浓度下降;而CO2浓度却基本不变(CO2扩散速度较快)。
随着动脉血中O2浓度下降,通过刺激主动脉体和颈动脉体外周化学感受器延髓的呼吸中枢兴奋,隔肌和肋间外肌活动加强,反射性引起呼吸运动增加。
5.增长解剖无效腔的家兔呼吸曲线图5.增长解剖无效腔的家兔呼吸曲线由图可知,增长解剖无效腔后,家兔呼吸幅度略有下降,而呼吸频率则稍稍上升,这是因为实验中通过插管的方式增大无效腔,也就是减小了进入肺泡的潮气量,即每次的有效气体更新变小。
结果促使O2分压下降,CO2分压上升,使其反射性的调节使呼吸加深加快。
所以膈肌放电的变化幅度加大,频率有微量增大。
反映到膈肌的收缩曲线,由于收缩频率的增大,为了维持正常的肺部通气量,所以收缩强度减弱。
南京大学医学院机能实验报告实验二题目家兔呼吸运动的调节一、实验目的1.观察血液中化学因素(PCO2 等)的改变对家兔呼吸运动的影响,探讨其作用机制。
2.掌握气管插管术和神经血管分离术。
二、实验材料及药品材料:家兔,动物手术器械(包括手术刀、粗剪、组织剪、止血钳),Y型玻璃气管插管,呼吸流量换能器,铁支架,结扎线,注射器,烧杯,生物信号采集处理系统。
药品:生理盐水,20%乌拉坦,1%普鲁卡因,氮气,二氧化碳,2%乳酸,50g/L 哌替啶,250g/L尼可刹米。
三、实验方法及现象1.打开电脑实验软件,调节仪器参数。
2.将呼吸换能器固定于铁支架上,输出线连接生物信号采集系统。
3.从动物房取家兔一只,称重。
本实验家兔体重为1.856kg,经鉴定,为雄性。
4.用20%乌拉坦对家兔于耳缘静脉注射麻醉。
根据理论,本实验应注射9.28ml。
观察动物结膜反射、瞳孔大小、呼吸心跳等。
5.将家兔固定于手术台,用棉绳勾住门齿,固定四肢。
局部剪毛,并点状注射1%普鲁卡因。
剪毛过程观察动物呼吸、心跳、结膜反射等。
6.颈前正中切开皮肤6-8cm,直至下颌角上1.5-2cm,用止血钳钝性分离软组织及颈部肌肉,暴露气管及气管平行的左右血管神经鞘,分离颈总动脉和迷走神经、气管。
在气管下穿两根结扎线备用。
7.在环状软骨下约1cm处做倒T型剪口,用棉签将气管中分泌物擦净。
气管插管由剪口处向肺端插入。
用结扎线将插管口结扎固定,在切口的头端用结扎线结扎止血。
用温热生理盐水纱布覆盖手术野。
8.描记一段正常呼吸运动曲线作为对照,辨认曲线上吸气、呼气的波形方向9.用一只小烧杯置于气管插管开口前,将二氧化碳气囊的导管口平行于气管插口使气体冲入烧杯,给动物吸入含有较高浓度二氧化碳的空气。
观察、记录呼吸运动的变化。
10.待呼吸曲线恢复正常,按上一步方法打开氮气气囊。
待家兔呼吸运动增强后即关闭氮气气囊。
11.待呼吸曲线恢复正常,由家兔耳缘静脉注射50g/L哌替啶,根据家兔呼吸状况,一旦出现呼吸幅度下降即停止给药。
家兔呼吸运动的调节【实验目的】1、学习记录家兔呼吸运动的方法2、.观察迷走神经在家兔呼吸运动调节中的作用3、观察并分析肺牵张反射及其他因素对呼吸运动的影响【实验原理】人体及高等动物的呼吸运动之所以能持续地、节律性地进行,是由于体内调节机制的存在。
正常节律性呼吸运动是在中枢神经系统参与下,通过多种传入冲动的作用,反射性调节呼吸的频率和深度来完成的。
体内、外的各种刺激,可以直接作用于中枢或不同部位的感受器,反射性地影响呼吸运动,以适应机体代谢的需要。
肺的牵张反射参与呼吸节律的调节。
【实验材料、器具和试剂】家兔、兔手术台,常用手术器械,止血钳、眼科剪、支架、气管插管、橡皮管、Pc-Lab 生物信号采集系统、张力传感器、保护电极、纱布、棉球、细棉线、注射器(20ml)、生理盐水等【实验步骤】;1、麻醉:取家兔一只称重,按4-5ml/Kg耳缘静脉注射25%氨基甲酸乙酯进行麻醉。
2、固定剪毛:背位固定在兔手术台上,剪去颈部被毛。
3、手术分离气管与颈部神经:A、颈部皮肤切口5-7cm:B、分离肌肉层:钝性分离C、行气管插管:倒“T”切口,插管固定D、分离双侧迷走神经4、手术分离家兔剑突软骨5、用金属钩钩住游离的剑突软骨,连接至张力换能器上。
6、打开PcLab生物信号采集系统,接通第一通道,输入张力信号、记录正常的呼吸曲线。
7、观察实验项目(1)记录正常的呼吸曲线,并识别吸气与呼气运动与曲线方向的关系。
(2)增加无效腔对呼吸运动的影响。
(3)CO2对呼吸运动的影响。
(4)缺氧对呼吸运动的影响。
(5)增加气道阻力对呼吸运动的影响。
(6)肺牵张反射(7)同时结扎双侧迷走神经,观察呼吸运动的变化。
(8)再次观察肺的牵张反射。
(9)剪断双侧迷走神经,分别刺激中枢端和外周端,观察呼吸运动的变化。
(10)缓慢放血20ml观察呼吸运动曲线的变化。
【实验结果】图1 家兔正常呼吸运动平静呼吸时,家兔的呼吸肌有节律的收缩和舒张,其波形也是有节律的周期性的移动文件1图2 家兔呼吸运动增加无效腔增大无效腔后,家兔的呼吸加深,呼吸频率加快;文件1图3家兔呼吸运动牵张反射(打起)肺牵张反射吸气过长过深,促使吸气及时转入呼气,呼气加长图4家兔呼吸运动牵张反射(抽气)肺牵张反射吸气过长过深,促使吸气时间加长。
家兔呼吸运动调节实验报告结果一、实验目的本实验旨在观察各种因素对家兔呼吸运动的影响,探讨呼吸运动的调节机制。
二、实验材料与方法(一)实验动物健康成年家兔一只。
(二)实验器材呼吸换能器、生物信号采集处理系统、手术器械、气管插管、动脉插管、注射器、CO₂气体瓶、N₂气体瓶、20%乌拉坦溶液等。
(三)实验步骤1、家兔称重后,用 20%乌拉坦溶液(5ml/kg)于耳缘静脉缓慢注射麻醉。
2、将家兔仰卧固定于手术台上,剪去颈部手术部位的毛,进行颈部正中切口,分离气管并插入气管插管。
3、分离一侧颈总动脉,插入动脉插管,通过压力换能器连接生物信号采集处理系统,记录动脉血压。
4、在剑突下切开皮肤,分离出剑突软骨,用丝线将其与张力换能器相连,以记录呼吸运动。
5、待动物稳定后,观察正常呼吸运动曲线。
6、依次进行以下操作,观察并记录呼吸运动的变化:增加吸入气中 CO₂浓度:通过气体瓶向气管插管内通入含较高浓度 CO₂的气体。
缺氧:用气囊阻断气管插管一段时间,造成缺氧。
增大无效腔:将一根长橡皮管连接在气管插管的一侧。
静脉注射乳酸溶液(2ml)。
切断双侧迷走神经,观察呼吸运动的变化。
然后分别刺激迷走神经中枢端和外周端,观察其效应。
三、实验结果(一)正常呼吸运动在未施加任何干预因素时,家兔的呼吸运动呈现出平稳、有节律的曲线,呼吸频率和幅度相对稳定。
(二)增加吸入气中 CO₂浓度当家兔吸入含较高浓度 CO₂的气体后,呼吸运动明显加深加快。
呼吸频率显著增加,呼吸幅度增大。
这表明 CO₂是调节呼吸运动的重要化学因素,其浓度升高可刺激呼吸中枢,增强呼吸运动。
(三)缺氧在造成缺氧的情况下,家兔的呼吸运动加深加快。
呼吸频率加快,呼吸幅度增大。
这是因为缺氧刺激外周化学感受器,反射性地引起呼吸运动增强,以增加肺通气量,改善缺氧状况。
(四)增大无效腔连接长橡皮管增大无效腔后,家兔的呼吸运动加深加快。
呼吸频率明显增加,呼吸幅度增大。
这是由于无效腔增大导致肺泡通气量减少,气体更新率降低,使得血液中的 PCO₂升高、PO₂降低,从而刺激呼吸中枢和外周化学感受器,引起呼吸运动增强。
模拟实验一:家兔呼吸运动调节
目的和原理观察血液中化学因素(PCO2、PO2和[H+])改变对家兔呼吸运动的影响,初步探讨其作用部位,并分析机制。
观察迷走神经在家兔呼吸运动调节中的作用,初步探讨其机理。
呼吸运动之所以有节律地进行,并能随时适应机体代谢的需要,是由于机体内存在着完整的调节机制。
体内外的各种直接或间接通过体内调节系统的作用而影响呼吸运动。
方法与步骤
(一)模拟装置及操作
1.呼吸运动调节模拟实验窗口(图24)。
家兔:家兔颈部气管插管,一通气口用胶管
连接呼吸换能器,家兔呼吸运动用期腹部动画展现。
图24 呼吸运动调节模拟实验窗口
2.手术刀:鼠标点击手术刀并拖动至家兔颈部释放,启动气管插管录象,录象结束,
记录仪描记家兔气道压力变化曲线。
3.仿真二道记录仪:第一道记录家兔气道压力变化曲线,第二道记录实验项目标记。
仿真记录仪面板设灵敏度、位移、纸速,面板设数字显示框,分别显示记录仪第
一道灵敏度、气道压力、呼吸频率、实验项目。
4.注射器:鼠标器点击注射器极拖动至家兔耳部上方释放,向输入框输入药品剂量,
点击确定,药品从家兔耳缘静脉注入。
呼吸运动因药物作用而发生变化,药品剂
量3%乳酸2ml
5.CO2气球、N2气球、胶管拖动至气管插管图气管插管开口长释放,呼吸运动发生
变化。
6.鼠标点击手术刀并拖动至家兔颈部神经解剖图的神经上方释放,可先后切断二侧迷
走神经,呼吸运动发生变化
7.测量按钮:按测量按钮,仿真记录仪显示所做实验项目的实验曲线,仿真记录仪面
板按钮变为图标按钮,有放大、缩小、压缩、扩展、定位图标按钮,分别可使仿
真记录仪内的实验曲线纵向放大或缩小,横向压缩或扩展,定位图标按钮可使所
选记录曲线处的位置移到仿真记录仪左边框。
8.测量状态:在测量状态下,鼠标器在仿真记录仪内移动,可对实验曲线进行测量,
并从仿真记录仪的面板数字显示框“压力”和“Time”中读出气道压力和呼吸周期
时间。
在曲线上点击,可测量相对值。
拖动仿真记录仪面板上的滚动条,可使实
验曲线左右滚动,显示前后实验滚动
9.窗口内容和可操作控件均有提示。
窗口提示栏右设置“返回”按钮,鼠标点击“返
回”按钮,程序返回到模拟实验室窗口。
(二)观察项目
1.描记正常呼吸曲线:记录一段正常呼吸运动曲线作为对照。
辨认曲线上吸气、呼气
的波形方向(注意:下列每一实验项目前必须先等待呼吸曲线恢复正常)。
2.观察缺O2对呼吸运动的影响:使用N2气囊,给动物吸入含有较高浓度N2气的空气
以造成部分缺O2,观察和记录呼吸运动的变化。
3.观察吸入气中CO2 含量增加对呼吸运动的影响:同上法用CO2气囊,使吸入的空气
中含有较多的CO2。
观察与记录到呼吸运动。
待呼吸恢复正常后再做下一步实验。
4.耳缘静脉缓慢注入2%乳酸溶液2ml,使血液中[H+]增加,观察血液酸碱度改变对呼
吸运动的影响。
5.观察迷走神经在呼吸运动调节中的作用:分别观察和记录切断一侧迷走神经和切断
两侧迷走神经以后呼吸运动的变化。
结果及分析
1.测量正常时,分别吸入CO2,纯N2 和注射乳酸溶液后家兔呼吸道气压力及呼吸频率
值并列表。
2.测量切断一侧迷走神经和切断两侧迷走神经以后家兔的吸气、呼气时间,吸气、呼
气幅度值。
3.比较分别吸入CO2,纯N2 和注射乳酸溶液,家兔呼吸运动的频率和幅度变化的差异,
分别说明它们各通过何种途径发挥作用。
对照实验结果,讨论切断迷走神经后家兔呼吸运动发生变化的机理。
一、目的要求:
通过快速静脉输液引起兔肺水肿的过程,了解肺水肿的表现及其发生机制。
二、实验动物:
家兔
三、药品与器材:
肾上腺素(1 :1000) ,生理盐水,1 %普鲁卡因,气管插管及呼吸描记装置,静脉导管和
静脉输液装置,颈部小手术器械、婴儿秤、天平、听诊器、滤纸、兔固定台、注射器、烧杯、纱布、线等。
四、实验方法:
•取兔一只,称重后仰卧固定于兔台上,剪去颈部被毛,在1 %普鲁卡因局麻下切开颈
前部皮肤,然后分离气管和一侧颈外静脉。
切开气管,插入气管插管,用丝线结扎固定后将呼吸描记装置相连,以描记呼吸。
结扎颈外静脉远心端,在近心端靠近结扎处剪一小口,插入静脉导管,结扎固定后将输液装置与之相接并试行滴注,通畅后暂停输液。
•描记一段正常呼吸,用听诊器听肺的呼吸音。
然后输入37 ℃生理盐水,输入量按80 ml
/kg 体重计算,输液速度150 ~180 滴/min ,输完后将肾上腺素按0 .5mg /kg 体重计算,
用生理盐水稀释10 倍后加入输液瓶中,继续滴注。
肾上腺素输完后可酌加少量生理盐水,以
10 ~15 滴/min 速度维持通道,以利必要时第2 次用药。
•输液过程中应密切观察以下情况:(1) 呼吸曲线是否变化,有否呼吸急促、困难;(2)
肺部是否出现罗音,属何性质;(3) 气管插管口有否粉红色泡沫样液体溢出。
如果上述情况变
化不明显可重复使用肾上腺素,用法及剂量同上,直至出现明显的肺水肿表现。
4 .动物发生肺水肿后,即可夹住气管,剪开胸前壁,在气管分叉处用线结扎,防止水肿
液溢漏,结扎处上方剪断气管,然后分离心脏及其血管,将肺取出,用滤纸吸干肺表面的水份后,准确称取肺重量,以计算肺系数。
肺系数计算公式:
肺系数= 肺重量(g )/ 体重(kg )
正常肺系数约为4 ~5 。
此后观察肺大体改变,切开肺,注意切面的变化,有否液体的溢出( 注意其量、性质、颜
色) ,联系肺水肿发生机制对结果作出分析。
五、注意事项:
1 .忌用实验前已有明显肺部异常征象( 罗音、喘息、气促等) 的动物,否则影响结果的可
靠性。
2 .剖取肺脏时,操作要小心,防止肺表面损伤引起水肿液外流,影响肺系数的准确性。
3 .在第1 次使用肾上腺素后肺水肿征象不明显者,可重复使用,两次输药间隔10 ~
15min ,不宜过频。
4 .应控制输液速度,不要太快,以150 ~180 滴/min 为宜。
六、讨论:
通过实验观察探讨肺水肿的发病机制。