循环伏安法
- 格式:ppt
- 大小:953.00 KB
- 文档页数:23



一、循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使用汞电极外,还可以用铂、金、玻璃碳、碳纤维微电极以及化学修饰电极等。
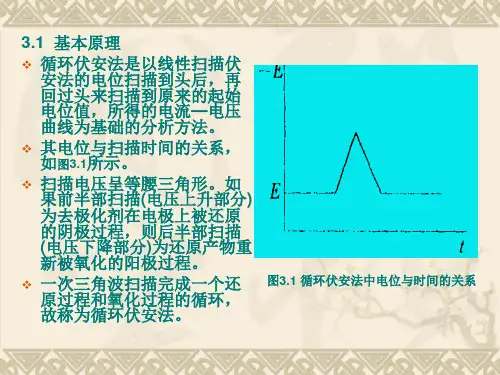
1.基本原理如以等腰三角形的脉冲电压加在工作电极上,得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
循环伏安法中电压扫描速度可从每秒种数毫伏到1伏。
工作电极可用悬汞电极,或铂、玻碳、石墨等固体电极。
2.循环伏安法的应用循环伏安法是一种很有用的电化学研究方法,可用于电极反应的性质、机理和电极过程动力学参数的研究。
但该法很少用于定量分析。
(1)电极可逆性的判断循环伏安法中电压的扫描过程包括阴极与阳极两个方向,因此从所得的循环伏安法图的氧化波和还原波的峰高和对称性中可判断电活性物质在电极表面反应的可逆程度。
若反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称。
(2)电极反应机理的判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。
3、循环伏安法的用途(1)、判断电极表面微观反应过程(2)、判断电极反应的可逆性(3)、作为无机制备反应“摸条件”的手段(4)、为有机合成“摸条件”(5)、前置化学反应(CE)的循环伏安特征(6)、后置化学反应(EC)的循环伏安特征(7)、催化反应的循环伏安特征二、循环伏安法相关问题:1、利用循环伏安确定反应是否为可逆反应(一般这两个条件即可)①.氧化峰电流与还原峰电流之比的绝对值等于1.[有时对同一体系,扫描速率不同也会在一定程度上影响其可逆性的一般而言,扫描速度对峰电位没有影响,但扫描速率越大其电化学反应电流也就越大.]②.氧化峰与还原峰电位差约为59/n mV, n为电子转移量(温度一般是293K).[但是一般我们实验时候不是在这个温度下,因此用这个算是有误差的,一般保证其值在100mv以下都算合理的误差.]2、判断扩散反应或者是吸附反应:改变扫描速率,看峰电流是与扫描速率还是它的二次方根成正比。



循环伏安法的工作原理1循环伏安法简介循环伏安法是一种经典的电化学方法,用于研究电极表面、某些离子溶液的氧化还原行为以及电化学反应动力学等问题。
它通常是通过改变电极电势,监测电流变化并绘制伏安曲线来实现的。
2循环伏安法的步骤循环伏安法的基本步骤非常简单:1.使电极在某个起始电势下静置一段时间,稳定后测量电流荷兰玻璃电极。
2.电势施加到不同的电位点上,记录下对应的电流值。
3.逆转电势并再次进行相同的测量。
4.让电极回到起始电势并记录相关电流值。
3循环伏安法的意义通过循环伏安法,我们可以测量氧化还原反应动力学及其机理。
这种方法广泛应用于电化学催化(如燃料电池)、电化学传感器、电极表面修饰以及材料表征等方面。
此外,该方法还能用于检测氧化还原反应参与的化学物质、观察电极电势对电化学反应的影响以及评价反应热力学和动力学参数等。
4循环伏安法的优点和应用循环伏安法的优点在于可靠性高、重复性好、具有很高的空间和时间分辨率,并且对于难以直接测量的实验系统进行反应动力学研究具有明显优势。
该方法在离子电解质的反应动力学、材料表征、催化和传感器等领域得到广泛应用。
例如,它被用于测量气体传感器、生物传感器、电化学电池等方面。
5循环伏安法的局限需要注意的是,循环伏安法也有局限性:仅能适用于反应速率较慢的化学体系,并需要高度纯净的电解质,还需要空气无尘条件下进行操作。
6结论总之,循环伏安法是一种非常重要且广泛应用的电化学研究方法,有效探究氧化还原反应机理,对于催化、物质表征等领域有着广泛应用。
理解和掌握循环伏安法的基本原理和应用场合,将有助于开展相关研究,并推动电化学研究的发展和应用。

循环伏安法目录循环伏安法概念基本原理循环伏安法的应用循环伏安法的用途编辑本段循环伏安法概念循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使用汞电极外,还可以用铂、金、玻璃碳、碳纤维微电极以及化学修饰电极等。
编辑本段基本原理如以等腰三角形的脉冲电压加在工作电极上,得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
循环伏安法中电压扫描速度可从每秒种数毫伏到1伏。
工作电极可用悬汞电极,或铂、玻碳、石墨等固体电极。
编辑本段循环伏安法的应用循环伏安法是一种很有用的电化学研究方法,可用于电极反应的性质、机理和电极过程动力学参数的研究。
但该法很少用于定量分析。
(1)电极可逆性的判断循环伏安法中电压的扫描过程包括阴极与阳极两个方向,因此从所得的循环伏安法图的氧化波和还原波的峰高和对称性中可判断电活性物质在电极表面反应的可逆程度。
若反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称。
(2)电极反应机理的判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。

循环伏安法原理
循环伏安法(Cyclic voltammetry,CV)是一种常用于电化学
研究的实验技术,用于研究电化学反应动力学、电极表面的电化学性质以及电极材料的电化学特性。
该方法的原理基于对电极上施加一系列线性变化的电位,通过测量所施加电位下的电流响应来获取样品的电化学信息。
CV
实验通常在三电极电极池中进行,包含工作电极、参比电极和计量电极。
首先,通过施加一个起始电位,使得工作电极与参比电极之间建立起一个起始电位差。
然后,通过改变电位来引发电化学反应,这导致在电极表面上发生氧化和还原反应。
这些反应会引起从工作电极到计量电极的电流流动。
随后的实验过程中,电位逐渐改变,使得电化学反应在每个电位值上进行。
电位的变化速率称为扫描速率,可用于控制反应速率。
在每个电位上,会测量到一个对应的电流响应,并绘制成循环伏安曲线。
通过分析循环伏安曲线,可以获取有关电化学反应的许多信息,例如反应的峰电位(峰电位代表了氧化还原反应的电位值)、峰电流(峰电流与反应速率有关)、氧化还原峰之间的电位差(反映反应的可逆性质)、氧化还原峰的峰形等。
此外,CV
还可以用于确定电极表面的有效面积、测量电极表面上的电荷转移速率等参数。
总之,循环伏安法通过改变电位来引发电化学反应,并通过测量电流响应来获取电化学信息。
它是一种简单有效的电化学检测方法,被广泛应用于材料科学、化学分析、电池研究等领域。

循环伏安法原理及结果分析在电化学研究领域,循环伏安法是一种极其重要的研究手段。
它不仅能提供有关电极反应的丰富信息,还在材料科学、生物化学、环境监测等众多领域发挥着关键作用。
接下来,让我们深入了解一下循环伏安法的原理以及如何对其结果进行分析。
循环伏安法的基本原理基于控制电极电位的线性扫描。
在实验中,工作电极的电位以一定的速率在一个特定的电位范围内进行周期性的线性扫描。
通常,电位从起始电位开始,向一个方向扫描到终止电位,然后反向扫描回到起始电位,如此反复,形成一个循环。
在这个过程中,电极表面会发生氧化还原反应。
当电极电位达到某种物质的氧化电位时,该物质会在电极表面被氧化,产生氧化电流;当电极电位反向扫描到该物质的还原电位时,之前被氧化的物质会被还原,产生还原电流。
通过测量这些电流随电位的变化关系,我们就能够获得有关电极反应的信息。
为了更好地理解循环伏安法的原理,我们可以以一个简单的氧化还原反应为例。
假设在溶液中存在一种可氧化还原的物质 A,其氧化态为 A+,还原态为 A。
当工作电极的电位逐渐升高时,当达到 A 的氧化电位时,A 会被氧化为A+,同时产生氧化电流。
随着电位的继续升高,氧化电流可能会先增大,然后由于扩散控制等因素逐渐减小。
当电位反向扫描时,A+会在电极表面被还原为 A,产生还原电流。
那么,循环伏安法得到的结果通常以电流电位曲线的形式呈现。
在分析这些曲线时,有几个关键的参数和特征需要关注。
首先是峰电位。
氧化峰电位和还原峰电位分别对应着物质的氧化和还原过程中电流达到最大值时的电位。
峰电位的位置可以提供有关反应的难易程度和可逆性的信息。
一般来说,对于可逆反应,氧化峰电位和还原峰电位之间的差值较小;而对于不可逆反应,这个差值较大。
其次是峰电流。
峰电流的大小与参与反应的物质的浓度、扩散系数以及扫描速率等因素有关。
根据 RandlesSevcik 方程,在一定条件下,峰电流与扫描速率的平方根成正比,与物质的浓度成正比。

循环伏安法介绍循环伏安法(Cyclic Voltammetry,简称CV)是一种电化学测试方法,广泛应用于表征电化学反应的动力学、电化学过程的机理和电极材料的性质等方面。
该方法通过不断改变电极电位,并测量对应的电流,来获得电化学反应过程中的电化学信息。
原理循环伏安法基于电化学基础理论和法拉第定律,利用电极材料与电解质溶液之间的电化学反应,在电位范围内,通过施加正向和负向扫描电压,观察电流的变化,得到伏安图。
伏安图表示了电流与电极电位之间的关系,反映了电化学反应的动力学与热力学信息。
实验步骤1.准备工作:清洗电极并将其与计量电位仪连接好。
2.准备电解质溶液:根据实验需求,配置适当浓度的电解质溶液,并使用磁力搅拌器搅拌均匀。
3.实验设置:将电解质溶液注入电解池中,并使电极浸入其中。
根据需要,设置施加电压的扫描范围和扫描速率。
4.实验操作:打开计量电位仪,设置初始电位,并开始扫描。
仪器会逐渐改变电极电位,并记录对应的电流值。
5.数据处理:根据实验结果,绘制伏安图,并分析图形特征。
根据法拉第定律,可以计算电极反应的电荷转移系数、反应速率常数等参数。
应用循环伏安法在电化学和材料科学领域有着广泛的应用。
1.电化学催化研究:循环伏安法可以用于表征电化学催化剂的活性和稳定性,评估催化剂对某种电化学反应的催化效率。
2.电极材料研究:通过循环伏安法可以评估电极材料的电活性表面积、电荷传递速率以及与电解质溶液之间的界面反应。
3.电化学反应动力学研究:利用循环伏安法可以确定电极反应的控制步骤和反应机理,并研究电化学反应速率与温度、扫描速率等因素的关系。
优点和局限循环伏安法具有以下优点:•实验步骤简单,容易操作。
•可以快速获取材料的电活性表面积等信息。
•可以在不同电位下观察电化学反应的动力学与热力学变化。
然而,循环伏安法也存在一些局限性:•无法直接获得电化学反应的反应速率常数等定量信息。
•实验数据分析较为复杂,需要依赖理论模型和数学计算。
循环伏安法介绍基本定义循环伏安法是指在电极上施加一个线性扫描电压,从起始电位以一定的速率扫描到一个顶点电位,再从该顶点电位扫描到另一个顶点电位的两阶段,此扫描可以在两个顶点电位之间多次重复。
循环伏安方法应用极为广泛。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界面吸附或新相形成的可能性,以及偶联化学反应的性质等。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为〃电化学的谱图〃。
激励信号(A)-UBOdTιme(s)循环伏安法的激励信号图该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
2、关键参数、参数的可设置范围及通常的设置范围最初电位(V):扫描起始点。
可设置范围10~∙10;依据体系的差异,水相体系T殳设置在±2.0V,有机相可以扩展到±5.0V,电池或串联电池体系还会更大。
最终电位(V):扫描最终点。
参数设置同上。
顶点电位I(V):电位扫描的最高限制。
参数设置同上。
顶点电位2(V):电位扫描的最低限制。
参数设置同上。
静置时间(S):电位扫描开始前的静置时间。
可设置范围1~100000。
通常设置为几秒或几十秒内。
扫描速率(V∕s):电位变化率,可设置范围IXIO-4~10000;稳态测量T殳数mV∕s,一般电极过程研究和测量可由数mV/s到数V∕s,快速表面反应电极过程动力学研究或超微电极快速扫描最高可以设置到数kV∕s o高扫描会有大电流,应注意考虑溶液电阻影响。
循环次数:1~500000次;全部点数:每个扫描周期的默认数据采集量为2000个点。
全部点数为2000X循环次数。
研究体系及实验曲线31、玻碳电极,1mMK3[Fe(CN)6]+1MKCI三电极体系:WE-GCE;RE-SCE;CE-Pt丝。
参数设置:o针对该体系,在扫速为0.001V/S以下时,避免实验时间过长,扫描范围选择为0.4~0.05V;选择在扫速为0.001〜0.01V/s时,扫描范围选择为0.5~-0.05V,避免扫描电位过负出现析氢现象;当扫速较高时,可以通过溶液电阻校正获得比较理想的实验曲线。
循环伏安法的基本原理
循环伏安法是一种常用的电化学实验技术,用于研究电化学反应的动力学和热力学性质。
它通过对电流与电势之间的关系进行测量,来探索电化学体系的特性。
其基本原理可以概括如下:
1. 经过循环伏安法之前,首先准备一个工作电极和参比电极。
工作电极是用来进行电化学反应的地方,而参比电极则作为电势的标准参照物。
2. 在实验开始前,先将电解质溶液中的离子浓度调节到所需程度,并将其填充至电化学池中。
3. 实验开始时,施加一个固定的电位范围在工作电极上,然后随着时间的变化,循环地改变工作电极电位。
4. 改变电位的频率和范围可根据具体需求进行调整,常用的有线性扫描、脉冲等方式。
5. 在每个电位下测量电流的变化,并记录下来。
通过测量电流与电势之间的关系,可以获得独特的电流-电势曲线,也称为循环伏安曲线。
6. 根据循环伏安曲线的形状和变化趋势,可以推断出电化学反应的机理、速率常数以及反应的可逆性等信息。
需要注意的是,具体的循环伏安法实验步骤可能会有所差异,但其基本原理不会改变。
循环伏安法在化学、材料科学、能源
等领域中有广泛的应用,能够帮助科学家们深入了解电化学反应的原理和性质,为新材料的开发以及能源技术的改进提供有力支持。
循环伏安法的基本原理循环伏安法(Cyclic Voltammetry, CV)是一种电化学分析方法,通过在电化学电极上施加一定的电压波形,然后测量电流随时间或电压的变化,从而研究电化学反应的动力学和热力学过程。
循环伏安法具有操作简便、结果可靠、信息丰富等优点,因此在化学、生物、环境等领域得到了广泛的应用。
循环伏安法的基本原理可以简单概括为电化学反应的动力学和热力学过程。
在进行循环伏安实验时,首先需要选择合适的工作电极,常用的有玻碳电极、金电极等。
然后将待测溶液置于电化学池中,通过外加电压或电流的方式,施加一定的电压波形,一般包括正向扫描、反向扫描和保持时间等步骤。
在这个过程中,电化学反应会在电极表面发生,导致电流的变化。
通过测量电流随时间或电压的变化,可以得到一系列的伏安曲线,从而分析电化学反应的动力学和热力学过程。
循环伏安法的原理基于法拉第定律和欧姆定律。
法拉第定律描述了电化学反应速率与电极电位之间的关系,而欧姆定律则描述了电流与电压之间的关系。
在循环伏安实验中,电极表面的电化学反应会随着电压的变化而发生,从而产生电流的变化。
通过分析伏安曲线的形状和特征,可以推断出电化学反应的类型、速率、反应物质的浓度等信息。
循环伏安法还可以用来研究电化学反应的热力学过程。
在循环伏安实验中,通过测量电流随电压的变化,可以得到氧化还原峰的位置、峰电位、峰电流等参数,从而计算出反应的标准电极电势、转移系数、电子转移数等热力学参数。
这些参数对于研究电化学反应的热力学过程具有重要的意义。
总之,循环伏安法是一种重要的电化学分析方法,其基本原理涉及电化学反应的动力学和热力学过程。
通过测量电流随时间或电压的变化,可以得到丰富的信息,对于研究电化学反应机理、催化剂活性、生物传感器等方面具有重要的应用价值。
希望通过本文的介绍,读者对循环伏安法的基本原理有所了解,并能够在实际工作中加以运用。
循环伏安法比电容公式推导循环伏安法(Cyclic Voltammetry,CV)是一种常用的电化学研究方法,在材料科学、能源存储等领域有着广泛的应用。
其中,通过循环伏安法来推导比电容公式是理解和分析电化学电容器性能的重要环节。
咱们先来说说循环伏安法到底是咋回事。
想象一下,你有一个电化学电池,就像一个小小的魔法盒子。
然后呢,你给这个盒子施加一个电压,从低到高,再从高到低,不断地循环这个过程。
在这个过程中,电流会随着电压的变化而变化,就像一个调皮的小精灵在跳来跳去。
循环伏安法得到的曲线通常会有一些特征,比如氧化峰和还原峰。
这些峰的位置和形状能告诉我们很多关于电极材料的信息,比如它的氧化还原反应活性啦,反应的可逆性啦等等。
接下来,咱们就要进入正题,推导比电容公式啦!假设我们在进行循环伏安测试时,得到的电流-电压曲线是一个比较理想的形状。
咱们先看一下比电容(C)的定义,它表示单位电压变化下电极存储电荷的能力。
那怎么从循环伏安曲线中得到这个比电容呢?这就得从电流(I)和扫描速率(v)说起啦。
在循环伏安曲线中,电流和电压是有关系的。
我们假设在某个电压区间内,电流和电压呈线性关系。
那么电流(I)就可以表示为:I = av + b ,这里的 a 和 b 是常数。
然后呢,我们对这个式子进行积分。
积分的区间就是我们所关注的电压区间。
经过一番复杂但有趣的数学运算(这里就不详细展开啦,不然会把大家绕晕的),最终我们可以得到比电容的公式:C =(∫IdV)/(vΔV) 。
这里的∫IdV 就是电流-电压曲线下的面积,v 是扫描速率,ΔV 是电压的变化范围。
有一次我在实验室带着学生做这个实验的时候,就遇到了一个小插曲。
有个学生特别着急,还没等仪器稳定就开始记录数据,结果得到的曲线乱七八糟的。
我就跟他说:“别着急,做实验就像煲汤,得小火慢炖,才能出好味道。
”后来他静下心来,重新做,终于得到了漂亮的曲线,也成功推导出了比电容公式,那高兴劲儿就甭提了!总之,循环伏安法比电容公式的推导虽然有点复杂,但只要我们耐心细致,就一定能搞明白。
循环伏安的原理
循环伏安法是一种电化学技术,主要用于分析物质的电化学特性。
该技术是通过在电极表面施加正弦交流电压,并对其响应的电流进行测量来实现的。
循环伏安技术可以用于测量物质的电化学反应动力学参数,如电化学反应速率、电荷转移率和表面反应速率等。
循环伏安法的实验装置包括电化学池、三电极和电位扫描仪等。
电化学池中包含待测物质、参考电极和计数电极,它们均是由电导率高的材料制成。
在实验开始时,参考电极和计数电极之间施加一个正弦波电压,以产生电势分布。
然后,电势将被扫描到一个区域,以引发化学反应。
在电压扫描过程中,电极表面的电位会发生变化,并产生对应的电流响应。
通过测量每个电压扫描周期内的电流响应,可以了解反应的动力学特性。
循环伏安法的原理是基于电化学反应动力学和电位扫描的相互作用。
扫描电位的变化导致电极表面的电位变化,并促使化学反应发生。
在循环伏安扫描的过程中,电极表面的电势会从正向变化到负向,并在反向扫描时重新从负向变化到正向。
这种循环电位可以引发多种电化学反应,包括氧化反应、还原反应和电极表面的电荷转移反应。
循环伏安法可以有助于研究许多不同类型的电化学反应。
例如,它可以用于测量金属物质的耐蚀性、半导体材料的导电性能以及有机物分子和多肽的物化特性。
此外,循环伏安法还可用于测量电化学反应发生的速率和体系中电子转移的能力等参数。
总之,循环伏安法是一种非常有用的电化学技术,它可以用于研究各种物质的电化学特性。
通过施加交变电压并测量对应的电流响应,可以确定物质的电化学反应动力学参数,并研究其电荷转移过程和表面反应速率。