质量记录汇总表格模板
- 格式:doc
- 大小:799.50 KB
- 文档页数:91

质量检查记录表模板日期:___________________项目名称:___________________检查人:___________________被检查单位/人员:___________________检查内容:1. 背景信息- 项目背景介绍:概述被检查单位/人员参与的项目情况。
- 相关标准或要求:列出适用的标准或要求,并确保被检查单位/人员了解及遵守。
2. 检查细节- 检查日期和时间:记录实际进行检查的日期和时间。
- 检查地点:指明检查进行的具体地点。
- 检查内容:详细列出需要检查的方面,如质量控制、工作流程、材料使用、工作环境等。
- 检查方法:使用何种方法、工具或设备进行检查,如抽样、测量、观察等。
- 检查标准:说明参考的标准或要求,判断检查结果是否符合标准或要求。
3. 检查结果- 符合项:列出检查过程中符合标准或要求的事项,并附上具体说明和证据。
- 不符合项:列出检查过程中不符合标准或要求的事项,并附上具体说明和证据。
- 建议和改进措施:针对不符合项提出建议和改进措施,以促使被检查单位/人员改善质量。
4. 结论- 综合评价:根据检查结果,对被检查单位/人员的整体质量情况进行评价。
- 补充说明或建议:如有必要,对检查过程中的特殊情况进行补充说明或提出进一步建议。
5. 签字- 检查人:填写检查人的姓名和签字。
- 被检查单位/人员确认:填写被检查单位/人员的姓名和签字,以表示对检查结果的确认。
注:本质量检查记录表仅供参考,具体内容和格式可根据实际需要进行调整和修改。
参考图示(可根据需要添加/删除内容):_________________________日期:___________________项目名称:___________________检查人:___________________被检查单位/人员:___________________检查内容:1. 背景信息(请在此处填写)2. 检查细节- 检查日期和时间:(请在此处填写)- 检查地点:(请在此处填写)- 检查内容:(请在此处填写)- 检查方法:(请在此处填写)- 检查标准:(请在此处填写)3. 检查结果- 符合项:(请在此处填写)- 不符合项:(请在此处填写)- 建议和改进措施:(请在此处填写)4. 结论(请在此处填写)5. 签字- 检查人:___________________- 被检查单位/人员确认:___________________附注:本质量检查记录表仅供参考,具体内容和格式可根据实际需要进行调整和修改。

质量管理体系质量记录表格汇总文件( 资料) 档案目录Q质-01文件( 资料) 发放记录 Q质-02名称: 编号:Q质-03文件( 资料) 更改登记表Q质-资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
文件借阅( 复制) 登记表Q质-056质量信息( 反馈回复) 登记 Q质-质量信息反馈单Q质-07质量信息处理回复单Q质-08资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
文件( 资料) 接收记录 Q质-0910受控文件清单 Q质-10Q质-11年第次内部审核实施计划年月日Q质-11-1Q质-11-2审核组成员名单Q质-11-3Q质-12年第次内部审核检查表受审核单位: 共页第页17Q质-12-1年第次内部审核检查表受审核单位: 共页第页1819资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
Q质-13内部审核不符合报告注: 此表一式两份, 一份留受审核单位, 一份由组织审核部门归档。
如纠正和纠正措施涉及多个单位, 可根据情况增加份数。
Q质-14年第次内部审核报告质量( ) 字——年月日Q质-14-1Q质-14-2Q质-14-3( ) 级不合格品审理申报表 Q质-15申报单位: 编号:资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
质量工作计划( 目标) 实施情况检查表Q质-16单位: 年月日此表一式二份, 质量管理部门一份, 填报单位一份审核: 制表:27资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
质量问题认可记录Q质-17年月日质量问题认可记录Q质-17年月日资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
Q质-18日期: 检查地点:检查人:监督检查记录本问题:确认人:处理结果:单位:验证:29资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
产品质量追踪卡Q质-19品种: 批号:产品质量追踪卡Q质-19-1 品种: 批次:内部沟通函Q质-20年月日一式三份( 发件单位, 收件单位, 质管部门)内部沟通函Q质-20年月日一式三份( 发件单位, 收件单位, 质管部门)资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。

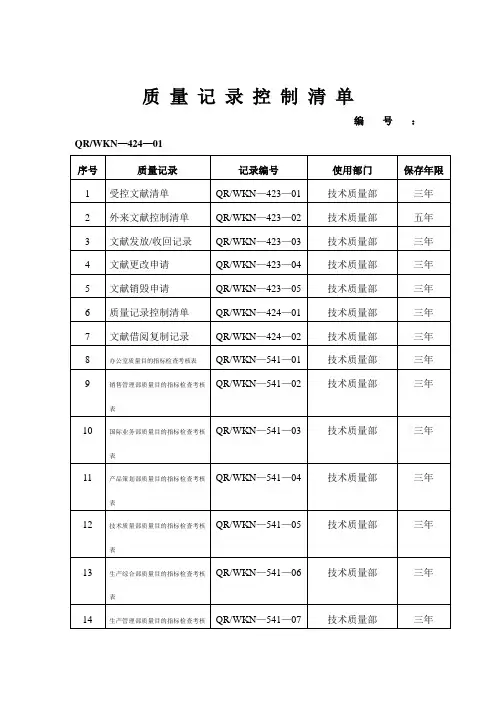
质量记录控制清单编号:QR/WKN—424—01编制:批准:质量记录控制清单编号:QR/WKN—424—01编制:批准:质量记录控制清单编号:QR/WKN—424—01编制: 批准:质 量记 录 控 制 清 单编号:QR/WKN —424—01编制:批准:受控文件清单编号:QR/WKN ——423—01编制:审核:批准:日期:外来文献控制清单编号:QR /WKN——423—02 序号:文献发放/收回记录编号:QR/WKN—423—03 序号:001文件更改申请编号:QR/WKN——423—04 序号:文件销毁申请编号:QR/WKN——423—05 序号:管理评审计划编号:QR/WKN——560—01 序号:管理评审通知编号:QR/WKN——560—02 序号:管 理 评审 报 告记录编号:QR/WKN ——560—03 序号:管理评审评价表编号:QR/WKN 560—05评审员签名:评审日期:管理评审评价资料(之)编号:QR/WKN——560—06 资料顺序号:编制:审核:批准:年度培训筹划编号:QR/WKN——620—01培训记录表编号:QR/WKN—620—02 序号:员工培训需求申请单编号:QR/WKN—620—03设施验收单编号:QR/WKN——630—02 序号:设施寻常保养项目表编号:QR/WKN 630—03设施名称:设施编号:使用部门:保养人:月设施检修筹划编号:QR/WKN——630—04执行部门:序号:设施检修单编号:QR/WKN—630—05设施使用部门:序号:设施报废单编号:QR/WKN——630—06使用部门:序号:产品规定评审表编号:QR/WKN—720—01□初次评审□修订(原评审表号:)序号:定单确认表编号:QR/WKN—720—02 序号:顾客反馈解决登记表编号:QR/WKN—720—04 序号:时间:从年月—年月设计开发建议书编号:QR/WKN—730—01 序号:设计和开发筹划书编号:QR/WKN—730—02 序号:设计和开发任务书编号:QR/WKN—730—03 序号主管副总经理签名:年月日设计和开发方案编号:QR/WKN—730—04 序号设计开发验证记录编号:QR/WKN—730—05 序号:设计评审登记表编号:QR/WKN—730—06 序号:设计开发输出清单编号:QR/WKN—730—07 序号:设计实验报告编号:QR/WKN—730—09 序号:客户试用报告编号:QR/WKN—730—10 序号:新产品鉴定报告编号:QR/WKN—730—11 序号:设计和开发信息联系单编号:QR/WKN——730-12 序号:供方评估登记表编号:QR/WKN—740—01 序号:合格供方名单编号:QR/WKN—740—02 序号:供方业绩评价表编号:QR/WKN—740—03 序号:采购申请单编号:QR/WKN—740—04 序号:采购员:日期:主管领导批准:日期:生产计划单编号:QR/WKN—751—01 序号:编制:日期:审核:日期:批准:日期:测量监视设备履历卡编号:QR/WKN—760—02 序号:填表人:审核:批准:计量设备校准计划表编号:QR/WKN—760—03 序号:编制:审核:批准:时间:校准记录表编号:QR/WKN—760—04 序号:顾客满意度调查表编号:QR/WKN—821—02 序号:年度内审计划编号:QR/WKN—822—01 序号:审核实施计划编号:QR/WKN——822—02 序号:审核组组长:成员:年月日第页共页1、审核目:2、审核根据:GB/T 19001- idt ISO 9001:公司质量手册第一版及质量管理体系其她文献3、审核覆盖产品:4、审核时间:年月日到月日初次会议时间:年月日时分末次会议时间:年月日时分5、现场审核期间请被审核方关于人员参加下列活动:首、末次会议:最高管理者和代表及与审核关于管理人员参加。
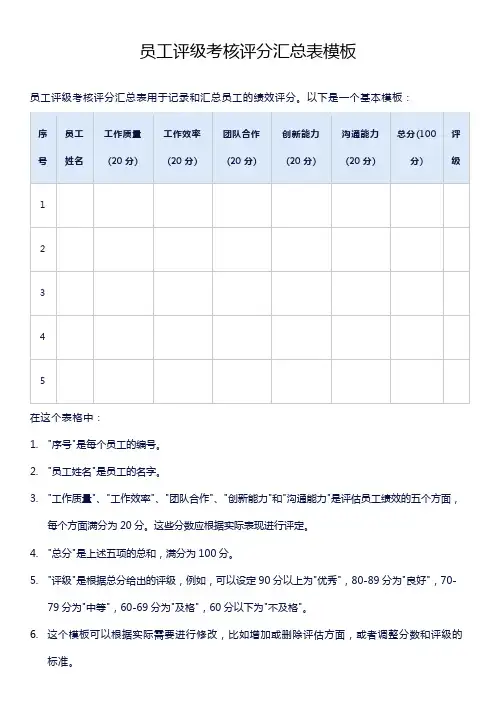
员工评级考核评分汇总表模板
员工评级考核评分汇总表用于记录和汇总员工的绩效评分。
以下是一个基本模板:
在这个表格中:
1."序号"是每个员工的编号。
2."员工姓名"是员工的名字。
3."工作质量"、"工作效率"、"团队合作"、"创新能力"和"沟通能力"是评估员工绩效的五个方面,
每个方面满分为20分。
这些分数应根据实际表现进行评定。
4."总分"是上述五项的总和,满分为100分。
5."评级"是根据总分给出的评级,例如,可以设定90分以上为"优秀",80-89分为"良好",70-
79分为"中等",60-69分为"及格",60分以下为"不及格"。
6.这个模板可以根据实际需要进行修改,比如增加或删除评估方面,或者调整分数和评级的
标准。
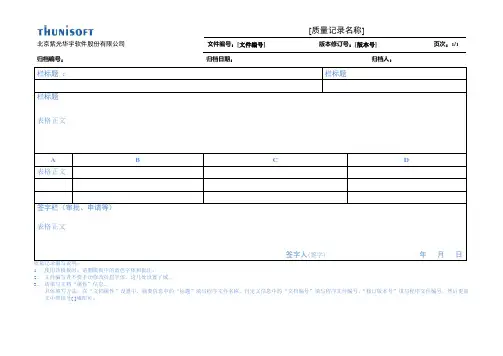
[质量记录名称]
北京紫光华宇软件股份有限公司文件编号:[文件编号] 版本修订号:[版本号] 页次:1/1
归档编号:归档日期:归档人:
栏标题:栏标题
栏标题
表格正文
A B C D
表格正文
签字栏(审批、申请等)
表格正文
签字人(签字)年月日
1、使用该模板时,请删模板中的蓝色字体和批注。
2、文件编写者不要手动修改页眉字体,这几处设置了域。
3、请填写文档“属性”信息。
具体填写方法:在“文档属性”设置中,摘要信息中的“标题”填写程序文件名称,自定义信息中的“文档编号”填写程序文件编号,“修订版本号”填写程序文件编号,然后更新文中带括号[ ]域即可。
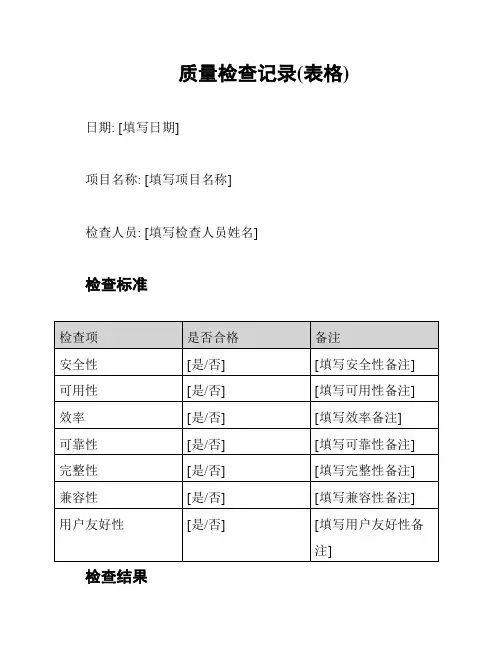
质量检查记录(表格)日期: [填写日期]
项目名称: [填写项目名称]
检查人员: [填写检查人员姓名]
检查标准
检查结果
安全性
检查结果: [填写安全性检查结果] 可用性
检查结果: [填写可用性检查结果] 效率
检查结果: [填写效率检查结果] 可靠性
检查结果: [填写可靠性检查结果] 完整性
检查结果: [填写完整性检查结果]
兼容性
检查结果: [填写兼容性检查结果]
用户友好性
检查结果: [填写用户友好性检查结果]
总结
检查人员总结: [填写检查人员的总结和建议] 签名
检查人员签名: [检查人员签名]
审核人员签名: [审核人员签名]。

文件编制申请批准表申请人(部门):
制度执行情况检查记录检查日期:年月日检查人:
供货方汇总表
供货方质量体系调查表
药品采购计划表
日期:年月日
供应商:计划制定:审核:批准:
购进、质量验收药品目录
页码
药品质量档案表
药品验收记录
药品储存、陈列环境检查记录
环境温湿度监测记录
近效期药品催销表
编号:填报日期:年月日报告人:
药品拆零销售记录
药品通用名称:商品名称:
中药方剂调配销售记录表
顾客意见征询表
尊敬的顾客:为提高本店药品经营质量管理水平和服务水平,请您提供宝贵意见和建议。
谢谢
药品质量问题查询表
药品质量问题投诉、质量事故调查处理报告
药品质量信息汇总分析表
药品销售分析
药品质量异常情况报告表
不合格药品确认、报告、报损、销毁表
编号:
药品购进退出、销后退回记录
药店员工花名册
企业年度培训计划表
企业设施设备一览表
设施、设备档案表。

质量追溯用表格
全钢子午胎( 二期) 硫化质量追溯记录
机台号: 规格: 品牌( 定牌) 模具号年月日Y-S-009
说明: 1.”备注”一栏对胎胚检查中存在的质量问题, 设备、动力波动等问题及处理加以说明。
2.传递: 硫化操作工→硫化班长→车间工艺技术员
全钢子午胎( 二期) 成型工序主鼓质量、追溯报表
班次/机台: 规格: 主手/记录人: 年月日Y-S-007
单位: 长度、宽度、定位mm, 压力MPa或kgf/cm2。
胎圈检查合格, 记录合格。
全钢子午胎( 二期) 成型工序辅鼓质量追溯报表
班次/机台: 规格: 辅手/记录人: 修胎: 年月日Y-S-
008
单位: 长度、宽度、定位mm, 压力MPa或kgf/cm2。
胎圈检查合格, 记录合格。
全钢子午胎( 二期) 半成品工序质量追溯记录
工序: 月日班次: 操作主手: Y-S-006。
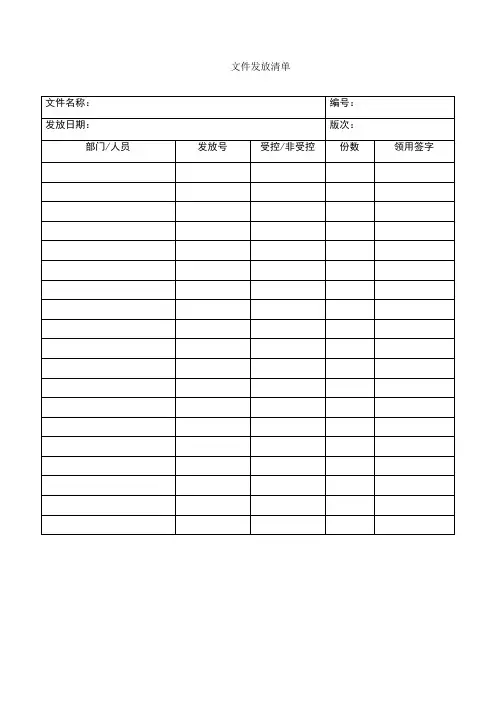
文件发放清单
受控文件清单
部门:第页共页
制表:审批:日期:
文件管理登记表
部门:第页共页
制表:审批:日期:
文件领用申请单
文件更改申请单
文件销毁/留用申请单
销毁文件登记表
文档目录
文件夹/袋名称:编号:
编制:日期:
文件借阅登记表
有效文件登记表
类别:体系文件
编制:批准:有效期:
质量记录清单
部门:第页共页
编制:审批:日期:
管理评审计划
管理评审通知
管理评审记录
管理评审会议签到表
管理评审报告
管理评审纠正/预防/改进措施记录单
年度公司培训计划
编制部门:负责人:编制日期:审批:第页共页
个人培训记录
姓名:编号:
培训考核记录表
特殊工作人员资格审查记录表
人力资源需求计划表
员工培训考核有效性评价
设施设备需求表
设施设备报废申请表
办公用品领用单物品名称:
设施设备记录
设备管理台帐
质量计划实施情况检查表
产品要求确认表
产品要求评审表
产品要求评审记录。
表 1 基础护理(危重患者)质量检查登记表注:1、七知道:一般资料(床号、姓名、性别、年龄、主管医师)、主要病情、观察重点、主要辅助检查的阳性结果、诊治及护理措施、饮食和营养状况、心理及健康指导要点。
2、出入院护理包括:入院介绍科主任、护士长、主管医师、责任护士、病房环境、住院相关制度;出院做好出院指导及床单位终末处理。
3、以患者为单位评价≥95 分为合格检查人:科室年月日表 2 、护理风险(跌倒、坠床)防范质量检查表科室:年月日注:以病区为单位评价,≥95 分为合格检查人:表 3 整体护理质量检查登记表科室年月日检查人:word 可编辑.表 4 消毒隔离检查登记表年月日科室注:细菌培养结果指化验室报告结果检查人:注:合格分大于或等于 95 分 检查人:word 可编辑 .表 5 病区管理质量检查登记表年月日科室科室年月日注:①以页为单位评价≥95 分为合格②凡无缺陷者只登体温单总页③本表一页不够者可续页检查人:科室年月日注:①以页数为单位评价≥95 分为合格② 一页不够可续页检查人:表7--2 其他护理文书质量检查登记表科室年月日每份≥95 分合格检查人:表9 急救物品检查登记表科室年月日检查人:注:1、气管切开包必备科室:神经内科、心外科、胸外科、耳鼻喉科、重症监护病房、神经外科2、急诊科必备:腹穿包、胸穿包、导尿包、深静脉穿刺包/留置针、清创缝合包、接生包、抢救包(内有开口器、舌钳、压舌板)、除颤仪、心电监护仪、洗胃栅、呼吸机(含气管插管全套物品)表10 各种登记本检查登记表科室年月日注:以科室为单位检查检查人:表11 执行护理核心制度登记表注:1、护理部检查以病区为单位综合评价2、科室检查以个人为单位检查人:表13 病区护士长工作考核登记表姓名:科室检查时间:年月日。
文件会稿单文件借(查)阅登记表文件销毁申请单文件收回销毁记录ABYY-ZR008-00 文件名称: 文号或编码:《药品经营质量管理规范》内部评审和公司质量管理体系审核计划ABYY-ZR011-00按照国家《药品经营质量管理规范》的要求以及公司制度规定,公司应组织人员对每年度的质量管理体系进行审核以及对《药品经营质量管理规范》在我公司的实施情况进行内部评审。
公司《质量管理制度》中的“质量管理体系审核制度”的7.2条具体规定:公司的质量管理体系审核应“每年进行一次,按照公司质量管理制度规定进行。
”同时还明确了,在进行质量管理体系审核时“同时实施《药品经营质量管理规范》的内部评审”。
200 年度体系审核和“GSP”评审计划安排如下:一.检查时间:二.检查人员:三.检查内容:1.质量管理体系运行状况;2. 《药品经营质量管理规范》实施情况;四.评审时间:五.评审地点:六.评审内容:1.质量体系运行情况;2.本公司经营方式和经营范围; *04013.组织机构与管理职责; 0501-07024.质量管理制度执行情况; *0801- *08025.人员与培训教育情况; 1001-17026. 健康体检 1601-16027.经营和仓储设施、设备运行状态; 1801-25018.进货质量管理; 2701-34019.入库验收质量管理;*3501-351310. 不合格药品管理; 4001-400511.药品保管与储存; 3601、*4101-411112.药品在库养护 3701、4201-420913.药品出库管理 4301-450114. 药品运输管理 4601-490215.药品销售和售后服务工作; 5001--570216.存在问题的整改及预防措施。
七.评审方式:会议评审。
八.评审部门:公司质量领导小组。
九.评审结果:报告形式。
四川省XXX医药有限公司质量管理部年月日《药品经营质量管理规范》实施情况内部评审公司质量管理体系年度审核审批表ABYY-ZR012-00编制时间:年月日四川省XXX医药有限公司质量管理体系评审记录表ABYY-ZR013-00不合格项通知书ABYY-ZR014-00 通知部门:编号:通知发出部门:GSP内部评审小组整改检查:质量管理部年月日整改实施报告ABYY-ZR015-00 GSP内部评审小组:编号:报告部门:经办人:质量信息传递、反馈表ABYY-ZR017-00建档日期:存档编号:ABYY-ZR018-00质量管理工作随笔四川省XXX医药有限公司四川省XXX医药有限公司质量管理工作随笔日期:事件:处理与结果:日期:事件:处理与结果:日期:事件:处理与结果:日期:事件:处理与结果:制度执行情况监督检查记录ABYY-ZR019-00制度执行情况监督检查记录整改通知单药品不合格报告、确认单四川省XXX医药有限公司药品不合格报告、确认单药品拒收通知单ABYY-ZR024-00四川省XXX医药有限公司药品拒收通知单药品质量复检通知单ABYY-ZR025-00。