第一章 氨基酸与多肽化学
- 格式:ppt
- 大小:4.71 MB
- 文档页数:67


第一章关注营养平衡第三节生命的基础----蛋白质(一)教学目标:1、了解氨基酸、蛋白质的结构和性质特点了解肽键及多肽;了解蛋白质的组成。
2、通过学生动手实验培养操作技能与观察能力,使之正确进行实验分析,从而加深对概念的理解,并抽象形成规律性认识。
3、培养学生的辩证唯物主义的观点。
4、通过学生实验,使学生的科学态度、思想情趣得到陶冶;通过钟南山院士事迹、结晶牛胰岛素的成功合成激发学生爱国主义思想感情,民族自豪感。
教学重点:氨基酸、蛋白质的结构和性质特点。
教学难点:氨基酸、蛋白质的性质。
教学过程:蛋白质广泛存在于生物体内,是组成细胞的基础物质。
动物的肌肉、皮肤、血液、乳汁以及发、毛、蹄、角等都是由蛋白质构成的。
蛋白质是构成人体的物质基础,蛋白质是生命的基础,没有蛋白质就没有生命。
今天我们来学习生命的基础----蛋白质。
第三节生命的基础----蛋白质含有丰富蛋白质的食品:资料卡片蛋白质是一类非常复杂的化合物,由碳、氢、氧、氮、硫等元素组成。
蛋白质的相对分子质量很大,从几万到几千万。
例如,烟草斑纹病毒的核蛋白的相对分子质量就超过了两千万。
因此,蛋白质属于天然有机高分子化合物。
我们学习蛋白质组成和结构。
一、蛋白质组成和结构蛋白质的复杂结构:1、氨基酸组成了蛋白质蛋白质在酸、碱或酶的作用下能发生水解,水解的最终产物是氨基酸。
下面是几种氨基酸的例子:氨基酸特点,写出氨基酸的通式。
氨基酸分子中既有氨基(-NH2),又有羧基(-COOH),因此它既能跟酸反应,又能跟碱反应,具有两性。
通式:有氨基(-NH2),又有羧基(-COOH),因此它既能跟酸反应,又能跟碱反应,具有两性。
现在从动植物体内蛋白质水解产物中分离出来的氨基酸有几百种。
但是,构成主要蛋白质的氨基酸只有20多种。
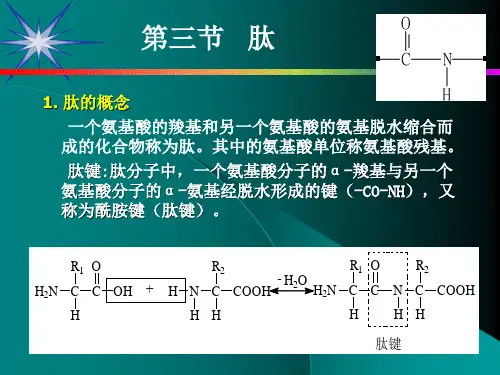
什么是两性物质,推测氨基酸的性质有那些?既与酸反应又与碱反应,还能互相反应(从结构上去分析)2、多肽肽: 一分子氨基酸中的羧基和另一分子氨基酸中的氨基之间脱去一个水分子, 经缩合反应而生成的产物.肽键: -CO-NH-请完成下列化学方程式,指出生成物是什么,并标出肽键。



第一节氨基酸与多肽一、氨基酸的结构与分类1.氨基酸是蛋白质的基本单位2.构成人体蛋白质的氨基酸是L-α-氨基酸3.L-α-氨基酸含有不对称碳原子,甘氨酸除外记忆小窍门:甘氨酸,即甜味氨基酸4.氨基酸的分类(1)酸性氨基酸:谷氨酸和天冬氨酸(2)碱性氨基酸:赖、精和组氨酸(3)极性中性氨基酸:丝、苏、谷氨酰胺、天冬酰胺、半胱氨酸(4)非极性疏水性氨基酸:甘、丙、缬、亮、异亮、脯氨酸(5)芳香族氨基酸:苯丙、色、酪二、肽键与肽链肽键:氨基酸的氨基和羧基形成的酰胺键(1)氨基和羧基形成(2)一定程度的双键性质(3)维系蛋白质一级结构的主要力量第二节蛋白质的结构一、一级结构1.一级结构是氨基酸的排列顺序2.肽键是维系一级结构的主要力量。
除此以外,还有二硫键(两个半胱氨酸之间形成二硫键)。
3.蛋白酶水解是使蛋白质的肽键被水解,变成氨基酸残基。
二、二级结构1.二级结构是多肽链主链的空间结构,不涉及侧链2.氢键是维系二级结构的主要力量。
3.代表性结构:α-螺旋,β-折叠,β-转角4.α-螺旋:右手螺旋、3.6个氨基酸一圈、螺距是0.54nm三、三级结构1.三级结构是多肽链所有原子的空间排布2.疏水键、盐键、二硫键、氢键和范德华力量是维系三级结构的主要力量。
四、四级结构1.具有四级结构的蛋白质是有两条或者以上的肽链构成2.每一条肽链都有自己的一、二、三级结构,这条肽链叫做亚基。
3.亚基可以相同,也可以不同4.亚基的立体排布和相互关系叫做四级结构5.由亚基构成的蛋白叫做寡聚蛋白6.独立的亚基没有生物学活性第三节蛋白质的结构和功能的关系一、一级结构与功能的关系1.一级结构是空间构象的基础2.一级结构是功能的基础3.一级结构并不是决定空间构象的唯一因素4.蛋白质的一级结构与分子病镰刀红细胞贫血:一个氨基酸(谷→缬)的差异二、高级结构与功能的关系2.血红蛋白的空间构象变化与结合氧O2与Hb结合后引起Hb构象变化,进而引起蛋白质分子功能改变的现象,称为别构效应。


第一篇蛋白质的结构与功能(第一~四章小结)第一章氨基酸氨基酸是一类同时含有氨基和羧基的有机小分子。
组成多肽和蛋白质的氨基酸除Gly外,都属于L型的α- 氨基酸(Pro为亚氨基酸)。
氨基酸不仅可以作为寡肽、多肽和蛋白质的组成单位或生物活性物质的前体,也可以作为神经递质或糖异生的前体,还能氧化分解产生ATP。
目前已发现蛋白质氨基酸有22种,其中20种最为常见,而硒半胱氨酸和吡咯赖氨酸比较罕见。
非蛋白质氨基酸通常以游离的形式存在,作为代谢的中间物和某些物质的前体,具有特殊的生理功能。
22种标准氨基酸可使用三字母或单字母缩写来表示。
某些标准氨基酸在细胞内会经历一些特殊的修饰成为非标准蛋白质氨基酸。
氨基酸有多种不同的分类方法:根据R基团的化学结构和在pH7时的带电状况,可分为脂肪族氨基酸、不带电荷的极性氨基酸、芳香族氨基酸、带正电荷的极性氨基酸和带负电荷的极性氨基酸;根据R基团对水分子的亲和性,可分为亲水氨基酸和疏水氨基酸;根据对动物的营养价值,可分为必需氨基酸和非必需氨基酸。
氨基酸的性质由其结构决定。
其共性有:缩合反应、手性(Gly除外)、两性解离、具有等电点,以及氨基酸氨基和羧基参与的化学反应,包括与亚硝酸的反应、与甲醛的反应、Sanger反应、与异硫氰酸苯酯的反应和与茚三酮的反应等。
与亚硝酸的反应可用于Van Slyke定氮,与甲醛的反应可用于甲醛滴定,Sanger反应和与异硫氰酸苯酯的反应可用来测定N-端氨基酸。
只有脯氨酸和羟脯氨酸与茚三酮反应产生黄色物质,其余生成蓝紫色物质,利用此反应可对氨基酸进行定性或定量分析。
多数氨基酸的侧链可能发生特殊的反应,可以此鉴定氨基酸。
不同氨基酸在物理、化学性质上的差异可用来分离氨基酸,其中最常见的方法是电泳和层析。
第二章蛋白质的结构肽是氨基酸之间以肽键相连的聚合物,它包括寡肽、多肽和蛋白质。
氨基酸是构成肽的基本单位。
线形肽链都含有N端和C端,书写一条肽链的序列总是从N端到C端。

生物有机化学Bioorganic Chemistry参考资料:1、古练权,马林,生物有机化学,高等教育出版社,19982、H. Dugas, Bioorganic Chemistry, 3rd Ed., Springer, 19953、刘育,尤长城,张衡益编著,超分子化学-合成受体的分子识别与组装,p385-400,南开大学出版社,20014、原始文献第一章绪论§1.1 生物分子与生物有机化学自然界中所有生物体的物质组成水生物分子金属离子(生物无机化学)蛋白质、核酸、糖、脂、维生素、激素等生物有机化学的研究对象、方法和结果生物分子和生物活性物质有机化学研究生物化学研究(结构测定,反应机制,(分离,提纯,生物功能化学合成,化学修饰)生物合成,基因研究)分子模型和实验室模拟研究设计合成新的生物分子与生物活性物质应用§1.2 生物大分子1、常见官能团2、基本结构单元3、立体结构的维系生物大分子中的重要官能团生物大分子中常见的其他基团2、基本结构单元一氨基一羧基酸一氨基二羧基酸、二氨基一羧基酸芳香及杂环氨基酸构成核酸的结构单元分子构成脂和糖的结构单元分子3、立体结构的维系共价键氢键配价键离子键疏水作用范德华作用力氢键及其典型的键长DNA碱基对中的氢键键酶的选择性结合(氢键)血红蛋白中的配价键酶中的离子键范德华力与距离的关系使蛋白质相互连接的作用(力)§1.3 生物体内发生的基本化学反应水解及缩合酯键,酰胺键,糖苷键的水解。
缩合是水解的逆反应如氧化和还原碳链增长反应DNA的烷基化及去烷基化磷酰化反应ATP(adenosine triphosphate),三磷酸腺苷分子重排反应异构化反应§1.4 生物有机化学的立体效应K 1/K 2=104一、邻基效应(proximity effect )二、潜手性中心与潜手性面的选择乙醛分子的潜手性面乙醛加氘生成手性醇的反应醇和辅酶NAD+作用NAD +(nicotinamideadenine dinucleotide ),即烟酰胺腺嘌呤二核苷酸N O氘代乙醇和辅酶NAD+的氧化还原反应YADH(yeast alcohol dehydrogenase)酵母乙醇脱氢酶还原三、生物分子的相互作用与超分子5‘●●●●●●●●●●●3’A T G C G T A T GT A C G C A T A C3’●●●●●●●●●●●5’DNA碱基对的识别。

第三节生命的基础——蛋白质氨基酸和多肽1.蛋白质的结构为什么这么复杂?提示:氨基酸是蛋白质的基本结构单元。
种类很多,组成蛋白质时种类、数量不同,排列的次序差异很大。
所以,蛋白质的结构很复杂。
►综合拓展一、氨基酸的化学性质氨基酸分子里含有羧基和氨基,羧基表现酸性,氨基表现碱性。
因此,氨基酸与酸或碱都能反应生成盐,具有两性。
1.与碱反应:2.与酸反应:3.脱水缩合反应:氨基酸分子中的氨基和羧基之间可以发生脱水缩合反应。
(1)两个氨基酸分子间脱去1分子水生成二肽,如:(2)两个氨基酸分子间脱去2分子水生成环状化合物,如:(3)多个氨基酸分子间缩合脱水(缩聚)生成多肽,如:蛋白质的性质2.什么是蛋白质互补?蛋白质互补遵循什么原则?提示:蛋白质互补就是两种或两种以上食物蛋白质混合食用,其中含有的必需氨基酸取长补短,相互补充,达到较好的比例,从而提高蛋白质的利用率。
其遵循的原则有:①食物的生物学种属越近越好;②搭配种类越多越好;③食用时间越近越好,同时食用最好。
►综合拓展二、盐析与变性的区别盐析变性加热、紫外线、X射线、强酸、强碱、重金属变化条件浓的无机轻金属盐盐以及甲醛、乙醇等部分有机化合物物理变化变化实质化学变化(蛋白质性质改变)(溶解度降低)变化过程可逆不可逆用途分离、提纯蛋白质杀菌、消毒1.下列关于蛋白质的叙述正确的是(B)A.加热会使蛋白质变性,因此生吃鸡蛋比熟吃好B.一束光线照射蛋白质溶液,产生丁达尔现象C.向鸡蛋清中加入食盐,会使蛋白质变性D.天然蛋白质中仅含C、H、O、N四种元素解析:蛋白质溶液是胶体,能产生丁达尔现象,B项正确;食盐不是重金属盐,不能使蛋白质变性,C项错误;蛋白质中含有碳、氢、氧、氮及少量的硫,有的还含有微量磷、铁、锌、钼等元素,D项错误。
2.波尔多液由CuSO4溶液和石灰乳混合而成,其防治病虫害的原因是(C)A.硫酸铜能使菌体蛋白质发生盐析而凝固B.石灰乳能使菌体蛋白质水解而推动生理活性C.铜离子在碱性条件下可使菌体蛋白质性质改变而发生聚沉D.蛋白质可以溶解在波尔多液中解析:波尔多液是硫酸铜和氢氧化钙的混合液。
第一章氨基酸一、名词解释1.氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物。
氨基连在α-碳上的为α-氨基酸。
组成蛋白质的氨基酸均为α-氨基酸。
出现在蛋白质中的氨基酸称为蛋白质氨基酸,又名标准氨基酸,目前发现22种,其中20种较常见。
2.蛋白质氨基酸(proteinogenic amino acid):出现在蛋白质分子中的氨基酸。
3.亲水氨基酸(hydrophilic amino acid):亲水氨基酸的R基团有极性,对水分子具有一定的亲和性,一般能和水形成氢键。
4.疏水氨基酸(hydrophobic amino acid):疏水氨基酸的R基团呈非极性,对水分子的亲和性不高或者很低,但对酯溶性物质的亲和性较高。
5.必需氨基酸(essential amino acid):必需氨基酸指的是人体自身(或其它脊椎动物)不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸。
它是人体(或其它脊椎动物)必不可少,而机体内又不能合成的,必须从食物中补充的氨基酸,称必需氨基酸。
必需氨基酸共有十种:Lys,Trp,Phe,Met,Thr,Ile,Leu,Val,Arg和His。
人体虽然能合成Arg和His,但合成的量在特定阶段不能满足正常需要。
因此这两种氨基酸又称为半必需氨基酸(semi-essential amino acid)。
6.非必需氨基酸(nonessential amino acid):人体自身(或其它脊椎动物)自身可以进行有效的合成,它们是:Ala,Asn,Asp,Gln,Glu,Ser,Cys,Tyr 和Gly。
7.非蛋白质氨基酸(Non-protein amino acid):不存在于蛋白质分子中而以游离状态和结合状态存在于生物体的各种组织和细胞的氨基酸。
第一章氨基酸(amino acid)的结构与性质第一节氨基酸的结构与分类一、氨基酸的结构组成蛋白质的基本单位是氨基酸。
如将天然的蛋白质完全水解,最后都可得到约二十种不同的氨基酸。
从氨基酸的结构通式可以看出:构成蛋白质的氨基酸均为L—α—氨基酸。
除R 为H(甘氨酸)外,其余氨基酸均具有旋光性。
*在空间各原子有两种排列方式:L—构型与D—构型,它们的关系就像左右手的关系,互为镜像关系,下图以丙氨酸为例:二、氨基酸的分类:1.按氨基酸分子中羧基与氨基的数目分:酸性氨基酸:一氨基二羧基氨基酸,有天冬氨酸、谷氨酸;碱性氨基酸:二氨基一羧基氨基酸,有赖氨酸、精氨酸、组氨酸;中性氨基酸:一氨基一羧基氨基酸,有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸。
2.按侧基R 基的结构特点分:脂肪族氨基酸芳香族氨基酸:苯丙氨酸、色氨酸、酪氨酸杂环氨基酸:脯氨酸、组氨酸3.按侧基R 基与水的关系分:非极性氨基酸:有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸;极性不带电氨基酸:天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸;极性带电氨基酸:天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸。
4. 按氨基酸是否能在人体内合成分:必需氨基酸:指人体内不能合成的氨基酸,必须从食物中摄取,有八种:赖氨酸、色氨酸、甲硫氨酸、笨丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苏氨酸。
非必需氨基酸:指人体内可以合成的氨基酸。
有十种。
半必需氨基酸:指人体内可以合成但合成量不能满足人体需要(特别是婴幼儿时期)的氨基酸,有两种:组氨酸、精氨酸。
三、稀有氨基酸:参加天然蛋白质分子组成的氨基酸,除了上述20 种有遗传密码的基本氨基酸之外,在少数蛋白质分子中还有一些不常见的氨基酸,称为稀有氨基酸。
它们都是在蛋白质分子合成之后,由相应的常见氨基酸分子经酶促化学修饰而成的衍生物。