2006年高考试题——化学(上海卷)
- 格式:doc
- 大小:2.13 MB
- 文档页数:27

离子共存高考试题1.(91全国化学,21)在某无色透明的酸性溶液中,能共存的离子组是A .NH 4+、NO 3-、Al 3+、Cl -B .Na +、Al 3+、K +、NO 3-C .MnO 4-、K +、SO 42-、Na +D .K +、SO 42-、HCO 3-、NO 3-2.(92全国化学,15)若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是A .SO 42-B .S 2-C .CO 32-D .Cl -3.(93全国化学,16)下列各组离子:(1)I —、ClO —、NO 3—、H +(2)K +、NH 4+、HCO 3—、OH —(3)SO 32—、SO 42—、Cl —、OH — (4)Fe 3+、Cu 2+、SO 42—、Cl — (5)H +、K +、AlO 2—、HSO 3—(6)Ca 2+、Na +、SO 42—、CO 32—在水溶液中能大量共存的是A .(1)和(6)B .(3)和(4)C .(2)和(5)D .(1)和(4) 4.(94全国化学,13)在PH=3的无色透明溶液中不能..大量共存的离子组 A .Al 3+ Ag + NO 3—Cl —B .Mg 2+ NH 4+ NO 3—Cl —C .Ba 2+ K + S 2— Cl —D .Zn 2+ Na + NO 3— SO 42—5.(95全国化学,11)在pH =1的溶液中,可以大量共存的离子组是A .Na +、K +、S 2-、Cl -B .Al 3+、Mg 2+、SO 42-、Cl -C .K +、Na +、AlO 2-、NO 3-D .K +、Na +、SO 42-、S 2O 32-6.(96全国化学,11)下列各组离子,在强碱性溶液中可以大量共存的是A .K +、Na +、HSO 3-、Cl -B .Na +、Ba 2+、AlO 2-、NO 3-C .NH 4+、K +、Cl -、NO 3-D .K +、Na +、ClO -、S 2-7.(06江苏,5)下列反应的离子方程式正确的是 BA .向沸水中滴加FeCl 3溶液制备Fe(OH)3胶体:Fe 3++3H 2O△Fe(OH)3↓+3H +B .用小苏打治疗胃酸过多:HCO 3-+H +===CO 2↑+H 2O C .实验室用浓盐酸与MnO 2反应制Cl 2:MnO 2+2H ++2Cl-△Cl 2↑+Mn 2++H 2OD .用FeCl 3溶液腐蚀印刷电路板:Fe 3++Cu===Fe 2++Cu 2+ 8.(96全国化学,18)某溶液中有NH 4+、Mg 2+、Fe 2+和Al 3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( ). A .NH 4+ B .Mg 2+ C .Fe 2+ D .Al 3+ 9.(97全国化学,9)下列各组离子,在强碱性溶液中可以大量共存的是A .I -、AlO 2-、Cl -、S 2-B .Na +、K +、NH 4+、Ba 2+C .Br -、S 2-、Cl -、CO 32-D .SO 32-、NO 3-、SO 42-、HCO 3-10.(99全国化学)下列各组离于在溶液中既可以大量共存,且加入氨水后也不产牛沉淀的是A .Na +、Ba 2+、Cl -、SO 42-B .K +、AlO 2-、NO 3-、OH -C .H +、NH 4+、Al 3+、SO 42-D .H +、Cl -、CH 3COO -、NO 3-11.(2004全国)在pH =l 含+2Ba 离子的溶液中,还能大量存在的离子是A .-2AlOB .-ClOC .-ClD .-24SO12、(2004年广东卷)下列反应完成后没有..沉淀的是 A 、BaCl 2溶液与Na 2CO 3溶液加足量稀CH 3COOHB 、Ba(OH)2溶液与KNO 3溶液加足量稀H 2SO 4C 、AgNO 3溶液与Na 2CO 3溶液加足量稀HClD 、Ca(OH)2溶液与FeCl 3溶液加足量稀HNO 3 13、(2004年江苏卷)巳知某溶液中存在较多的H +、SO 42—、NO 3—,则该溶液中还可能大量存在的离子组是A .Al 3+、CH 3C00—、Cl —B .Mg 2+、Ba 2+、Br —C .Mg 2+、Cl —、I —D .Na +、NH 4+、Cl —14.(2005年广东)下列各组离子一定能大量共存的是A .在含大量Fe 3+的溶液中:NH 4+、Na +、Cl —、SCN —B .在强碱溶液中:Na +、K +、AlO 2—、CO 32—C .在c (H +) =10—13mol/L 的溶液中:NH 4+、Al 3+、SO 42—、NO 3—D .在pH =1的溶液中:K +、Fe 2+、Cl —、NO 3— 15.(2005年江苏)某溶液既能溶解Al(OH)3,又能溶解H 2SiO 3,在该溶液中可以大量共存的离子组是A .K +、Na +、HCO -3、NO -3 B .Na +、SO -24、Cl —、ClO — C .H +、Mg 2+、SO -24、NO -3 D .Ag +、K +、NO -3、Na + 16、(2005年天津卷)下列各组离子在溶液中能大量共存的是A 酸性溶液Na +、K +、MnO 4-、Br -B 酸性溶液Fe 3+、NH 4+、SCN -、NO 3-C 碱性溶液Na +、K +、AlO 2-、SO 42-D 碱性溶液Ba 2+、Na +、CO 32-、Cl -17.下列各组离子在溶液中能大量共存的是 ( )A .酸性溶液Na +、K +、MnO 4-、Br -B .酸性溶液Fe 3+、NH 4+、SCN -、NO 3-C .碱性溶液Na +、K +、AlO 2-、SO -24 D .碱性溶液Ba 2+、Na +、CO -23、Cl - 18、(2006年江苏卷).一定能在下列溶液中大量共存的离子组是 A .含有大量Al 3+的溶液:Na +、NH 4+、SO 42-、Cl - D .含有大量NO 3-的溶液:H +、Fe 2+、SO 42-、Cl - C .含有大量Fe 3+的溶液:Na +、Mg 2+、NO 3-、SCN -B .c (H +)=1×10-13mol ·L -1的溶液:Na +、Ca 2+、SO 42-、CO 32- 19、(2006年上海卷)已知某溶液中存在较多的H +、SO 42-、NO 3-,则溶液中还可能大量存在的离子组是A A13+、CH 3COO -、C1-B Na +、NH 4+、C1-C Mg 2+、C1-、Fe 2+D Mg 2+、Ba 2+、Br -20.(2006年四川卷)室温下,在强酸性和强碱性溶液中都不能..大量共存的离子组是 A. NH 4+、Cu 2+、Cl 一、N03- B. K +、Na +、S032一、S 2—C. K +、Na +、A102-、S042-D. Ba 2+、Fe 2+、N03-、Br -21、(2007北京卷).在由水电离产生的H +浓度为1×10-13mol·L -1的溶液中,一定能大量共存的离子组是① K +、Cl -、NO 3-、S 2- ② K +、Fe 2+、I -、SO 42- ③ Na +、Cl -、NO 3-、SO 42- ④Na +、Ca 2+、Cl -、HCO 3- ⑤ K +、Ba 2+、Cl -、NO 3- A .①③ B .③⑤ C .③④ D .②⑤22. (2007年江苏向存在大量Na +、Cl -的溶液中通入足量的NH 3后,该溶液中还可能大量存在的离于组是A .K +、Br -、CO 32-B .Al 3+、H +、MnO 4-C .NH 4+、Fe 3+、SO 42-D .Ag +、Cu 2+、NO 3- 23.(2008年江苏)在下列溶液中,各组离子一定能够大量共存的是A .使酚酞试液变红的溶液: Na +、Cl -、SO 42-、Fe 3+B .使紫色石蕊试液变红的溶液:Fe 2+、Mg 2+、NO 3-、Cl -C . c (H +)=10-12 mol ·L -1的溶液:K +、Ba 2+、Cl -、Br -D .碳酸氢钠溶液:K +、SO 42-、Cl -、H + 24.(2008年广东卷理科基础)下列各组离子一定能大量共存的是A .在含有大量[Al(OH)3]-的溶液中:NH 4+、Na +、Cl -、H +B .在强碱溶液中:Na +、K +、CO 32-、NO 3-C .在pH =12的溶液中:NH 4+、Na +、SO 42-、Cl -D .在c(H +)=0.1mol ·L -1的溶液中:K +、I -、Cl -、NO 3-25、(2008年重庆)下列各组离子在给定条件下能大量共存的是A 、在pH =1溶液中:NH 4+、K +、ClO —、Cl —B 、有SO 42—存在的溶液中:Na +、Mg 2+、Ca 2+、I —C 、有NO 3—存在的强酸性溶液中:NH 4+、Ba 2+、Fe 2+、Br —D 、在c(H +) =1.0×10—13mol/L 的溶液中:Na +、S 2—、AlO 2—、SO 32— 26.(2008年全国I )在溶液中加入中量Na 2O 2后仍能大量共存的离子组是A.NH +4、Ba 2+、Cl -、NO -3B.K +、AlO -2、Cl -、SO 2-4C.Ca 2+、Mg 2+、NO -3、HCO -3D.Na +、Cl -、CO 2-3、SO 2-327、(2008年海南)在pH =13的无色溶液中,可以大量共存的一组离子是:A 、NH 4+、NO 3— 、K +、SO 42—B 、CO 32_、NO 3—、HCO 3—、Na + C 、Na +、ClO —、AlO 2—、NO 3— D 、CrO 42—、K +、Na +、SO 42—28.(02上海,19)下列离子方程式书写正确的是 BA .FeCl 2溶液中通入Cl 2:Fe 2++Cl 2===Fe 3++2Cl -B .澄清石灰水与少量小苏打溶液混合:Ca 2+十OH -+HCO 3-===CaCO 3↓+H 2OC .FeS 固体放人稀硝酸溶液中:FeS +2H +===Fe 2++H 2S ↑D .AlCl 3溶液中加入过量氨水:Al 3++4OH -===AlO 2-+2H 2O 29.(99全国,2)下列离子方程式书写正确的是 ABA .过量氯气通入溴化亚铁溶液中 3Cl 2+2Fe 2++4Br -===6Cl -+2Fe 3++2Br 2B .过量二氧化碳通入偏铝酸钠溶液中 CO 2+2H 2O+AlO -2===Al(OH)3↓+HCO -3C .在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合NH +4+HSO -3+2OH —===SO -23+NH 3↑+2H 2OD .碳酸氢镁溶液中加入过量石灰水 Mg 2++2HCO -3+Ca 2++2OH —===CaCO 3↓+2H 2O+MgCO 3↓30.(96上海,9)下列离子方程式书写正确的是 CA .氯化铁溶液中通入硫化氢气体:2Fe 3++S 2-=2Fe 2++S ↓B .碳酸钡中加入稀硫酸:BaCO 3+2H +=Ba 2++CO 2↑+H 2OC .偏铝酸钠溶液中加入过量盐酸:AlO 2-+4H +=Al 3++2H 2OD .碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO 3-+OH -=CO 32-+H 2O31.(01上海,12)下列离子在溶液中因发生氧化还原反应而不能大量共存的是 AA .H 3O +、NO 3-、Fe 2+、Na +B .Ag +、NO 3-、Cl -、K +C .K +、Ba 2+、OH -、SO 42-D .Cu 2+、NH 4+、Br -、OH -32.(00广东,16)某溶液中含有大量Fe 2+、Fe 3+、Mg 2+和NH 4+,其[H +]=10-2 mol·L -1,在该溶液中可以大量存在的阴离子是 AA.SO42-B.NO3-C.SCN-D.CO32-33、(2007全国卷II)27. (15分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:为鉴别它们,分别完成以下实验,其结果是:a.B和D都不溶于水,也不溶于酸;b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀d.E溶于水后,与上述某阴离子反应可生成B;e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀是减少,但不消失。

2006年普通高等学校招生全国统一考试理科综合能力测试(I)1、在常温常压下呈气态的化合物,降温使其固化得到的晶体属于A、分子晶体B、原子晶体C、离子晶体D、何种晶体无法判断2、下列叙述正确的是A 同一主族的元素,原子半径越大,其单质的熔点一定越高B 同一周期元素的原子,半径越小越容易失去电子C 同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高D 稀有气体元素的原子序数越大,其单质的沸点一定越高3、用N A代表阿伏加德罗常数,下列说法正确的是A 0.5mol Al与足量盐酸反应转移电子数为1N AB 标准状况下,11.2L SO3所含的分子数为0.5N AC 0.1mol CH4所含的电子数为1N AD 46g NO2和N2O4的混合物含有的分子数为1N A4、把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为A、1︰2︰3B、3︰2︰1C、6︰3︰1D、6︰3︰25、浓度均为0.1mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是A BaCl2 NaOH NaHCO3B Na2CO3 MgCl2 H2SO4C AlCl3 NH3·H2O NaOHD Ba(OH)2 CaCl2 Na2SO46、在0.1mol·L-1CH 3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是A 加入水时,平衡向逆反应方向移动B 加入少量NaOH固体,平衡向正反应方向移动C 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小D 加入小量CH6COONa.固体,平衡向正反应方向移动7、茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:关于茉莉醛的下列叙述错误的是A 在加热和催化剂作用下,能被氢气还原B 能被高锰酸钾酸性溶液氧化C 在一定条件下能与溴发生取代反应D 不能与氢溴酸发生加成反应8、由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为A、0.15mol·L-1B、0.2mol·L-1C、0.3mol·L-1D、0.4mol·L-19、X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。

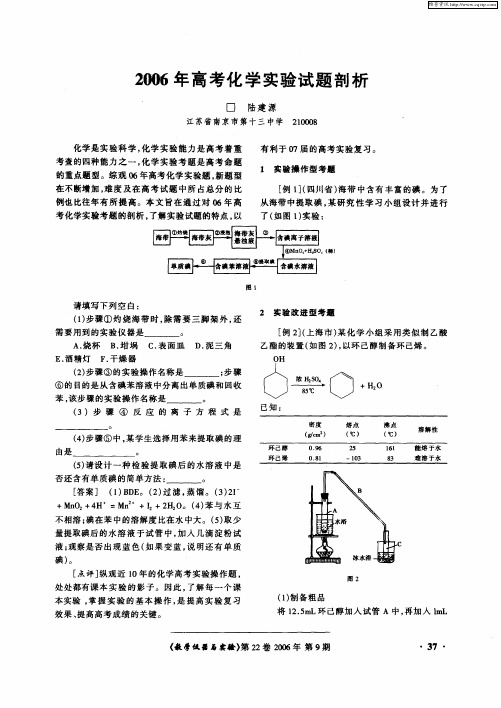

2006年普通高等学校招生全国统一考试(天津卷)化学试题一、选择题 ( 本大题共 7 题, 共计 42 分)7.下列说法正确的是A.用乙醇或CCl4可提取碘水中的碘单质B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同C.24Mg32S晶体中电子总数与中子总数之比为1∶1D.H2S和SiF4分子中各原子最外层都满足8电子结构8.引起下列环境污染的原因不正确的是A.重金属、农药和难分解有机物等会造成水体污染B.装饰材料中的甲醛、芳香烃及氡等会造成居室污染C.SO2、NO2或CO2都会导致酸雨的形成D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧9.下列说法正确的是A.ⅠA族元素的金属性比ⅡA族元素的金属性强B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强D.第三周期元素的离子半径从左到右逐渐减小10.下列关于电解质溶液的叙述正确的是A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Clˉ)>c(NH+4)>c(H+)=c(OHˉ)B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大11.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g)+W(s);ΔH>0下列叙述正确的是A.加入少量W,逆反应速率增大B.当容器中气体压强不变时,反应达到平衡C.升高温度,平衡逆向移动D.平衡后加入X,上述反应的ΔH增大12.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。
电池总反应为:4Al+3O2+6H2O==4Al(OH)3,下列说法不正确的是A.正极反应式为:O2+2H2O+4eˉ==4OHˉB.电池工作时,电流由铝电极沿导线流向铂电极C.以网状的铂为正极,可增大与氧气的接触面积D.该电池通常只需更换铝板就可继续使用13.已知反应:①101kPa时,2C(s)+O2(g)==2CO(g);ΔH=-221 kJ/mol②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol下列结论正确的是A.碳的燃烧热大于110.5 kJ/molB.①的反应热为221 kJ/molC.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/molD.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量二、非选择题 ( 本大题共 4 题, 共计 66 分)26.(14分)中学化学中几种常见物质的转化关系如下:将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。

全国⾼考(上海卷)化学试题及答案2012年全国普通⾼等学校招⽣统⼀考试上海化学试卷考⽣注意:1.本试卷满分l50分,考试时问120分钟·2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择题)或写(⾮选择题)在答题纸上;做在试卷上⼀律不得分。
3.答题前,考⽣务必在答题纸上⽤钢笔或圆珠笔清楚填写姓名、准考证号,并将核对后的条形码贴在指定位置上。
4.答题纸与试卷在试题编号上是⼀⼀对应的,答题时应特别注意,不能错位。
相对原⼦质量:H-1 C-12 N-14 O-16 Na-23 Si⼀28 Cl-35.5 K-39 Cu-64 Se-79⼀、选择题(本题共10分,每⼩题2分,每题只有⼀个正确选项)1.今年3⽉修订的《环境空⽓质量标准》中新纳⼊的强制监测指标是A.PM2.5 B.NOx C.SO2 D.可吸⼊颗粒物2.下列关于化⽯燃料的加⼯说法正确的是A.⽯油裂化主要得到⼄烯B.⽯油分馏是化学变化,可得到汽油、煤油C.煤⼲馏主要得到焦炭、煤焦油、粗氨⽔和焦炉⽓D.煤制煤⽓是物理变化,是⾼效、清洁地利⽤煤的重要途径3.氮氧化铝(AlON)属原⼦晶体,是⼀种超强透明材料,下列描述错误的是A.AlON和⽯英的化学键类型相同 B.AlON和⽯英晶体类型相同C.AlON和Al2O3的化学键类型不同D.AlON和Al2O3晶体类型相同4.PH3⼀种⽆⾊剧毒⽓体,其分⼦结构和NH3相似,但P-H键键能⽐N-H键键能低。
下列判断错误的是A.PH3分⼦呈三⾓锥形B.PH3分⼦是极性分⼦C.PH3沸点低于NH3沸点,因为P-H键键能低D.PH3分⼦稳定性低于NH3分⼦,因为N-H键键能⾼5.和氢硫酸反应不能产⽣沉淀的是A.Pb(NO3)2溶液 B.Na2S洛液 C.CuSO4溶液 D. H2SO4溶液⼆、选择题(本题共36分,每⼩题3分,每题只有⼀个正确选项)6.元素周期表中铋元素的数据见右图,下列说法正确的是A.Bi元素的质量数是209B.Bi元素的相对原⼦质量是209.0C.Bi原⼦6p亚层有⼀个未成对电⼦D.Bi原⼦最外层有5个能量相同的电⼦7.⽔中加⼊下列溶液对⽔的电离平衡不产⽣影响的是A.NaHSO4溶液 B.KF溶液 C.KAl(SO4)2溶液 D.NaI溶液8.过量的下列溶液与⽔杨酸()反应能得到化学式为C7H5O3Na的是A.NaHCO3溶液 B.Na2CO3溶液 C.NaOH溶液 D.NaCl溶液9.⼯业⽣产⽔煤⽓的反应为:C(s)+H2O(g)→CO(g)+H2(g)-131.4 kJ下列判断正确的是A.反应物能量总和⼤于⽣成物能量总和B.CO(g)+H2(g)→C(s)+H2O(g)+131.4kJC.⽔煤⽓反应中⽣成1 mol H2(g)吸收131.4 KJ热量D.⽔煤⽓反应中⽣成1体积CO(g)吸收131.4 KJ热量10.⽤滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏⾼的是A.试样中加⼊酚酞作指⽰剂,⽤标准酸液进⾏滴定B.滴定管⽤蒸馏⽔洗涤后,直接注⼊标准酸液进⾏滴定C.锥形瓶⽤蒸馏⽔洗涤后,壹接加⼊待测溶液进⾏滴定D.滴定管⽤蒸馏⽔洗涤后,直接注⼊待测液,取20.00 mL进⾏滴定ll.⼯业上将氨⽓和空⽓的混合⽓体通过铂⼀铑合⾦⽹发⽣氨氧化反应,若有标准状况下VL氨⽓完全反应。
2006年普通高等学校招生全国统一考试(上海卷)化学第I卷(共66分)相对原子质量:H:1 C:12 N:14 O:16 Mg:24 S:32 Cl:35.5 Fe:56一、选择题(本题共10分),每小题2分,只有一个正确选项,答案涂写在答题纸上。
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。
以下解决能源问题的方法不当的是A 用木材作燃料B 用液氢替代汽油C 开发风能D 开发地热2.以下化学用语正确的是A 乙烯的结构简式CH2CH2B 乙酸的分子式C2H4O2C 明矾的化学式KAlSO4·12H2OD 氯化钠的电子式Na3.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等它们互称为A 同系物B 同分异构体C 同素异形体D 同位素4.下列不符合当今化学研究方向的是A 发现新物质B 合成新材料C 研究化学反应的微观过程D 研究化学反应中原子守恒关系5.下列有机物命名正确的是A 2-乙基丙烷B CH3CH2CH2CH2OH 1-丁醇C CH3--CH3间二甲苯D 2-甲基-2-丙烯二、选择题(本题共36分),每小题3分,只有一个正确选项,答案涂写在答题纸上。
6.下列含有非极性键的共价化合物是A HClB Na2O2C C2H2D CH47.下列反应中生成物总能量高于反应物总能量的是A 碳酸钙受热分解B 乙醇燃烧C 铝粉与氧化铁粉末反应D 氧化钙溶于水8.某非金属单质A和氧气发生化合反应生成B。
B为气体,其体积是反应掉氧气体积的两倍(同温同压)。
以下对B分子组成的推测一定正确的A 有1个氧原子B 有2个氧原子C 有1个A原子D 有2个A原子9.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。
二甘醇的结构简式是HO-CH2CH2-O-CH2CH2-OH。
下列有关二甘醇的叙述正确的是A 不能发生消去反应B 能发生取代反应C 能溶于水,不溶于乙醇D 符合通式C n H2n O310.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是A A13+、CH3COO-、C1-B Na+、NH4+、C1-C Mg2+、C1-、Fe2+D Mg2+、Ba2+、Br-11.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。
2006年全国高中学生化学竞赛决赛理论试题2006年1月7日 上海竞赛时间4.5小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试题和答卷纸装入信封,放在桌面上,听到指令后方可撤离考场。
试卷和答卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定位置的方框内,答在试题纸上一律无效。
用黑色墨水笔或黑色圆珠笔答题。
不得携带任何其他纸张进入考场。
需要额外的答卷纸或草稿纸时可举手向监考老师索取。
在答卷纸页眉自填总页数和页码。
必须在试题首页左边和每页答卷纸左边指定位置填写营号及姓名,否则按废卷论。
允许使用非编程计算器以及直尺等文具。
不得携带铅笔盒、通讯工具入场。
第1题 (9分) 钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
钨在自然界主要以钨(VI)酸盐的形式存在。
有开采价值的钨矿石是白钨矿和黑钨矿。
白钨矿的主要成分是钨酸钙(CaWO 4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO 4。
黑钨矿传统冶炼工艺的第一阶段是碱熔法:黑钨矿NaOH, 空气 熔融(1)水浸A )浓盐酸(2)滤液沉淀B产品C其中A 、B 、C 都是钨的化合物。
1-1. 写出上述流程中A 、B 、C 的化学式,以及步骤⑴、⑵、⑶中发生反应的化学方程式。
1-2. 钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。
对钨的纯度要求不高时,可用碳作还原剂。
[1] 写出用碳还原氧化钨制取金属钨的化学方程式。
[2] 用下表所给的298.15K 的数据计算上述反应的标准自由能变化,推出该反应在什么温度条件下能自发进行。
(假设表中数据不随温度变化)物质 Δf H m (kJ ⋅mol −1)S m (J ⋅mol −1⋅K -1)W(s)WO 3(s) C(石墨) CO(g) CO 2(g) H 2(g) H 2O(g) H 2O(l)-842.870 -110.52 -393.51 0 -241.82 -285.31 32.64 75.90 5.74 197.56 213.64 130.57 188.72 69.901-3. 为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,为什么?写出用氢气还原氧化钨的化学方程式。
2006年普通高等学校招生全国统一考试(上海卷)化学本试卷分第工卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分l50分,考试时间l20分钟。
第l卷(选择题共666分)相对原子质量:H一1 C一12 N一140—16 M一24 S一32 C1一35.5 Fe--56一、选择题:本题共10分,每小题2分,只有一个正确选项。
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。
以下解决能源问题的方法不当的是 ( ).A.用木材作燃料 B.用液氢替代汽油C.开发风能 D.开发地热二、选择题:本题共36分,每小题3分,只有一个正确选项。
6。
下列含有非极性键的共价化合物是 ( )A.HCl B.Na202 C.C2 H2D.CH47.下列反应中生成物总能量高于反应物总能量的是 ( )A.碳酸钙受热分解 8.乙醇燃烧 C.铝粉与氧化铁粉末反应 D.氧化钙溶于水8.某非金属单质A和氧气发生化合反应生成B。
B为气体,其体积是反应掉氧气体积的两倍(同温同压)。
以下对8分子组成的推测一定正确的是 ( )A.有l个氧原子 B.有2个氧原子C.有l个A原子 D.有2个A原子15.在标准状况下,向100 mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为’ ( )A.0.5 mol/L B.0.05 mol/L.C.1 mol/L . D.0.1 mol/L16.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是 ( )A.反应速率:两者相同C.反应生成气体的颜色:前者浅,后者深D.反应中转移的电子总数:前者多,后者三、选择题:本题共20分,每小题4分;每小题有一个或两个正确选项。
只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分。
18.右图是气体制取装置,下列能用此装置制取气体并能“随.开随用、A.大理石和稀硫酸制取二氧化碳B.锌粒和稀硫酸制氢气C.浓盐酸和二氧化锰制取氯气D.由石和水制取乙狯20.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是 ( ) A.0.1 mol/I.,的盐酸和0.1 mol/I。
2006年全国普通高等学校招生统一考试上海 化学试卷本试卷分为第I 卷(第1—4页)和第II 卷(第5—12页)两部分。
全卷共12页。
满分150分,考试时间120分钟。
第I 卷 (共66分)考生注意:1.答第I 卷前,考生务必在答题卡上用钢笔或圆珠笔清楚填写姓名、准考证号、校验码,并用铅笔正确涂写准考证号和校验码。
2.第I 卷(1—22小题),由机器阅卷,答案必须全部涂写在答题纸上。
考生应将代表正确答案的小方格用铅笔涂黑。
注意试题题号和答题纸编号一一对应,不能错位。
答案需要更改时,必须将原选项用橡皮擦去,重新选择。
答案不能写在试卷上,写在试卷上一律不给分。
3.第II 卷第23题和第26题为分叉题,各分为A 、B 两题,A 题适合使用二期课改新教材考生解答,B 题适合使用一期课改教材考生解答。
但考生可任选一题。
若两题均做,一律按A 题计分。
相对原于质量: H —1 C —12 N —14 0—16 Mg —24 S .32 C1—35.5 Fe —56一.选择题(本题共10分),每小题2分,只有一个正确选项,答案涂写在答题纸上。
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。
以下解决能源问题的方法不当的是A .用木材作燃料B 。
用液氢替代汽油C .开发风能D .开发地热2.以下化学用语正确的是A .乙烯的结构简式CH 2CH 2B .乙酸的分子式C 2H 4O 2C .明矾的化学式KAlSO 4·12H 2OD .氯化钠的电子式Na3.科学家发现C 60后,近年又合成了许多球形分子(富勒烯),如C 50、C 70、C 120、C 540等它们互称为A .同系物B .同分异构体C .同素异形体D .同位素4.下列不符合当今化学研究方向的是A .发现新物质B .合成新材料C .研究化学反应的微观过程D .研究化学反应中原子守恒关系5.下列有机物命名正确的是A 、2-乙基丙烷 B.CH 3CH 2CH 2CH 2OH 1-丁醇C 、间二甲苯 · Cl ·· ·· · · · CH 3CH 3CH3-CH -CH 3 CH 2 CH 3D . 2—甲基—2—丙烯二、选择题(本题36分)每小题3分、只有一个正确选项,答案涂写在答题纸上。
2006年高考试题——化学(上海卷)2006年普通高等学校招生全国统一考试(上海卷)化学第I卷(共66分)相对原子质量:H:1 C:12 N:14 O:16 Mg:24 S:32 Cl:35.5 Fe:56一、选择题(本题共10分),每小题2分,只有一个正确选项,答案涂写在答题纸上。
i.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。
以下解决能源问题的方法不当的是A 用木材作燃料B 用液氢替代汽油C 开发风能D 开发地热ii.以下化学用语正确的是A 乙烯的结构简式CH2CH2B 乙酸的分子式C2H4O2C 明矾的化学式KAlSO4·12H2OD 氯化钠的电子式Naiii.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等它们互称为A 同系物B 同分异构体C 同素异形体D 同位素iv.某非金属单质A和氧气发生化合反应生成B。
B为气体,其体积是反应掉氧气体积的两倍(同温同压)。
以下对B分子组成的推测一定正确的A 有1个氧原子B 有2个氧原子C 有1个A原子D 有2个A原子v.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。
二甘醇的结构简式是HO-CH2CH2-O-CH2CH2-OH。
下列有关二甘醇的叙述正确的是A 不能发生消去反应B 能发生取代反应C 能溶于水,不溶于乙醇D 符合通式C n H2n O3vi.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是A A13+、CH3COO-、C1-B Na+、NH4+、C1-C Mg2+、C1-、Fe2+D Mg2+、Ba2+、Br-vii.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。
玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是①②③④A 黄绿色橙色蓝色白色B 无色橙色紫色白色C 黄绿色橙色蓝色无色D 黄绿色无色紫色白色viii.N A代表阿伏加德罗常数,下列说法正确的是A 9g D2O中含有的电子数为5N AB 1molMgCl2中含有的离子数为2N AC 1molCH4分子中共价键总数为4N AD 7.1g C12与足量NaOH溶液反应转移的电子数为0.2N Aix.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是A 两烧杯中铜片表面均无气泡产生B 甲中铜片是正极,乙中铜片是负极C 两烧杯中溶液的pH均增大D 产生气泡的速度甲比乙慢x.下列物质能通过化合反应直接制得的是①FeCl2②H2SO4③NH4NO3④HClA 只有①②③B 只有②③C 只有①③④D 全部xi.在标准状况下,向100mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为A 0.5mol/LB 0.05mol/LC 1mol/LD 0.1mol/Lxii.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是A 反应速率:两者相同B 消耗硝酸的物质的量:前者多,后者少C 反应生成气体的颜色:前者浅,后者深D 反应中转移的电子总数:前者多,后者少xiii.根据相关化学原理,下列判断正确的是A 若X是原子晶体,Y是分子晶体,则熔点:X<YB 若A2+2D-→2A-+D2,则氧化性:D2>A2C 若R2-和M+的电子层结构相同,则原子序数:R>MD 若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB三、选择题(本题共20分),每小题4分,每小题有一个或两个正确选项。
只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分,答案涂写在答题纸上。
xiv.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是A 大理石和稀硫酸制取二氧化碳B 锌粒和稀硫酸制氢气C 浓盐酸和二氧化锰制取氯气D 电石和水制取乙炔xv.下列离子方程式中正确的是A H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H+十SO42-→BaSO4↓+2H2OB Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-→CaCO3↓+CO32-+2H2OC Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O→2HCO3-D CH3COOH溶液与NaOH溶液反应:H ++OH-→H2Oxvi.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液B 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液C pH=4的醋酸溶液和pH=10的氢氧化钠溶液D pH=4的盐酸和pH=l0的氨水xvii.为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是A 一定有SO32-离子B 一定有CO32-离子C 不能确定Cl-离子是否存在D 不能确定HCO3-离子是否存在xviii.已知Ba(AlO 2)2可溶于水。
右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。
下列有关叙述正确的是A a-b时沉淀的物质的量:A1(OH)3比BaSO4多B c-d时溶液中离子的物质的量:AlO2-比Ba2+多C a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3D d-e时溶液中离子的物质的量:Ba2+可能等于OH-第II卷(共84分)四、(本题共24分)考生注意:23题为分叉题,分A、B两题,考生可任选一题。
若两题均做,一律按A题计分。
A 题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
xix.(A)(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________甲、乙的最高价氧化物水化物的酸性强弱为:________>________(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:_________________________________________ _________________________________23.(B)下表中的实线表示元素周期表的部分边界。
①~⑤分别表示元素周期表中对应位置的元素。
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多_______个。
元素③氢化物的电子式为_______。
(3)元素④—般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
A 元素①的单质B 元素②的单质C 元素①②形成的合金D 无法判断xx.(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+________→________+________+________+H2O(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1mol氧化剂_______(填“得到”或“失去”)________mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:__________ +__________ →xxi.(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______________,K值大小与温度的关系是:温度升高,K值______________。
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g)+Q(Q>0)CO和H2O浓度变化如右图,则0~4min的平均反应速率v(CO)=______mol/(L·min)(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
①表中3min~4min之间反应处于_________状态;C1数值________0.08mol/L(填大于、小于或等于)。
②反应在4min~5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是________(单选)。
A 增加水蒸气B 降低温度C 使用催化剂D 增加氢气浓度五、(本题共24分)考生注意:26题为分叉题,分A、B两题,考生可任选一题。
若两题均做,一律按A题计分。
A 题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
xxii.(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。
倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C 装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)由上述实验事实可知:(1)①固体M中一定有的物质是______________(填化学式);理由是_________________________________________ _____________________________。
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是_______。
写出B装置中反应的离子方程式__________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_________________________________________ ______________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。