2019-2020年九年级化学上册 第四单元课题1、3 原子和离子练习 人教新课标版
- 格式:doc
- 大小:1.02 MB
- 文档页数:14

第四单元课题1《原子的构成》同步练习1.绝大多数原子的原子核中含有(A)A.质子、中子、电子 B.质子、电子C.中子、电子 D.质子、中子2.下列说法正确的是( D )A. 原子不能再分B. 原子核是由质子和电子构成C.相对原子质量就是实际原子质量的简称 D. 原子可以构成分子,也可以构成物质3.下列关于分子和原子的说法不正确...的是( A )A.分子在化学反应前后种类和数目保持不变B.分子在不停地运动C.原子可以直接构成物质D.原子是化学变化中的最小粒子4.下列说法正确的是(C)A.净化后的空气是纯净物 B.氧气的质量占空气质量的21%C.空气是几种单质和几种化合物组成的混合物D.空气是几种元素组成的混合物5.有两种不同的铀原子,一种原子核内有92个质子和143个中子,另一种原子核内有92个质子和146个中子,则它们不相等的是( A)A.原子的质量B.核电荷数C.核内质子数D.核外电子数6.小红同学在化学学习过程中,总结了以下“规律”,你认为不科学的是( D )A、原子是由原子核和核外电子构成的B、原子核是由质子和中子构成的C、原子中的质子数与电子数是相等的D、原子中的质子数与中子数总是相等的7.锂电池可做心脏起搏器的电源。
已知锂原子核内含有3个质子和4个中子,则该锂原子的核外电子数为(B)A、1B、3C、4D、78.美国铱星公司(已破产)原计划发射77颗卫星,以实现全球卫星通讯,其原本准备发射的卫星数目恰好与铱原子的原子核外电子数目相等,下列关于铱原子的各种说法中正确的是(A)A.铱原子的核电荷数为77B.铱原子的相对原子质量为77C.铱原子的中子数为77D.卫星通讯需要依靠铱原子9.1999年度诺贝尔化学奖获得者艾哈迈德·泽维尔(AhmedHzewail)开创了化学研究新领域,他使运用激光光谱技术观测化学反应时分子中原子运动成为可能。
你认为该技术不能观察到的是(A)。
A.原子中原子核的内部结构B.化学反应中原子的运动C.化学变化中生成物分子的形成D.化学反应中反应物分子的分解10.下列有关原子的说法中正确的是(B)A.原子都是由质子、中子和核外电子构成的B.原子的类别是由原子核内的质子数所决定的C.原子中不存在带电微粒,因而整个原子不显电性D.原子的质量主要集中在质子和电子上11.一个碳原子的质量是1.993×10-26 Kg,碳的相对原子质量为(C)A. 12 gB. 1/12C.12D.1.993×10-26 Kg/1212、据中央电视台2001年6月3日对云南抚仙湖湖底古城考古的现场报道,科学家曾通过对古生物遗骸中的碳-14含量来推断古城的年代。
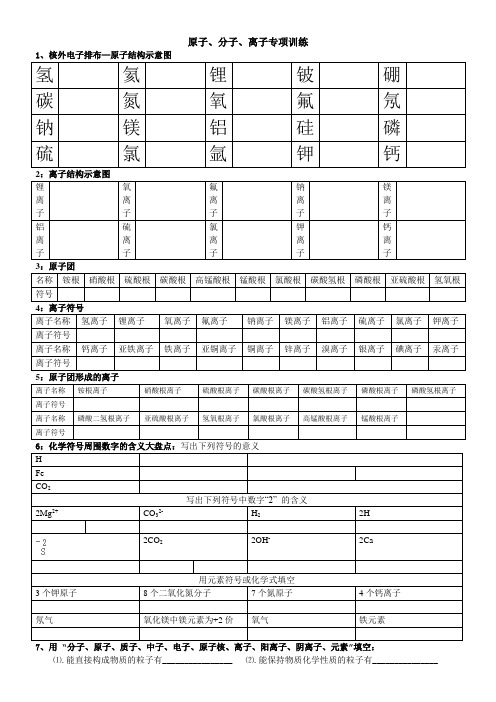
原子、分子、离子专项训练
1、核外电子排布—原子结构示意图
氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙2:离子结构示意图
锂离子氧
离
子
氟
离
子
钠
离
子
镁
离
子
铝离子硫
离
子
氯
离
子
钾
离
子
钙
离
子
3:原子团
名称铵根硝酸根硫酸根碳酸根高锰酸根锰酸根氯酸根碳酸氢根磷酸根亚硫酸根氢氧根符号
4:离子符号
离子名称氢离子锂离子氧离子氟离子钠离子镁离子铝离子硫离子氯离子钾离子离子符号
离子名称钙离子亚铁离子铁离子亚铜离子铜离子锌离子溴离子银离子碘离子汞离子离子符号
5:原子团形成的离子
离子名称铵根离子硝酸根离子硫酸根离子碳酸根离子碳酸氢根离子磷酸根离子磷酸氢根离子离子符号
离子名称磷酸二氢根离子亚硫酸根离子氢氧根离子氯酸根离子高锰酸根离子锰酸根离子
离子符号
6:化学符号周围数字的含义大盘点:写出下列符号的意义
H
Fe
CO2
写出下列符号中数字“2” 的含义
2Mg2+CO32-H22H
2CO22OH-2Ca
用元素符号或化学式填空
3个钾原子8个二氧化氮分子7个氮原子4个钙离子
氖气氧化镁中镁元素为+2价氧气铁元素
7、用“分子、原子、质子、中子、电子、原子核、离子、阳离子、阴离子、元素”填空:
⑴.能直接构成物质的粒子有________________ ⑵.能保持物质化学性质的粒子有_______________。

“分子和原子”阶梯训练基础达标1.三月油菜花黄,桃李芳香,你能闻到香味是因为()A.分子之间有间隙B.分子不断运动C.分子质量小D.分子在化学变化中可分2.水结成冰后,下列说法正确的是()A.水分子的质量不变B.水分子间的间隔不变C.水分子不再运动D.水分子不再保持其化学性质3.将空的矿泉水瓶从高原地区带到平原,瓶子变瘪,原因是瓶内气体()A.分子体积变小B.分子质量变小C.分子间隔变小D.分子数目减少4.建立宏观和微观之间的联系是一种科学的思维方式。
下列对宏观事实的解释不正确的是()A.气体可压缩储存于钢瓶中——分子间有间隙B.物体的热胀冷缩——分子的大小是可以变化的C.在阳光下,湿衣服容易晾干——分子的运动速率随温度升髙而加快D.1滴水中大约有1.67×1021个水分子——分子很小5.能证明分子在化学变化中可以再分的事实是()A.水结冰B.水蒸发C.冰融化D.水通电6.下列关于构成物质的微粒的叙述正确的是()A.世界是由物质组成的,物质是由微粒构成的B.构成物质的微粒是能用肉眼见到的C.构成物质的微粒之间的空隙是相同D.构成物质的微粒有的是在不断地运动的,有的是不能运动的7.一氧化碳和二氧化碳的化学性质不同的主要原因是()A.分子的构成不同B.密度不同C.生成它们的反应条件不同D.用途不同8.将下面左右两边相关的内容用短线连接起来.A.化学变化中的最小粒子B.构成分子的粒子(1)分子 C.保持物质化学性质的最小粒子D.化学反应中可以再分的粒子(2)原子 E.构成物质的一种粒子F.不断地运动着的粒子G.一种很小的粒子.9.生活就是一本化学教科书,只要你留心观察,用心思考,便可发现化学无处不在,探究其乐无穷。
物质是由微观粒子构成的,请用你学过的分子知识解释下列现象。
⑴仔细观察如图实验,回答下列问题:水与酒精混合后,总体积 10 mL(填“大于”、“等于”、“小于”)。
该实验说明。
⑵水蒸发过程中,变化的是微粒之间的,水通电过程中,没有变化的微粒是,分子和原子的主要区别是:在化学反应中发生变化,不发生变化,只是重新组合成新的。

第四单元 课题1 原子的构成课下作业1.1999年度诺贝尔化学奖获得者艾哈迈德·泽维尔(AhmedHzewail )开创了化学研究新领域,他使运用激光光谱技术观测化学反应时分子中原子运动成为可能。
你认为该技术不能观察到的是( )。
A.原子中原子核的内部结构B.化学反应中原子的运动C.化学变化中生成物分子的形成D.化学反应中反应物分子的分解2.反质子、正电子都属于反粒子,它们分别与质子、电子的质量、电量相等,但电性相反。
欧洲的科研机构曾宣称已制造出了反氢原子,那么,根据你的理解,下列关于反氢原子的结构叙述正确的是( )A.由一个带正电的质子和一个带负电的电子构成B.由一个带负电的质子和一个带正电的电子构成C.由一个带负电的质子和一个带负电的电子构成D.由一个带负电的质子和两个带负电的电子构成3.(2008年安徽肇庆)某原子结构示意图和在周期表中的信息如右图。
则该元素的质子数为 ,元素的相对原子质量为 ,它在化合物中的化合价为 。
4.(2008年重庆)下列叙述中不正确的是( )A 、钠原子失去电子后变成钠离子B 、氯离子失去电子后变成氯原子C 、原子的质量主要集中在原子核上D 、化学变化中分子不能再分5.已知磷的相对原子质量为31,原子核内有15个质子,则磷原子的核内有 个中子,核外有 个电子。
解析:原子的质量主要集中在原子核上,而原子核又是由质子和中子构成的,在原子中,相对原子质量=质子数+中子数,因此磷原子内中子数为31-15=16.又由于原子不显电性,电子数=质子数,所以磷原子核外有15个电子。
6.人类对原子结构的认识是逐渐深入的。
下图所示是不同时期科学家提出的原子结构模型。
1808年,英国科学家道尔顿提出了原子论。
他认为物质都是由原子直接构成的;原子是一个实心球体,不可再分割;同一类原子性质相同;不同的原子是以简单的整数比相结合。
1897年,英国科学家汤姆生发现原子中存在电子。
1904年汤姆生提出了一个被称为“西瓜式”结构的原子结构模型,电子就像“西瓜子”一样镶嵌在带正电的“西瓜瓤”中。

课题1 原子的构成(第一、二板块你应尽力完成,第三板块则由你决定取舍)第一板块 本课题你学到多少基础知识?不妨检测一下。
1.下列关于原子的叙述,错误的是( )A.原子是化学变化中最小的粒子B.原子是构成物质的一种粒子C.原子一定由质子、中子和电子构成D.原子的质量主要集中在原子核上2.原子显电中性的原因是( )A.构成原子的各种粒子均不带电B.原子核外电子数大于核内质子数C.核内质子数等于中子数D.原子核所带电量和核外电子的电量相等,但电性相反3.铁的相对原子质量为56,表示的意义是( )A.表示铁原子的相对原子质量为56gB.表示一个铁原子的质量为56gC.表示铁原子的原子核内有56个质子D.表示一个铁原子质量是一个碳原子质量的1/12的56倍。
4. 在原子中,不带电荷的粒子是( )A.质子B.中子C.电子D.原子核5.下列物质不是由原子直接构成的是( )A.氧气B.氩气C.黄金D.硫磺6.⑴已知在原子中“相对原子质量≈质子数 + 中子数”。
请填写下面表格原子种类 质子数 中子数 核外电子数 相对原子质量 氢(H ) 1 0 1氧(O ) 8 8钠(Na ) 11 23⑵根据上表的信息,计算一个水分子所含总质子数为 。
7. 某些花岗石材中含有对人体有害的放射性元素——氡,氡原子质子数为86,中子数为136,这种氡原子核外电子数为 ,核电荷数为 ,相对原子质量为 。
已知一个碳-12原子的质量为 1.993×10-27kg ,则氡原子的质量为 。
第二板块 你能把所学的知识用来解决下面的问题吗?祝你成功!8.1993年8月,我国科学家利用超高真空扫描隧道显微镜,在一块晶体硅(Si )的表面上通过探针的作用搬走原子,写下了“中国”两个字。
下列说法中不正确的是( )A .上述操作中发生了化学变化 B.上述操作发生了物理变化C.这两个汉字是目前世界上最小的汉字D.这标志着我国科学家进入操纵原子的阶段9.化学上称“原子是化学变化中的最小粒子”的根据是( )A.原子质量小B.原子是构成物质的最小粒子C.原子体积小D.原子在化学变化前后的种类、数目第四单元 物质构成的奥秘电子不变10.下列各种原子的质量各1g,所含原子个数最多的是()A.氧原子B.铁原子C.氢原子D.碳原子11.在分子、原子、质子、中子、电子、原子核这些粒子中:(1)能直接构成物质的粒子有;(2)能保持物质的化学性质的有;(3)显示电中性的粒子有;(4)带正电荷的有;(5)带负电荷的有;(6)质量最小的粒子是;(7)参加化学反应时,一定发生变化的是;(8)在同一原子里数目相等的是;(9)质量与原子质量相近的是;(10)原子中可以不含。

课题3 离子(第一、二板块你应尽力完成,第三板块则由你决定取舍)第一板块本课题你学到多少基础知识?不妨检测一下。
1.下列离子符号书写正确是()A.铁离子Fe2+B.镁离子Mg+2C.硫酸根离子SO42-D.钾离子K1+2. 近年用红外线技术研究液氢,发现液氢中含有H3+ 。
H3+属于()A.单质B.分子C.原子D.离子3.下列粒子的结构示意图,哪个能表示原子,且该粒子又处于稳定结构()A. B. C. D.4.与元素的化学性质有密切关系的是()A.原子的质子数B.原子的中子数C.原子的核电荷数D.原子最外层电子数5.下面的说法错误的是()A.稀有气体元素的原子都处于稳定结构,不易发生化学反应,故它们的化学性质比较稳定。
B.处于稳定结构的粒子,一定是稀有气体元素的原子。
C.原子核外的电子是分层排布的。
D.金属元素原子在反应易失去最外层电子,而非金属元素的原子的最外层则易夺取电子。
6. 据《自然》杂志报道,科学家最近研制一种以锶原子做钟摆的钟是世界上最精确的钟。
锶元素(元素符号为Sr )原子结构示意图如右图所示。
锶元素属于(填“金属”或“非金属”)元素,锶原子的核内质子数,为,核外有个电子层,锶离子的符号为。
7. *R元素的粒子结构示意图如右图所示:(1)a表示,b表示。
(2)当b=8时,且该粒子为不带电粒子,则a = 。
(3)当b=8时,且该粒子带有两个单位负电荷,则该粒子化学符号是。
8.记忆五个常见的多核离子(即含有多个原子核的离子)的符号。
离子名称硫酸根离子硝酸根离子碳酸根离子氢氧根离子铵根离子离子符号CO32-OH-第二板块你能把所学的知识用来解决下面的问题吗?祝你成功!9.科学家已研究出高能粒子N5+,关于它的说法正确()A. N5+是5个氮原子构成的单质B. N5+中只有质子,没有中子和电子C.每个N5+中含有35个质子和34个电子D. 每个N5+中含有35个质子和35个电子10.下列结构示意图中能用符号R2+表示的是(R代表某种元素符号)()A. B. C. D.11.构建知识网络是一种重要的学习方法。
第4单元自然界的水(45分钟100分)有关相对原子质量:H-1 C-12 N-14 O-16一、选择题(本大题包括10小题,每小题3分,共30分)1.按环保要求:凡是有颜色、异味的工业废水都禁止排放。
净化此类废水可采用的方法是( )A.沉淀B.过滤C.吸附D.静置2.由电解水的有关实验可得到的结论是( )①水由氢、氧两种元素组成②水中有氢气和氧气③电解1体积的水可以得到2体积的氢气和1体积的氧气④化学反应里分子可以再分成原子,而原子不能再分A.①②B.③④C.②③D.①④3.(2012·牡丹江中考)水对人类和社会经济可持续发展起着重要作用,下列做法属于爱护水资源的是( )A.使用含磷洗衣粉B.工业废水未达标排放C.用淘米水洗菜、浇花D.农业和园林灌溉采用大水浸灌4.下列关于淡水资源的认识错误的是( )A.我国淡水资源非常丰富,干旱对我国无影响B.地球上的水资源丰富,但可供利用的淡水资源有限C.为了人类的生存和发展,人人都应爱惜淡水资源D.水体污染,破坏了水体生态系统,还会危害人体健康5.下列物质中属于氧化物的是( )A.①B.②C.③D.④6.(2012·湖州中考)“毒胶囊”成为社会焦点,铬严重超标,其中含有的铬酸钠(Na2Cr2O7)中铬元素的化合价为( )A.+3B.+4C.+5D.+67.(2012·济宁中考)对下列符号意义的表述,正确的是( )A.N2两个氮原子B.2H 两个氢元素C.2H2O 两个水分子D.Ca2+钙元素的化合价为+2价8.我国2011年发射的“天宫一号”目标飞行器和“神舟八号”飞船,实施了首次空间飞行器无人交会对接试验。
“天宫一号”飞行器升空所用燃料之一为液氢。
下列有关氢气的说法,你认为不正确的是( )A.氢气是一种无色、无臭、难溶于水的气体B.氢气在空气中燃烧时,产生淡蓝色火焰C.氢气和液氢的化学性质不同D.点燃用排水法收集的一试管氢气,若发出尖锐的爆鸣声,则表明氢气不纯9.某元素原子的相对原子质量为27,化合价为+3,则其氧化物中氧元素的质量分数为( )A.47.1%B.26.5%C.77.1%D.72%10.(2012·江西中考)蚊虫叮咬时分泌的蚁酸(CH2O2)会使人体皮肤肿痛。
2024年人教版九年级上册化学第四单元课后练习1(含答案和概念)试题部分一、选择题:1. 下列物质中,属于纯净物的是()A. 自来水B. 空气C. 氧气D. 铁水2. 下列气体中,能支持燃烧的是()A. 氧气B. 氮气C. 二氧化碳D. 氢气3. 下列关于分子的说法,正确的是()A. 分子是构成物质的最小粒子B. 分子是由原子组成的C. 分子之间没有间隔D. 分子的质量是固定的4. 下列关于原子的说法,错误的是()A. 原子是由原子核和电子组成的B. 原子核是由质子和中子组成的C. 电子的质量很小,可以忽略不计D. 原子的质量主要集中在原子核上5. 下列关于元素的说法,正确的是()A. 元素是具有相同质子数的原子B. 元素是具有相同电子数的原子C. 元素是具有相同中子数的原子D. 元素是具有相同质量数的原子6. 下列物质中,属于单质的是()A. 氧气B. 氯化钠C. 二氧化碳D. 硫酸7. 下列关于化合物的说法,错误的是()B. 化合物中各元素的质量比是固定的C. 化合物中各元素的质量分数是固定的D. 化合物中各元素的原子个数比是固定的8. 下列关于氧化物的说法,正确的是()A. 氧化物是由氧元素和另一种元素组成的化合物B. 氧化物中氧元素的质量分数一定是50%C. 氧化物中氧元素的化合价一定是2D. 氧化物都是无色无味的固体9. 下列关于化学式的说法,错误的是()A. 化学式可以表示一种物质B. 化学式可以表示一个分子C. 化学式可以表示一个原子D. 化学式可以表示一个离子10. 下列关于化学方程式的说法,正确的是()A. 化学方程式中的反应物和物之间用“+”连接B. 化学方程式中的反应物和物之间用“=”连接C. 化学方程式中的反应物和物之间用“→”连接D. 化学方程式中的反应物和物之间用“←”连接二、判断题:1. 构成物质的微粒有分子、原子和离子。
()2. 分子是保持物质化学性质的最小粒子。
A.B.C.D.币仍仅州斤爪反市希望学校滨湖区九年级上册化学第四单元 课题3<离子>练习2〔〕5.某元素原子电子层数为3,其原子的最外层有3个电子。
此元素的离子核外电子数为m ,那么此元素的核电荷数为A ,m B,m-3 C,m+3 D,无法确定6.离子变成原子后,会发生变化的是A ,失去一定数目的电子B ,得到一定数目的电子C ,不得失电子D ,可能得到电子,也可能失去电子7.以下结构示意图中,表示阴离子的是:二,填空题 8.构成物质的粒子由____________、____________、__________。
氯化钠是由________构成,铜是由____________,水是由_____________。
9.用符号表示:⑴氧元素______⑵氧气______⑶n 个氧原子______⑷氧离子_______⑸2个氧离子_________10.甲、乙两元素的原子结构示意图如下:甲:乙:〔1〕甲原子原子核内的质子数,最外电子层上有个电子,这种原子容易电子,形成离子。
〔2〕乙原子的核电荷数为,第二层上有个电子,这种原子容易电子,形成离子。
二,课后作业:练习册P63—65页三,预习作业:〔阅读书上P81--83页,完成习题〕1.________________________________叫做化学式。
2.化学式表示的意义为:1.___________________ __,2.____ ____________________3.________ _____________,4.________________________3.说出化学式H2O的四个意义:________________________________________________。
九年级人教版化学第四单元同步练习题及单元测试题_附答案初三化学第四单元同步练习题:化学式与化合价【典型例题】例1:O2表示氧气,还可以表示:①氧元素;②一个氧分子;③两个氧元素;④氧气由氧元素组成;⑤每一个氧分子由两个氧原子构成;⑥两个氧原子。
正确的是A. ①②③ B. ②④⑤ C. ②④⑥ D. ①④⑥【解析】化学式的意义有六点:①表示一种物质,如O2表示氧气;②表示物质的一个分子,如O2表示一个氧分子;③表示组成物质的各种元素,如O2由氧元素组成;④表示物质一个分子中各元素的原子个数,如O2表示一个氧分子由两个氧原子构成;⑤表示组成物质各元素的质量比;⑥表示物质中某元素的质量分数。
此外,还要区分元素和原子的概念,如元素只论种类不论个数,③是错误的,⑥两个氧原子应表示为2O 。
【答案】B例2:写出下列符号所表示的意义:(1)H________ (2)2H________ (3)H2________ (4)2H2________ 【解析】解答此题关键是要搞清元素符号及化学式含义,弄清元素符号周围不同位置上的数字所表示的意义. 【答案】(1)H :表示氢元素,表示一个氢原子. (2)2H :表示2个氢原子.(3)H2:表示氢气;表示氢气是由氢元素组成;表示一个氢分子;表示1个氢分子含有2个氢原子.(4)2H2表示2个氢分子.知识点2:化合价:一)元素化合价的表示方法:化合价用+1、+2、+3、-1、-2……表示,标在元素符号的正上方,要注意化合价的表示方法与离子符号的区别,离子所带电荷符号用+、2+、-、2-……表示,标在元素符号的右上角,如:Na+、Cl -、Mg2+、O2-。
试区别2Ca +与Ca2+,2S -与S2-中数字的含义。
2Ca +表示钙元素显+2价(或钙元素的化合价为+2价);2S -表示硫元素显-2价。
Ca2+表示一个钙离子带2个单位的正电荷;S2-表示1个硫离子带2个单位的负电荷。
2019-2020年九年级化学上册第四单元课题1、3 原子和离子练习人教新课标版原子和离子二、考点清单1、初步了解原子核外的电子是分层排布的;认识原子结构示意图2、认识原子结构与元素化学性质的关系;3、了解离子的概念,并掌握它的形成规律及与原子的区别。
4、了解化合物形成的过程。
总结物质与其构成离子的关系,完成课后练习题三、全面突破知识点1:原子核外电子的排布1、核外高速运动的电子是按能量由低到高,离核由近至远的顺序分层排布的核外电子的运动状况:高速运动分层排布电子层数:一二三四五六七……电子能量:逐渐升高离核距离:逐渐增大2、原子结构示意图:最外层电子数得失电子元素性质金属元素一般<4 易失活泼非金属元素一般≥4 易得活泼稀有气体元素8或2(He)稳定稳定①元素的化学性质决定于原子的最外层电子数。
②原子最外层电子数为8(氦为2)的结构称为稳定结构。
【典型例题】例1:根据钠原子的结构示意图,不能确定的是A. 元素种类B. 质子数C. 相对原子质量D. 电子层数【解析】解答本题的关键是弄清原子结构示意图中各部分表示的含义。
圆圈里面的数字表示原子核内的质子数,弧线表示电子层,弧线上的数字表示该电子层上的电子数。
因此,从钠原子的结构示意图中,我们可以看出:钠原子的质子数为11,核外有3个电子层,最外层有1个电子,是金属元素。
由于相对原子质量≈质子数+中子数,而中子数在原子结构示意图中没有反映,因此,仅凭钠原子的结构示意图,无法确定其相对原子质量。
【答案】C。
例2:下列叙述正确的是A. 原子是不能再分的最小粒子B. 同种元素的粒子,不一定具有相同的质子数C. 混合物中不可能只含有一种元素D. 元素的化学性质跟原子的最外层电子数关系非常密切【解析】原子在化学反应中不能再分,但它并不是构成物质的最小粒子。
原子是由原子核和核外电子构成的,在其他变化中还可以再分。
元素的种类由质子数决定,即同种元素的质子数一定相同。
混合物是由多种物质混合而成的,但组成元素却可能只有一种,如由O2和O3组成的混合物就只含有一种元素(即O 元素)。
元素的化学性质主要由该元素原子的最外层电子数决定。
【答案】D。
例3:已知溴的元素符号为Br,溴原子的结构示意图如图所示。
(1)x的值为________。
(2)溴元素的化学性质与下图中____(填序号)元素的化学性质最相似。
【解析】(1)任何元素的原子,核外电子总数一定等于核内质子数,因此x=35。
(2)元素的化学性质主要由该元素原子的最外层电子数决定。
溴原子的最外层电子数为7,图中B选项的原子结构示意图表示的原子的最外层电子数也为7,所以二者的化学性质最相似。
【答案】(1)35(2)B例4:某元素的原子最外层电子数为2,则该元素A. 肯定是金属元素B. 肯定是非金属元素C. 肯定是稀有气体元素D. 可能是金属元素或稀有气体元素【解析】一般来说,金属元素的原子最外层电子数小于4个,非金属元素的原子最外层电子数大于或等于4个,稀有气体元素的原子最外层电子数是8个(当第一层是最外层时有2个电子,如He)。
【答案】D。
例5:元素周期表是我们学习和研究化学的重要工具。
下表是元素周期表中1~18号元素原子的核外电子排布,我们对它进行研究:(1)第17号元素的名称是 ,它属于 元素(填“金属”或“非金属”),它在化学反应中容易 (填“得”或“失”)电子。
(2)从上表中我们还可以探究出以下规律: ①原子序数与原子核电荷数在数值上相等; ② ; ③ ; ④ 。
【解析】本题为原子结构与元素性质之间关系的发现规律式开放性试题。
元素性质由原子最外层电子数决定,最外层电子数出现周期性的变化,则元素的性质也将呈现周期性的变化规律。
原子中最外层电子数小于4的元素一般为金属元素,易失去电子;最外层电子数大于或等于4的元素一般为非金属元素;最外层电子数等于8(氦为2)的元素为稀有气体元素。
【答案】(1)氯 非金属 得(2)②每周期中的原子核外电子层数都相等,都等于周期数 ③每一周期元素原子的最外层电子数从左到右逐渐增大 ④每一竖行(族)中元素原子的最外层电子数相等知识点2:离子的形成1、定义:带电的原子或原子团叫离子. (原子团:常作为一个整体参加反应的原子集团)2、分类:(1)阳离子:带正电荷的离子(原子失电子) (2)阴离子:带负电荷的离子(原子得电子) 3、离子的表示方法:(1)离子符号:(离子符号歪戴帽,先写数字后写号)Na +、Cl -、O 2-、2Mg 2+*离子符号表示的意义:表示离子(或一个离子),如: Mg 2+——表示镁离子(一个镁离子) 2Mg 2+:小2表示每个镁离子带两个单位的正电荷,大2表示两个镁离子 离子符号前面的化学计量数(系数)表示离子的个数; (2)离子结构示意图:(特点:最外层稳定结构) 阳离子:质子数>电子数 阴离子:质子数<电子数①金属元素的原子容易失去最外层电子,失去m个电子就带m个单位正电荷,表示为R m+. 如铝原子Al→铝离子3Al .(13=2+8+3)原子结构示意图 阳离子结构示意图(13>2+8)②非金属元素的原子容易得到电子,达到8电子稳定结构,得到n 个电子,就带n个单位负电荷,表示为R n-. 如氧原子O→氧离子O 2-.(8=2+6)原子结构示意图 (8<2+8)阴离子结构示意图5、常见原子团离子:(1)NH 4+:铵根离子 (2)OH -:氢氧根离子 (3)NO 3-:硝酸根离子(4)SO 42-:硫酸根离子 (5)CO 32-:碳酸根离子 6、化合物的形成过程:问题:钠原子和氯原子核外电子都未达到相对稳定结构,那么,它们在化学反应中是怎样达到相对稳定结构的呢?+1128+172817钠原子(Na )氯原子(Cl )+1128钠离子(Na +)+17288氯离子(Cl -)失1个电子得1个电子NaCl氯化钠【典型例题】例1:钠原子和钠离子的结构示意图如下:请回答:(1)由于它们的原子核内( )相同. 所以它们都属于钠元素。
(2)钠原子和钠离子的化学性质( )。
(填“相同”或“不相同”)【解析】钠原子和钠离子原子核内都是11个质子,所以它们都属于钠元素,钠原子最外层有一个电子,易失去。
而钠离子最外层有8个电子,达到稳定结构,所以它们的化学性质不相同。
【答案】(l )质子数 (2)不相同例2:根据结构示意图回答(1)如果该图表示的是原子,则X值为_____ 。
(2)如果该图表示的是带两个单位正电荷的阳离子,则X值为_____ 。
(3)如果该图表示的是带两个单位负电荷的阴离子,则X值为______ 。
【解析】(1)原子中质子数=核外电子数,x=2+8=10(2)阳离子是原子失去电子后形成的,带2个单位正电荷说明失去了2个电子,则原子中的质子数=阳离子中的电子数+失去的电子数=2+8+2=12;(3)阴离子是原子得到电子后形成的,带2个单位负电荷说明得到了2个电子,则原子中的质子数=阴离子中的电子数-得到的电子数=2+8-2=8;【答案】(l)10 (2)12 (3)8例3:1996年科学家在宇宙深处发现了H3+离子和H3分子。
请回答:(1)1个H3+离子中含有个质子、个电子;(2)构成H3分子的原子的结构示意图是;(填序号)(3)H3属于。
(填“混合物”、“单质”或“化合物”)【解析】本题是对科技新发现“H3+”“H3”的有关化学知识的考查。
该题中,由于1个“H3+”离子中含有3个氢原子核,但又失去了1个电子,故有3个质子和2个电子。
在“H3”分子中,氢原子的核内有一个质子,核外有1个电子,故C正确。
由于“H3”是由同种元素组成的纯净物,故属于单质。
【答案】(l) 3、2,(2)C (3)单质例4:科学家已研究出高能微粒N5+,关于它的说法正确的是A. N5+是由5个氮原子构成的单质B. N5+中只有质子没有中子和电子C. 每个N5+中含有35个质子和34个电子D. 每个N5+中含有35个质子和35个电子【解析】N5+是带电的微粒,不是物质,所以A是错的。
N5+是离子符号,一个N5+离子中含有5个氮原子,5个氮原子共应有35个质子、35个电子,而此微粒带一个单位正电荷,应已失去1个电子,为35个质子、34个电子。
【答案】C例5:在分子、原子、质子、中子、电子、原子核、离子这些微粒中:(1)能直接构成物质的微粒有_________________;(2)能保持物质化学性质的微粒有_____________;(3)显示电中性的微粒有__________________;(4)带正电的微粒有______________________;(5)带负电的微粒有______________________;(6)质量最小的微粒有_____________________;(7)参加化学反应时,一定发生变化的微粒有__________;(8)在同一原子里数目相等的是_____________;【解析】本题综合考查微观粒子的性质,思考容量大,解题的关键在于把各种微粒性质的异同点搞清楚。
(1)能直接构成物质的微粒有分子(如氧气)、原子(如金属铜)和离子(如食盐NaCl);(2)能保持物质化学性质的微粒当然也包括分子、原子、离子、而分子只是保持物质化学性质的一种微粒;(3)分子、原子不显电性,而中子本身就不带电;(4)质子和原子核带正电荷,离子有阴离子和阳离子之分,其中阳离子带正电荷;(5)电子和阴离子带负电荷;(6)质量最小的微粒应为电子;(7)化学变化时分子一定要解离成原子,再重新结合成其他物质的分子;(8)原子之所以不带电,是因为带正电的质子与带负电的电子数目相等。
【答案】(1)分子、原子、离子;(2)分子、原子、离子;(3)分子、原子、中子;(4)原子核、质子、阳离子;(5)电子、阴离子;(6)电子(7)分子(8)质子和电子。
例6:下图是1~18号元素原子最外层电子数与原子核电荷数的关系图。
试回答:(1)一个水分子共有个原子核、个质子。
(2)一个Mg2+核外共有个电子;Cl_的最外层电子数和原子的最外层电子数相同。
(3)通过对下图的分析,你能发现哪些规律?。
【解析】本题考查原子结构、最外层电子数与核电荷数之间的关系,一个水分子中含有两个氢原子和一个氧原子,所以有3个原子核,1个氢原子有1个质子,共有2个氢原子,1个氧原子有8个质子,故共有10个质子。
1个镁离子是在镁原子基础上失去2个电子而形成的,故有12-2=10个电子,氯离子的最外层应有8个电子,与Ar或Ne原子的最外层电子数相同。
图像呈现的规律是开放性的,元素的性质由原子最外层电子数决定,最外层电子数出现周期性的变化,则元素的性质也将呈现周期性变化规律。