大学物理第 13 章 第 2 次课 -- 理想气体的等温过程和绝热过程..
- 格式:ppt
- 大小:900.50 KB
- 文档页数:14

热力学理想气体的等温过程与绝热过程热力学是研究物质能量转换和物质性质变化的学科,而热力学理想气体的等温过程与绝热过程是热力学中的两个重要概念。
本文将详细探讨热力学理想气体在等温过程和绝热过程中发生的变化和特性。
一、等温过程等温过程是指气体在恒温条件下发生的过程。
在等温过程中,气体的温度保持不变,但是其他物理量如压强、体积等会发生变化。
热力学理想气体在等温过程中的特点如下:1. 等温膨胀:当气体受热膨胀时,其体积增大,但是温度保持不变。
根据理想气体状态方程PV=RT,可以得到等温膨胀的关系式为P1V1=P2V2,其中P1和V1分别为初始状态下的压强和体积,P2和V2为终态下的压强和体积。
2. 等温压缩:当气体被压缩时,其体积减小,但是温度保持不变。
根据理想气体状态方程PV=RT,可以得到等温压缩的关系式为P1V1=P2V2,其中P1和V1分别为初始状态下的压强和体积,P2和V2为终态下的压强和体积。
3. 等温过程中的能量转化:根据热力学第一定律,等温过程中的能量转化可以表示为Q=W,即等温过程中所吸收的热量等于所做的功。
这是因为在等温过程中,气体通过与外界交换热量来保持温度不变,而这部分热量又可以转化为对外界所做的功。
二、绝热过程绝热过程是指气体在不与外界交换热量的条件下发生的过程。
在绝热过程中,气体的内能发生变化,从而引起其他物理量的变化。
热力学理想气体在绝热过程中的特点如下:1. 绝热膨胀:当气体在没有热量交换的情况下膨胀时,其体积增大,压强减小。
根据理想气体状态方程PV=RT,可以得到绝热膨胀的关系式为P1V1^γ=P2V2^γ,其中γ为气体的绝热指数,取决于气体的性质。
2. 绝热压缩:当气体在没有热量交换的情况下被压缩时,其体积减小,压强增大。
根据理想气体状态方程PV=RT,可以得到绝热压缩的关系式为P1V1^γ=P2V2^γ,其中γ为气体的绝热指数,取决于气体的性质。
3. 绝热过程中的能量转化:在绝热过程中,没有热量交换发生,因此热力学第一定律可以表示为Q=0=W,即绝热过程中没有热量的吸收或放出,所以气体对外界所做的功等于内能的改变。

理想气体的等温与绝热过程理想气体是物理学中一个重要的理想化模型,它假设气体的分子之间没有相互作用,体积可以忽略不计。
在实际的等温与绝热过程中,理想气体表现出了不同的特性和行为。
本文将深入探讨理想气体在等温与绝热过程中的特点和数学表达方式。
等温过程是指气体在恒定温度条件下发生的过程。
在等温过程中,理想气体的温度保持不变,因此根据理想气体状态方程PV=nRT,压强和体积成反比。
也就是说,当体积增大时,压强会相应减小,反之亦然。
这种关系可以用数学表达式PV=常数来表示,其中常数等于nRT。
绝热过程是指气体在没有热量交换的情况下发生的过程。
在绝热过程中,理想气体的内部能量保持不变,因此根据理想气体状态方程PV=nRT,压强和体积的乘积保持不变。
也就是说,当体积减小时,压强会相应增大,反之亦然。
这种关系可以用数学表达式P₁V₁^γ=P₂V₂^γ来表示,其中γ是气体的绝热指数,对于大多数单原子气体而言,γ≈5/3。
在等温过程中,理想气体的温度保持恒定,因此内能的增加和对外做功相互抵消。
根据气体内能的公式(因为内能只与温度有关),ΔU=nCvΔT,其中ΔU表示内能的变化,n表示物质的摩尔数,Cv表示摩尔定容热容,ΔT表示温度变化。
由于等温过程中温度不变,因此ΔT=0,所以ΔU=0。
这意味着在等温过程中,理想气体的内能保持不变。
在绝热过程中,理想气体没有热量交换,因此热量的增加全都被用于对外做功。
根据绝热过程中的热力学第一定律,Q-W=ΔU,其中Q 表示吸收的热量,W表示对外做的功,ΔU表示内能的变化。
由于绝热过程中没有热量交换,因此Q=0,所以W=ΔU。
这意味着在绝热过程中,理想气体的内能变化全部用于对外做功。
绝热过程和等温过程的比较可以看出,等温过程中理想气体对外做的功为零,内能的变化为零;而绝热过程中理想气体对外做的功不为零,内能的变化全部用于对外做功。
这两个过程都是理想气体在不同条件下的特性,对于理论研究和实际应用都有着重要的意义。

理想气体中的等温过程与绝热过程在研究理想气体的性质和行为时,等温过程和绝热过程是两个重要的概念。
它们描述了气体在外界条件改变下的变化规律,是热力学和物理学中的基础概念之一。
本文将详细介绍等温过程和绝热过程的定义、特点和数学表达,以及它们在实际应用中的意义和重要性。
一、等温过程等温过程是指在气体与外界保持恒定温度的条件下,体积和压力发生变化的过程。
根据理想气体状态方程PV=nRT,当温度保持不变时,压力和体积成反比关系。
也就是说,当压力增加时,体积减小;压力减小时,体积增加,以保持气体的温度不变。
以一定量的理想气体为例,假设其体积从V₁变化到V₂,对应的压力由P₁变化到P₂。
根据等温过程的特点,我们可以得到以下数学表达式:P₁V₁ = P₂V₂这个表达式被称为爱德华·博伯定律,也是描述等温过程中气体性质的重要公式之一。
从公式中可以看出,当气体的温度不变时,压力和体积之间存在一个不变的乘积关系。
等温过程在实际应用中有着重要的意义。
在工程领域中,等温过程常常用于设计和优化热机、制冷设备等。
在化学实验中,等温过程也是调整反应条件和控制反应速率的基础。
二、绝热过程绝热过程是指在理想气体与外界没有热量交换的条件下,体积和温度发生变化的过程。
在绝热过程中,气体与外界之间没有能量的转移,因此其内能保持不变。
根据内能守恒定律,绝热过程中气体的温度变化与体积变化呈反比关系。
同样以一定量的理想气体为例,假设其体积从V₁变化到V₂,对应的温度由T₁变化到T₂。
根据绝热过程的特点,我们可以得到以下数学表达式:T₁V₁^(γ-1) = T₂V₂^(γ-1)其中,γ为气体的绝热指数,表示气体热容比。
对于单原子分子气体,γ约等于5/3;对于双原子分子气体,γ约等于7/5。
从上述公式中可以看出,当气体的体积增加时,温度会降低,反之亦然。
绝热过程的应用也非常广泛。
例如,在内燃机中,汽缸中的气体在燃烧过程中发生绝热膨胀,从而驱动活塞运动,产生功。


理想气体的等温过程与绝热过程理想气体是指在一定温度下,气体分子之间完全没有相互作用的气体模型。
在理想气体的热力学过程中,等温过程和绝热过程是两个重要的概念。
本文将分别介绍理想气体的等温过程和绝热过程,并探讨它们的特点和应用。
一、理想气体的等温过程等温过程是指在气体发生变化的过程中,温度保持不变。
对于理想气体而言,等温过程可以用以下方程来描述:PV = 常数(1)式中,P表示气体的压强,V表示气体的体积。
根据理想气体状态方程,PV = nRT,式中,n表示气体的物质的量,R是气体常数,T是气体的绝对温度。
结合方程(1)和PV = nRT,我们可以得到:nRT = 常数(2)由方程(2)可知,在等温过程中,气体的物质的量n和体积V是成反比的关系。
也就是说,在体积增大的同时,物质的量会减少,反之亦然。
这说明了在等温过程中,气体分子会随着体积的改变而发生数量的变化。
等温过程还有一个重要的特点是气体对外做功。
根据热力学的能量守恒定律,气体所做的功等于外界对气体做的功。
在等温过程中,气体扩大或收缩的功可以通过以下公式计算:W = - nRT * ln(V2/V1) (3)式中,W表示气体所做的功,V1和V2分别表示气体的初始体积和最终体积。
二、理想气体的绝热过程绝热过程是指在气体发生变化的过程中,没有热量的交换。
绝热过程的特点是温度和压强同时变化。
对于理想气体而言,绝热过程可以用以下方程来描述:PV^γ = 常数(4)式中,γ表示气体的绝热指数,对于大多数单原子理想气体而言,γ约等于5/3。
根据理想气体状态方程,PV = nRT,我们可以推导出绝热过程中,温度和压强的关系:T = (Pv^(γ-1))/(nR) (5)式中,Tv表示绝热过程中气体的温度。
由方程(5)可知,在绝热过程中,随着气体体积的减小,气体的温度也会随之降低。
反之,体积的增大会导致温度的升高。
这与等温过程中温度保持不变的特点形成了鲜明的对比。


热学中理想气体的等温过程与绝热过程的研究在热学中,理想气体是一种非常重要的概念。
理解理想气体的行为对于研究物质的热力学性质至关重要。
在本文中,我们将研究理想气体的等温过程和绝热过程。
一、等温过程等温过程是指在温度不变的情况下改变气体的容积,从而改变气体的压强和密度的过程。
对于理想气体而言,等温过程是一个非常特殊的过程,因为理想气体的等温过程满足泊松定律。
泊松定律指出,在等温过程中,理想气体的压强与密度成反比。
即P∝1/V,其中P表示气体的压强,V表示气体的体积。
如果我们将温度和物质的物态方程考虑在内,可以得到PV=nRT,其中n表示气体的摩尔数,R为气体常数,T表示气体的温度。
根据泊松定律,可以推导出,对于理想气体,在等温过程中PV=constant。
二、绝热过程绝热过程是指在没有热量交换的情况下改变气体的容积,从而改变气体的压强和密度的过程。
在绝热过程中,理想气体的内能不会发生改变,因为没有热量传递。
因此,绝热过程也称为内能守恒过程。
绝热过程的一个重要特点是,理想气体的压强和密度的变化满足玻意耳定律。
玻意耳定律指出,在绝热过程中,理想气体的压强与密度成正比。
即P∝ργ,其中γ是热容比,表示气体在绝热过程中的热容与气体在等压过程中的热容之比。
对于单原子分子气体而言,γ=5/3;对于双原子分子气体而言,γ=7/5。
绝热过程可以用绝热指数k来描述,k=cp/cv,其中cp表示气体在等压过程中的比热容,cv表示气体在等容过程中的比热容。
对于理想气体而言,k=γ。
三、等温过程与绝热过程的区别从上述内容可以看出,等温过程和绝热过程有着明显的不同点。
等温过程中,理想气体的压强与密度成反比;绝热过程中,理想气体的压强与密度成正比。
这意味着,在等温过程中,气体的温度保持不变,而在绝热过程中,气体的温度会随着容积的改变而发生变化。
此外,等温过程和绝热过程的热容比也不同。
在等温过程中,热容比始终为1;在绝热过程中,热容比取决于气体的分子结构。

理想气体的等温过程与绝热过程计算理想气体的等温过程和绝热过程是热力学中常见的两种过程。
在本文中,我们将着重讨论这两种过程的计算方法和相关概念。
等温过程是指气体在保持恒定温度的条件下发生的过程。
在等温过程中,气体与外界交换热量,但由于温度不变,气体内部能量的平均值也保持不变。
根据理想气体状态方程PV=nRT,等温过程中气体的体积和压力成反比。
换句话说,当气体的体积增大时,压力会下降,反之亦然。
为了计算等温过程中气体的状态变化,我们可以使用维尔纳二次定律,即P1V1=P2V2,其中P1和V1是初始状态下的压力和体积,P2和V2是终态下的压力和体积。
这个方程的推导基于理想气体状态方程和等温过程的定义。
接下来,让我们进一步探讨绝热过程。
绝热过程是指气体在没有与外界交换热量的条件下发生的过程。
在绝热过程中,气体的内部能量发生变化,但没有热量的进出。
根据理想气体状态方程,绝热过程中气体的压力和体积满足PV^γ=常数,其中γ是气体的绝热指数。
对于单原子理想气体(如氦气),γ=5/3;而对于双原子理想气体(如氮气),γ=7/5。
与等温过程类似,为了计算绝热过程中气体的状态变化,我们可以使用维尔纳二次定律。
然而,在绝热过程中,由于没有热量交换,我们需要使用绝热指数γ来代替温度,在方程中的体积和压力关系为P1V1^γ=P2V2^γ。
通过上述的计算方法,我们可以得到等温过程和绝热过程中气体状态变化的结果。
这些结果对于热力学系统的分析和工程应用具有重要意义。
除了等温过程和绝热过程,理想气体还有其他类型的过程,如等容过程和等压过程。
每种过程在计算上都具有一定的特点和方法。
总结起来,理想气体的等温过程和绝热过程是热力学中重要的概念。
通过合适的计算方法,我们可以得到气体在这两种过程中的状态变化。
这些计算结果对于热力学系统的研究和实际应用非常有价值。
在实际工程中,我们可以利用这些计算结果来设计和优化热力学系统,提高能源利用效率。
热力学理想气体的等温过程与绝热过程的应用热力学是物理学中的一个重要分支,研究能量转化和能量传递的规律。
其中,理想气体的等温过程和绝热过程是热力学中的两个关键概念。
本文将探讨这两个过程的基本概念、特点以及在现实生活中的应用。
1. 理想气体的等温过程等温过程指在热力学系统中,温度保持不变的过程。
对于理想气体,等温过程可以通过理想气体定律来描述,即PV=constant。
其中,P代表气体的压力,V代表气体的体积。
等温过程的特点是气体内能的变化与对外做功的变化相等。
在等温膨胀过程中,当气体从一个状态变到另一个状态时,气体分子的平均动能保持不变,但体积增大。
由于气体的压力与体积的乘积为一常数,气体膨胀时压力下降。
等温过程在实际生活中有着广泛的应用。
例如,工业生产过程中的空气压缩机、火箭发动机的工作过程等都是等温过程。
此外,气体冷却过程中的制冷机也是基于等温过程的原理工作的。
2. 理想气体的绝热过程绝热过程指在热力学系统中,没有热量交换的情况下进行的过程。
对于理想气体,绝热过程可以通过绝热指数来描述,即PV^γ=c onstant。
其中,γ为绝热指数,代表气体的性质。
绝热过程的特点是气体内能的变化与对外做功的变化不相等。
在绝热膨胀过程中,当气体由一个状态转变到另一个状态时,气体内部没有能量的流失或补充。
由于没有热量交换,气体在膨胀过程中温度下降,压力也随之降低。
绝热过程在现实生活中也有着广泛的应用。
例如,内燃机的工作过程中,气缸内的燃气通过绝热膨胀驱动活塞运动。
此外,高压空气输送系统中的管道膨胀也可用绝热过程来描述。
3. 等温过程与绝热过程的应用等温过程和绝热过程在工程技术和生活实践中有着广泛的应用。
以下是它们在不同领域的一些具体应用:3.1 热力学循环等温过程和绝热过程常常被应用于热力学循环中,如卡诺循环、斯特林循环和往复式内燃机。
通过在不同温度下的等温膨胀和绝热膨胀,实现能量的转变和工作的产生。
3.2 制冷技术制冷技术中的压缩机利用了等温过程和绝热过程的原理。
理想气体的等温过程与绝热过程理想气体在不同的过程中表现出不同的特性,其中等温过程和绝热过程是两种常见的气体过程。
本文将对理想气体的等温过程和绝热过程进行详细介绍。
一、理想气体的等温过程等温过程是指气体在温度恒定的情况下发生的过程。
在等温过程中,气体内部的分子运动速度仍在改变,但总体来说,分子碰撞所产生的压强和分子间的引力相互抵消,使得气体保持恒定的温度。
这是因为等温过程中热量的加入与放出相等,保持热平衡。
在等温过程中,根据理想气体的状态方程PV=nRT(其中P为气体的压强,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的温度),可以得到以下关系式:P1V1=P2V2其中P1和V1表示初始状态下的压强和体积,P2和V2表示最终状态下的压强和体积。
从上式可以看出,在等温过程中,气体的压强和体积呈反比关系。
等温过程的特点是气体对外界做功。
由于气体的体积发生改变,气体向外界提供了一定的功。
在等温过程中,由于气体分子的运动速度和分子间的引力相互抵消,气体没有温度差,故不会产生热量的传递。
二、理想气体的绝热过程绝热过程是指气体与外界没有热量交换的过程。
在绝热过程中,气体受到的外界影响只有气体的压强和体积的改变,而没有温度的改变。
绝热过程中气体内部的分子速度会发生改变,但总体来说,分子的动能和势能保持恒定。
绝热过程中,根据理想气体的状态方程PV^γ=常数(其中γ为气体的绝热指数,在单原子分子中为5/3,在双原子分子中为7/5,例如空气中的氮氧化合物),可以推导出以下关系式:P1V1^γ=P2V2^γ其中P1和V1表示初始状态下的压强和体积,P2和V2表示最终状态下的压强和体积。
从上式可以看出,在绝热过程中,气体的压强和体积的幂函数关系。
绝热过程的特点是气体做功和温度变化。
由于没有热量传递,气体对外界做功时从内部获取能量,导致气体的温度下降。
绝热过程的常见应用是气体膨胀和压缩的过程。
综上所述,理想气体的等温过程和绝热过程在气体状态变化和能量交换方面具有不同的特点。
热学理想气体的等温过程与绝热过程热学中,理想气体是一个非常重要的研究对象。
理想气体在各种过程中的性质以及其与热力学参数的关系一直是科学家们探索和分析的对象。
本文将着重讨论理想气体的等温过程和绝热过程,探究这两种过程在理想气体中的特点以及相互之间的区别。
等温过程是指气体在温度不变的情况下进行的过程。
在等温过程中,气体的温度保持不变,从而使得气体内能的变化与做功的变化相抵消,维持气体的总能量保持不变。
根据理想气体的状态方程,可以得出等温过程中气体压强和体积之间的关系为P1V1=P2V2,即等温过程是一个双曲线,曲线的形状取决于气体的特性。
绝热过程是指气体在没有与外界交换热量的情况下进行的过程。
在绝热过程中,气体的内能发生改变,但是热量的交换量为零,因此气体的温度会发生变化。
根据理想气体的状态方程,可以得出绝热过程中气体压强和体积之间的关系为P1V1^γ=P2V2^γ,其中γ为绝热指数,也是一个气体的特性常数。
绝热过程的压强-体积关系曲线是一个双曲线,且比等温过程更陡峭。
在实际情况中,等温过程和绝热过程往往同时存在。
例如,当理想气体在容器中进行等温膨胀时,同时做功以及与外界交换热量,这个过程既有等温的特点又有绝热的特点。
绝热和等温过程的结合,使得气体的性质更加丰富和复杂。
通过对理想气体等温过程和绝热过程的分析,我们可以得到一些重要的结论。
首先,等温过程中气体的内能保持不变,而绝热过程中气体的内能发生改变;其次,等温过程中气体的压强和体积成反比,绝热过程中气体的压强和体积有一定的幂指数关系;最后,等温过程和绝热过程往往同时存在于实际情况中,使得气体的过程更加复杂多变。
综上所述,热学中的理想气体等温过程和绝热过程是两个重要的研究对象,它们揭示了气体在不同条件下的行为特性。
等温过程中气体保持温度不变,绝热过程中气体没有与外界交换热量。
通过对这两种过程的研究,可以更好地理解和分析理想气体的性质和行为。
对于热学研究的深入和应用,进一步探究和理解理想气体的等温过程和绝热过程具有重要的意义。
热力学基础知识理想气体的等温过程和绝热过程理想气体的等温过程和绝热过程热力学是研究物质内部热和机械运动相互转化关系的一门学科。
在热力学中,等温过程和绝热过程是基础知识,对于理解理想气体的行为和性质非常重要。
本文将介绍理想气体的等温过程和绝热过程以及它们在物理实践中的应用。
一、等温过程等温过程是指气体在恒定温度下发生的过程。
在等温过程中,气体和外界之间可以进行热量的交换,以保持系统温度不变。
理想气体的等温过程遵循以下规律:1. 等温膨胀:当理想气体在等温条件下发生膨胀时,保持系统温度不变,同时气体对外界做功,即系统对外界做正功。
根据理想气体状态方程 PV=nRT,可以推导出等温膨胀时,气体的体积和压力呈反比的关系,即 PV=常数。
2. 等温压缩:当理想气体在等温条件下发生压缩时,同样保持系统温度不变,但是此时外界对气体做功,即系统对外界做负功。
根据理想气体状态方程,可以得到等温压缩时,气体的体积和压力也呈反比的关系。
等温过程的应用非常广泛,其中一个典型的应用是冷热机的工作原理。
冷热机中的循环过程通常分为等温膨胀、绝热膨胀、等温压缩和绝热压缩四个过程。
等温膨胀和等温压缩过程是通过与外界热源和冷源接触来保持温度不变,从而实现热机效率的提高。
二、绝热过程绝热过程是指气体在无热量交换的情况下发生的过程。
在绝热过程中,系统与外界之间没有能量的转移,因此温度会发生变化。
理想气体的绝热过程遵循以下规律:1. 绝热膨胀:当理想气体在绝热条件下发生膨胀时,不进行热量的交换,系统对外界做正功。
根据理想气体状态方程,可以得到绝热膨胀时,气体的体积和压力呈反比的关系。
2. 绝热压缩:当理想气体在绝热条件下发生压缩时,同样不进行热量的交换,外界对气体做功,即系统对外界做负功。
根据理想气体状态方程,可以得到绝热压缩时,气体的体积和压力也呈反比的关系。
绝热过程在实际中也有许多应用。
例如,内燃机中的压缩过程和膨胀过程通常被视为绝热过程,这种过程可以更好地描述气体在缸内的行为。
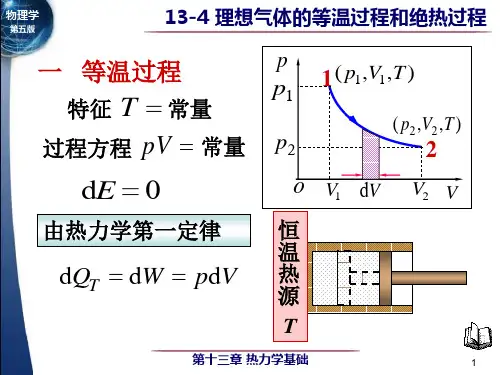
§6-5 理想气体的等温过程和绝热过程一、等温过程(Isothermal Process )1.特点:理想气体的温度保持不变,T =const 。
2.过程曲线:在PV 图上是一条双曲线,叫等温线。
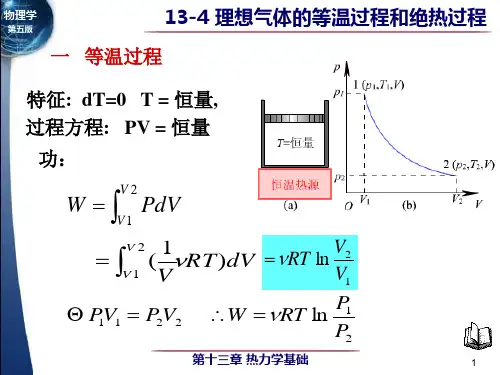
3.过程方程:P 1V 1= P 2V 24.内能、功和热量的变化系统经过等温过程,从状态()T V P ,,11变成()T V P ,,22内能 012=-=∆E E E功 ⎰=21V V T PdV W由气体状态方程 RT M m PV =得 VRT M m P 1= 12ln 121V V RT M m dV V RT M m W V V T ==⎰——用体积表示。
用压强表示为21ln P P RT M m W T = 热量:由热力学第一定律得 1221ln ln V V RT M m P P RT M m Q T ==5.特征:在等压过程中,系统从外界吸收的热量,全部用来对外作功。
注意:对于等温过程,不能定义摩尔热容;如果要定义,则∞=C 。
二、绝热过程(Adiabatic Process )1.特点:系统与外界没有热量交换的过程,Q =0。
2.内能、功和热量的变化系统经过绝热过程,从状态()11T V P ,,变成()22T V P ,,内能 ()12,12T T C Mm E E E m V -=-=∆ 热量 Q =0由热力学第一定律 0=+∆=W E Q ,得功 ()12,T T C Mm W m V -=- 用状态参量P ,V 表示,根据状态方程R PV T M m =,可知()1 22112211,-=-γV P V P V P V P R C W mV --= 证明:由定义可知,m V m V m V m V mP C R C R C C C ,,,,,1+=+==γ 因而1,-=γm V C R 故 11,-=γR C m V 因而 12211-γV P V P W -= 3.特征:在绝热过程中,系统对外界所作的功是由于系统内能的减少来完成的。
理想气体等温过程和绝热过程的能量变化在热力学中,理想气体的等温过程和绝热过程是两个非常重要的概念,它们涉及到气体在状态变化时能量的转化和传递。
理解这两个过程中的能量变化,对于深入掌握热力学原理以及解决实际问题都具有重要意义。
首先,我们来了解一下什么是理想气体。
理想气体是一种假设的气体模型,它具有一些特定的性质。
理想气体的分子之间没有相互作用力,分子自身的体积可以忽略不计。
这样的假设使得对气体行为的分析和计算大大简化。
等温过程,顾名思义,就是在温度保持不变的情况下进行的过程。
在这个过程中,理想气体与外界有热量交换,以保持温度恒定。
根据理想气体状态方程$PV = nRT$(其中$P$是压强,$V$是体积,$n$是物质的量,$R$是气体常数,$T$是温度),由于温度$T$不变,所以$PV$的乘积也是不变的。
假设一个理想气体从初始状态$(P_1, V_1)$经过等温过程变化到终态$(P_2, V_2)$。
在这个过程中,气体对外做功可以通过积分计算得到:$W =\int_{V_1}^{V_2} PdV$。
由于$PV$为常数,设为$C$,则$P =\frac{C}{V}$,所以$W =C\ln\frac{V_2}{V_1}$。
又因为温度不变,内能只与温度有关,所以内能的变化$\Delta U =0$。
根据热力学第一定律$\Delta U = Q + W$,因为$\Delta U = 0$,所以$Q =W$。
这意味着气体从外界吸收的热量等于气体对外做的功。
接下来,我们探讨绝热过程。
绝热过程是指气体与外界没有热量交换的过程。
在绝热过程中,气体的压强、体积和温度都会发生变化。
对于绝热过程,有一个重要的方程:$PV^{\gamma} =$常数。
其中,$\gamma$是比热容比,对于单原子气体,$\gamma =\frac{5}{3}$;对于双原子气体,$\gamma =\frac{7}{5}$。
同样假设一个理想气体从初始状态$(P_1, V_1)$经过绝热过程变化到终态$(P_2, V_2)$。