冻干机自动进出料系统
- 格式:ppt
- 大小:14.38 MB
- 文档页数:27
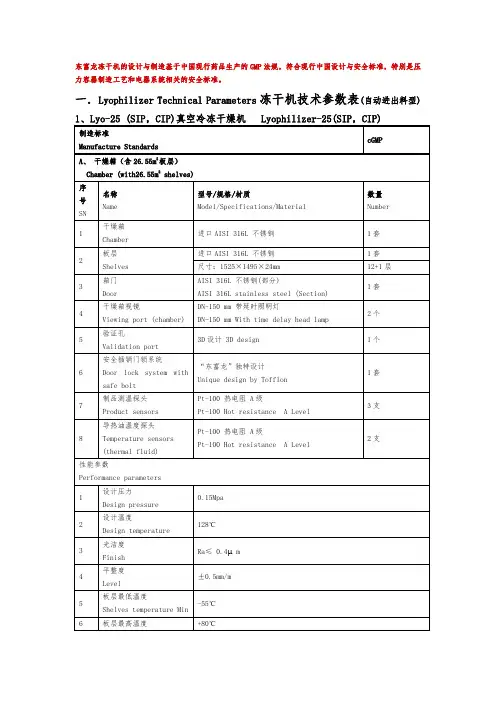

药厂车间设计与设备题目:冷冻干燥设备综述学院专业学号学生姓名指导教师二〇一年月目录1.冻干技术原理 (2)2.冻干设备分类 (3)2.1.干燥搁板面积 (4)2.2.冻结方式 (4)2.3.干燥仓形状 (4)3.冷冻干燥机结构 (4)4.冻干基本过程 (4)4.1 前处理 (5)4.2 预冻 (5)4.3 干燥 (5)3.4 后处理 (6)5.冻干技术发展历史 (6)5.1 食品的冻干 (6)5.2 标本、医药品的冻干 (7)5.3 当今情况 (8)6.冻干设备医药领域应用 (8)6.1中药现代化 (8)6.2西药制备 (8)6.3生物制品的保存 (9)7.冻干设备主要厂商 (9)7.1国内主要厂商及产品 (9)7.2国外主要厂商及产品 (11)8.冻干发展现状和趋势 (11)8.1 制冷系统的发展现状和趋势 (12)8.2 控制系统的发展现状和趋势 (13)8.3 整合的冻干生产线 (13)8.4结论 (13)9.参考文献 (14)1.冻干技术原理真空冷冻干燥技术,也可称之为冷冻升华干燥,它是将经过一定处理的新鲜物料或者湿物料的温度降低到物料共晶点温度以下,使物料内部的水分完全冻结,形成固态的冰,然后适当抽取干燥仓内的空气,使其达到一定的真空度,之后对加热板进行加热达到适当的温度下,使冰直接升华为水蒸气,再利用真空系统的捕水器或者制冷系统的水气凝结器将水蒸气冷凝,从而得到干制品物料的一种技术。
真空冷冻干燥技术其干燥过程是物料内部水分的物理状态变化并且逐渐移动的过程,由于这种变化和移动是发生在低温低压条件下的,因此,真空冷冻干燥技术的基本原理就是低温低压下传热传质的机理。
在低压下水的相变过程和常压下大体相似,但相变时的具体温度不同。
例如在103 Pa压力下,固态冰转化为液态水的温度略高于0℃,而液态水转化为蒸汽的温度为6.3℃,可见降低压力后冰点变化不大,而沸点却大大降低了。
可以想象,当压力降低到某一值时,沸点即与冰点相重合,固态冰就可以不经液态而直接变为气态,这时的压力称为三相点压力,相应的温度称为三相点温度。

冻干机及其自动进出料系统URS用户需求标准URS文件编号制定日期2013.8.23 审核日期批准___ 日期____用户:部门:位置:文件编号:版本:审核和批准名字公司职能签名日期编写GMP咨询师审核GMP经理审核生产经理审核工程经理审核验证经理审核项目经理批准QA经理版本历史版本. 日期编写人变更描述目录1.概述 (1)1.1范围 (1)1.2遵循方针 (1)1.3法规和指南 (1)2.介绍 (1)2.1目的 (1)2.2范围 (1)2.3描述 (1)2.4说明 (2)3.术语 (3)4.用户要求 (4)4.1生产能力 (4)4.2工艺要求 (4)4.3功能 (5)5.自动进出料 (10)6.公用系统 (10)7.环境 (11)8.清洁要求 (11)9.限制和要求条款 (11)10.约束条件 (12)1. 概述1.1范围本文件的起草用来确认Iron Spirit设计对准备采购的冻干机及其自动进出料系统的规格和性能要求。
本文件内容涉及设备、测试步骤、规格、文档和参考书目,所有这些将支持冻干机及其自动进出料系统URS的合理性。
1.2遵循方针本URS文件的起草符合Iron Spirit设计的质量方针和要求。
1.3法规和指南整个系统或设备必须符合中国现行GMP,美国FDA和欧盟GMP的要求。
另外,供应商所供应系统或设备应该符合以下使用的法规和指南:ISPE制药工程基准指南系列——无菌生产设施(第二版)2. 介绍2.1 目的该文件的目的是定义位于生产厂房二楼的冻干制剂车间冻干机的用户需求标准。
该URS在移交给供应商之后,将意味着所有指定的要求被涵盖在供应商的供应范围之内。
2.2 范围序号设备名称部门流程图位号地点1.2.2.3 描述本文件是Iron Spirit设计制定的用以说明无菌冻干粉针剂的冻干机及其进出料系统的用户要求,目的是协助用户通过重要的部件、关键参数和必需的选择,一可能的最有效的花费去获得满足用户需求的无菌东干粉针剂的冻干机及其进出料系统。

冻干机及其自动进出料系统用户需求标准审核和批准版本历史目录1.概述.................................................... (1)1.1范围.................................................... . (1)1.2遵循方针 (1)1.3法规和指南 (1)2.介绍.................................................... (1)2.1目的.................................................... . (1)2.2范围.................................................... . (1)2.3描述.................................................... . (1)2.4说明.................................................... . (2)3.术语.................................................... (3)4.用户要求.................................................... .. (4)4.1生产能力 (4)4.2工艺要求 (4)4.3功能.................................................... . (5)5.自动进出料......................................................106.公用系统.................................................... . (10)7.环境.................................................... .. (11)8.清洁要求.................................................... . (11)9.限制和要求条款 (11)10.约束条件.................................................... . (12)1. 概述1.1范围本文件的起草用来确认设计对准备采购的冻干机及其自动进出料系统的规格和性能要求。


冻干制剂自动进出料系统用户采购要求说明书User’s Requirements Specification数量 2 套(包括相关附件等)买方地址卖方地址版本历史本采购说明适用于以下设备:名称冻干制剂自动进出料系统型号数量共2 套1. 总说明General本项目是一个系统工程项目。
项目编号:2008—03—NP15。
甲乙双方均为此设立项目组和项目经理,项目经理即为联系人。
This project is a system project. Project No: 2008-03-NP15. Both XX and the Vendor should set up a Project Team for this project. Project Manager should be the contact person本用户要求说明书(URS-2102)是对冻干制剂线(西林瓶)自动进出料系统(Automatic Loadingand Unloading System)的设计、制造、材质、控制系统、检查和测试、文件、包装运输发货、安装调试、验证、操作使用培训的说明和最低要求。
This URS-2102 is used for the minimum requirement for design, fabrication, material, control system, FAT, documentation, packing& transportation, installation/commissioning, validation and training for a lyophilisation line (vial) automatic loading and unloading system所有设备的设计、制造、材质、检查和测试、制造厂内测试(FAT)(包括试运行与验证)、用户现场最终检查和测调试(SAT)等活动由卖方负责并由买方人员参加复核及批准,SAT 部分将由双方人员共同实施并签署各项调试、验收的有关报告。

自动进出料系统用户需求User’s Request Specification文件编号:版本号:编制:审核:批准:1、目的该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
2、范围本文件的范围涉及到了对此定制冻干机移动式自动进出料系统的要求,供应商应以URS将作为详细设计以及报价的基础。
供应商在设计、制造、组装时必须要按照URS来执行。
3、缩略词列表Term 术语Definition 定义CD Compact Disc压缩磁盘EU-GMP European –Good Manufacturing Practice欧盟药品质量管理规范FAT Factory Acceptance Test出厂验收测试GAMP Good Automated Manufacturing Practices良好的自动生产规范GMP Good Manufacturing Practices药品生产质量管理规范HMI Human Machine Interface人机界面IQ Installation Qualification安装确认ISO International Standards Organization国际标准组织MOC Material Of Construction建筑材料OQ Operational Qualification运行确认Ph Phase阶段P&ID Process and Instrument Diagram.工艺流程图PLC Programmable Logic Controller可编程逻辑控制器RTD Resistance Temperature Device 电阻温度设备SAT Site Acceptance Test现场验收测试SOP Standard Operating Procedures标准操作规程SS Stainless steel不锈钢WFI Water For Injection注射用水EPDM Ethylene―Propylene―Diene tripolym er 三元乙丙橡胶Hypalon 氯磺化聚乙烯4、设备标准设备必须符合以下标准、规范:4.1 GMP 法规●中华人民共和国药典(2010版)●药品生产质量管理规范(2010版)●中华人民共和国药品管理法实施条例4.2 行业标准设计、制造、材料、所有部件的供应以及配置必须基于并符合中国相关规范、要求和准则。


我对冷冻干燥技术的原理、冻干机组成、冻干参数、冷冻干燥的程序、影响冷冻干燥过程的因素、冻干制品不合格现象和解决方法的学习心得。
第一节冷冻干燥技术原理干燥是保持物质不腐败变质的方法之一。
干燥的方法有许多,如晒干、煮干、烘干、喷雾干燥和真空干燥等。
但这些干燥方法都是在0℃以上或更高的温度下进行。
干燥所得的产品,一般是体积缩小、质地变硬,有些物质发生了氧化,一些易挥发的成分大部分会损失掉,有些热敏性的物质,如蛋白质、维生素会发生变性。
微生物会失去生物活力,干燥后的物质不易在水中溶解等。
因此干燥后的产品与干燥前相比在性状上有很大的差别。
而冷冻真空干燥法不同于以上的干燥方法,产品的干燥基本上在0℃以下的温度进行,即在产品冻结的状态下进行,直到后期,为了进一步降低干燥产品的残余水分含量,才让产品升至0℃以上的温度,但一般不超过40℃。
溶剂效应在药物化学合成中涉及到的有机反应,许多都需要溶剂存在下才能进行。
加入溶剂往往不仅是为了改善反应物料的传质和传热,而且由于许多溶剂分子还能与反应试剂的微粒相互作用,围绕这些微粒形成溶剂膜,从而能够改变微粒的自由能和电子结构。
溶剂的这种作用将对反应速率产生影响,有时还会改变反应历程和定向。
因此,溶剂的使用是关键。
溶液:溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质(溶质)以分子或更小的质点分散于另一物质(溶剂)中。
溶质,溶液中被溶剂溶解的物质。
溶质可以是固体:如溶于水中的糖和盐等、液体:如溶于水中的酒精等、或气体:如溶于水中的氯化氢气体等。
溶剂(solvent)广义指在均匀的混合物中含有的一种过量存在的组分。
狭义地说,在化学组成上不发生任何变化并能溶解其他物质(一般指固体)的液体;或者与固体发生化学反应并将固体溶解的液体。
溶解生成的均匀混合物体系称为溶液,在溶液中过量的成分叫溶剂;量少的成分叫溶质。
溶剂也称为溶媒,即含有溶解溶质的媒质之意。
但是在工业上所说的溶剂一般是指能够溶解固体化合物(这一类物质多数在水中不溶解)而形成均匀溶液的单一化合物或者两种以上组成的混合物,这类除水之外的溶剂称为非水溶剂或有机溶剂,水、液氨、液态金属、元机气体等则称为无机溶剂。

冻干系统之自动进出料在冻干粉针药品生产中,为了更好地保证产品的质量及更好地控制风险,更多地借助于自动进出料系统和隔离装置。
上一篇文章中已经为您介绍了隔离系统,本文则为您介绍自动进出料系统。
随着技术的进步和认识的不断提高,制药企业对无菌生产的要求越来越严格。
在冻干粉针药品的生产过程中,为了控制人员对药品的污染、更好地保证产品的质量和更好地控制风险,自动进出料系统在药厂的应用愈加普及。
2007年东富龙自主研制了冻干机自动进出料系统,并获得国家专利。
这不仅填补了当时国内同行业的空白,而且达到国际先进水平,对于制药行业自动化程度的提高和药品的无菌保证都具有划时代的意义。
根据自动进出料系统的自动化程度,可以将其分为半自动进出料系统和全自动进出料系统两大类;其中,全自动进出料系统根据设备形式又可以分为:(1)移动式自动进出料系统;(2)固定式自动进出料系统;(3)混合式自动进出料系统。
半自动进出料系统配备半自动进出料的冻干机有以下几个特点:(1)冻干机无等高进料功能;(2)冻干机仅通过开大门进料,无小门;(3)半加塞西林瓶需要套框后再进料。
半自动进出料系统优点在于,投入很少的成本即可完成对老车间冻干转运系统的改造,实现无风险的搬运和传送,取代了原来的人工操作模式,大大提高了生产效率,满足了无菌转运的要求。
半自动进出料系统分为整列系统、转运系统和脱框系统三大部分;整列及输送部分主要与灌装机相接,对灌装后的西林瓶进行整理装框,根据不同设备的要求,可以做成手动形式或自动形式,主要有平台式套框装置、网带式套框装置、螺杆理瓶套框装置以及星轮理瓶套框装置等;转运系统分为网带式和小车式;脱框系统分为人工脱框和自动脱框。
半自动进出料全自动进出料系统配备全自动进出料的冻干机必须满足以下几个条件:(1)冻干机必须带有进出料的小门,并且可以实现自动开闭;(2)冻干机板层可以实现等高位置的进出料,也就是说所有板层的进出料全部在同一个高度;(3)板层定位精度要求高,可以实现与自动进出料装置的无缝对接;(4)板层两侧带有导向轨道。
一、真空冷冻干燥原理真空冷冻干燥(简称冻干)是将含水物质先冻结成固态,然后使其中的水份从固态升华成气态,从而除去水份而保存物质的方法。
1.冻干的优点:冻干与通常的晒干、煮干、喷雾干燥及真空干燥相比有如下突出的优点。
a.冻干是在低温下干燥的,不会使蛋白质产生变性,但可使微生物等失去生物活力。
这对于那些热稳定性能差的生物活性制品、生物化学类制品、基因工程类制品和血液制品等的干燥保存特别适用。
b.由于是低温干燥,使物质中的挥发性成分和受热变性的营养成分和芳香成分损失很小,因此是化学制品、药品和食品的优质干燥方法。
c..在低温干燥过程中,微生物的生长和酶的作用几乎无法进行,从而能最好地保持物质原来的性状。
d.干燥后体积、形状基本不变,物质呈海绵状,无干缩,复水时与水的接触面大,能迅速还成原来的形状。
e.因一般是在真空下干燥,故氧气极少,使易氧化的物质得到了保护。
f.能除去物质中95%~99.5%的水分,制品的保存期长。
2.冻干的应用冻干是一种优质的干燥方法。
但是它需要比较昂贵的专用设备,干燥过程中的能耗较大,因此加工成本较高,目前主要应用在以下几个方面。
a.生物制品、药品方面:如抗菌素、抗毒素、诊断用品和疫苗的保存。
b.微生物和藻类方面:如各种细菌、酵母、酵素、原生动物、微细藻类等的长期保存。
c.生物标本、生物组织方面:如制作各种动植物标本,干燥保存用于动物异种或同种移植的皮肤、骨骼、主动脉、心瓣膜等边缘组织。
d.制作用于光学显微镜、电子扫描和透射显微镜的小组织片。
e.食品的干燥方面:如咖啡、茶叶、肉鱼蛋类、海藻、水果、蔬菜、调料、豆腐、方便食品等。
f.高级营养品及中草药方面:如蜂王浆、蜂蜜、花粉、中草药制剂等。
g.超细微粉的制备方面:如制取Al2O3、ZrO2、TiO2、Ba2Cu3O7~8、Ba2Ti9O20等超细微粉。
h.其他方面:如化工中的催化剂,冻干后可提高催化效率5~20倍;将植物叶子、土壤冻干保存,用以研究土壤、肥料、气候对植物生长的影响及因子的作用;潮湿的木制文物、淹坏的书籍稿件等用冻干法干燥,能最大限度地保持原状等。
冻干快冻与慢冻比较(5篇)第一篇:冻干快冻与慢冻比较1.慢冻和快冻主要是根据制品的情况来决定的,不同的制品采用不同的降温速度,因为这样做的目的是改变制品内部的晶型结构,利于制品的快速升华,慢冻的速度一般是1℃/min,快冻的速度一般是10-50℃/min2.制品冻结速度的快慢是影响制品质量的重要因素,同一体积的药业,快速冷冻形成的冰晶体小,其冻干升华的表面积较大,可加快制品升华干燥的过程;慢速冷冻形成的冰晶体大,溶质晶核与冰之间的间隙较大,利于深层冻结体升华水分排出,也可缩短干燥时间采用速冻方法的成品粒子细腻,外观均匀,比表面积大,多孔结构好,溶解速度快;慢冻形成粗晶在升华时留下的空隙较大,可提高冻干效率,但是外观没有速冻的好快冻~隔板提前预冻~降温一般-35°下,制品再进箱冻结.慢冻~制品进箱后,开机冻干,隔板与制品一起降温冻结.冷冻速率的快慢会影响冰晶尺寸的大小,因此也会影响干燥产品的质量。
冷冻过程中,冰晶的数量和大小受二个因素影响,即成核速率和晶体生长速率,而这二者都受温度的影响。
在0℃时晶体的生长速率增加,而成核速率很低,因此在0℃保持一段的时间将产生数量少而尺寸大的晶体,在低于0℃以下的温度冻结时将得到数量多而尺寸小的晶体。
冰晶的大小也影响干燥速率和干燥后产品的溶解速度和产品质量。
大的冰晶利于升华,小的冰晶不利于升华;大的冰晶溶解慢,小的冰晶溶解快;冰晶越小干燥后越能反映产品的原来结构。
第二篇:冻干车间岗位职责书冻干车间岗位职责书1车间主任岗位职责⑴车间工作计划制订及组织实施:根据公司下达的,月生产量,制定出、月工作计划;⑵生产技术、质量的稳定与提高:对产品质量、工艺技术的监控,督促技术员、班长定期召开技术分析会及质量分析会;指导技术员进行技术攻关活动;指导技术员工作;⑶人员培训及人才培养:负责并组织实施对车间员工工作标准、专业技能、员工心态等相关知识的培训;负责全车间人员有关制度条例及企业文化的培训;负责对对全车间人员传达公司及厂部的精神;⑷成本核算与控制:指导车间物料员的工作;定期检查车间物料、动力统计;每月就生产物资、动力、工资与物料员进行成本分析,材料上报厂部留档;⑸员工管理与协调:根据生产任务对车间人员岗位进行合理调配;2技术员岗位职责⑴质量管理与控制:对生产过程进行全面质量监督与控制,对产品请验与分析;⑵生产技术研究改进:提高车间现有产品质量,改善现有产品的工艺条件,对车间生产过程中出现的技术问题进行技术攻关;⑶发布指令:根据生产计划及工艺要求会同生产部计划小组发布生产指令;⑷生产工艺技术、技能培训:对车间员工进行生产工艺、GMP、SOP等相关知识培训及考核;⑸生产记录整理归档:审核、整理生产原始记录,并按时交到质保部归档。
LYO-3(SIP、CIP)型真空冷冻干燥机再确认报告目录1.确认情况概述………………………………………………………………………1.1适用范围…………………………………………………………………………1.2.设备概况…………………………………………………………………………1.3确认内容及目的…………………………………………………………………1.4再验证……………………………………………………………………………2.确认前准备…………………………………………………………………………2.2温度探头前校准………………………………………………………………2.3指示剂确认……………………………………………………………………2.4.培训………………………………………………………………………………3.运行确认…………………………………………………………………………3.1安全性能测试……………………………………………………………………3.2与自动进出料通讯的确认……………………………………………………3.3空载测试…………………………………………………………………………3.4捕水量测试………………………………………………………………………3.5化霜程序测试……………………………………………………………………3.6.过滤器完整性确认……………………………………………………………4.性能确认……………………………………………………………………………4.1在位清洗(CIP)功能测试………………………………………………………4.2在位灭菌(SIP)功能测试…………………………………………………………4.3挑战性实验……………………………………………………………………5.确认后风险评估……………………………………………………………5.LRPN打分……………………………………………………………5.2确认后的风险分析……………………………………………………………6.温度探头后校准……………………………………………………………7.偏差及变更…………………………………………………………………………7.1偏差……………………………………………………………7.2变更……………………………………………………………8.验证结果小结……………………………………………………………9.验证结论及总结……………………………………………………………10.附件……………………………………………………………1.确认情况概述1.1适用范围本报告适用于2110冻干房的LYO-3(SIP、CIP)型真空冷冻干燥机的确认,本设备主要用于药品的冷冻干燥。
冻干机全自动进出料系统简述全自动进出系统设备四、对全自动进出料系统基本认识情况《全自动进出料系统》分为三种:1、移动式自动进出料方式2、固定式进出料系统方式3、混合式自动进出料系统三种方式。
(一) 移动线自动进出料系统的组成1、进料集成系统INT-LOADING(与上游灌装机相集成衔接)2、自动进料理瓶系统IS(实现西林瓶的自动嵌套整列功能)3、自动导向小车AGV(实现西林瓶的自动装运功能)4、转运轨道X-RAIL(实现自动导向小车AGV X坐标的精确定位)5、自动出料系统OS(实现西林瓶的自动卸载功能)6、出料集成系统INT-UNLOADING(与下游轧盖机相集成衔接)7、无菌隔离系统(可作为与移动式小车型自动进出料系统相集成)8、控制系统移动式自动进出料系统的特点1、能够满足多台冻干机的进出料(三台冻干机最为经济)2、无菌室内冻干机大门套小门的设计方式3、一块隔板可一次性完成装卸料4隔离器适合做LAF和oRABS(二)固定式进出料系统的组成1、进料集成系统(与上游灌装机相集成衔接)2、自动进料理瓶系统(实现西林瓶的自动嵌套整列功能)3、自动进料过度桥系统(实现与冻干机隔板精确对接功能4、自动出料系统(实现西林瓶的自动卸载功能)5、出料集成系统(与下游轧盖相集成衔接)6、无菌隔离系统(可作为与固定式过度桥型自动进出料系统相集成固定式自动进出料系统特点1、能够满足单台式多台冻干机的进出料(单台或两台冻干机最为经济)2、冻干机大门作为例行检修用而设计位于机修室,无菌室内冻干机只设计带有进出料小门3、无菌隔离器适合做LAF,RABS,CRABS,ISOLATOR.4、适合低温进出料工艺(西林瓶直接装载入低温控制的冻干机隔板中5、可以兼容考虑水针生产线(一线两用:可兼顾冻干粉针和水针线)6、设计布局紧凑,占地面积小。
(三)混合式自动进出料系统方式A、进料侧1、进料集成系统(与上游灌装机相集成衔接)2、自动进料理瓶系统(实现西林瓶的自动嵌套整列功能)3、自动进料过滤桥系统(实现与冻干机隔板精确对接功能)4、无菌隔离器系统5、控制系统B、出料侧1、自动导向小车AGV(实现西林瓶的自动装运功能)2、转运轨道X-RAIL(实现自动导向小车AGV X坐标的精确定位3、自动出料系统(实现西林瓶的自动卸载功能)4、出料集成系统(与下游盖轧机相集成衔接)5、无菌隔离系统(可作为选项相集成)6、控制系统混合式自动进出料系统的特点1、能够满足多台冻干机群的进出料(四台冻干机最为经济)2、冻干机生产班次灵活,在进料的同时也可以进行出料。