鲁教版九年级化学上册溶液的形成
- 格式:pptx
- 大小:2.48 MB
- 文档页数:29


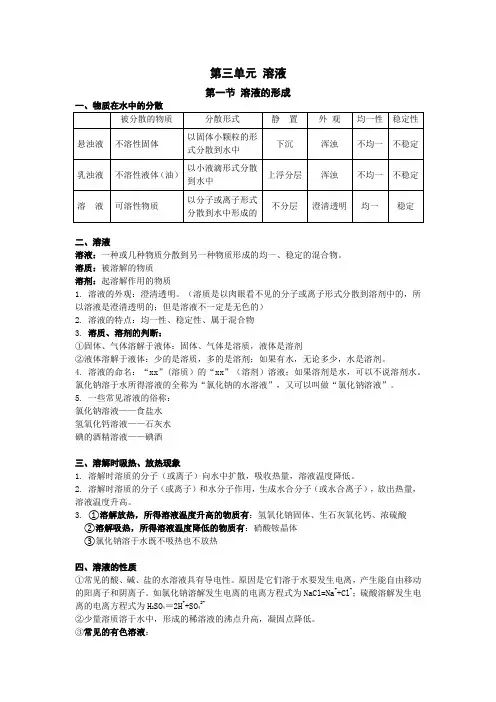
第三单元溶液第一节溶液的形成一、物质在水中的分散二、溶液溶液:一种或几种物质分散到另一种物质形成的均一、稳定的混合物。
溶质:被溶解的物质溶剂:起溶解作用的物质1.溶液的外观:澄清透明。
(溶质是以肉眼看不见的分子或离子形式分散到溶剂中的,所以溶液是澄清透明的;但是溶液不一定是无色的)2.溶液的特点:均一性、稳定性、属于混合物3.溶质、溶剂的判断:①固体、气体溶解于液体:固体、气体是溶质,液体是溶剂②液体溶解于液体:少的是溶质,多的是溶剂;如果有水,无论多少,水是溶剂。
4.溶液的命名:“xx”(溶质)的“xx”(溶剂)溶液;如果溶剂是水,可以不说溶剂水。
氯化钠溶于水所得溶液的全称为“氯化钠的水溶液”,又可以叫做“氯化钠溶液”。
5.一些常见溶液的俗称:氯化钠溶液——食盐水氢氧化钙溶液——石灰水碘的酒精溶液——碘酒三、溶解时吸热、放热现象1.溶解时溶质的分子(或离子)向水中扩散,吸收热量,溶液温度降低。
2.溶解时溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量,溶液温度升高。
3.①溶解放热,所得溶液温度升高的物质有:氢氧化钠固体、生石灰氧化钙、浓硫酸②溶解吸热,所得溶液温度降低的物质有:硝酸铵晶体③氯化钠溶于水既不吸热也不放热四、溶液的性质①常见的酸、碱、盐的水溶液具有导电性。
原因是它们溶于水要发生电离,产生能自由移动的阳离子和阴离子。
如氯化钠溶解发生电离的电离方程式为NaCl=Na++Cl-;硫酸溶解发生电离的电离方程式为H2SO4=2H++SO42-②少量溶质溶于水中,形成的稀溶液的沸点升高,凝固点降低。
③常见的有色溶液:蓝色溶液(含Cu 2+):硫酸铜溶液,氯化铜溶液,硝酸铜溶液浅绿色溶液(含Fe 2+):硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液黄色溶液(含Fe 3+):硫酸铁溶液,氯化铁溶液,硝酸铁溶液 紫红色溶液:高锰酸钾溶液 紫色溶液:石蕊溶液五、饱和溶液与不饱和溶液1. 定义:在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。


3.1《溶液的形成》(第一课时)教学设计-鲁教版核心素养目标变化观念与平衡思想:通过对食盐溶解过程的微观揭秘,学会从微观角度理解溶解的过程,建立微粒观;认识溶液的基本特征,能判断典型溶液中的溶质、溶剂;科学探究与创新意识:通过探究物质溶解时温度的变化,了解实验探究的基本过程;知道溶解时的能量变化与微粒运动有关,初步建立能量观;科学精神与社会责任:掌握乳化的原理,并了解溶液对自然界的生命活动以及人类生产生活的重要意义。
教学重难点及解决措施教学重点:溶液的相关概念,物质溶解过程中的能量变化教学难点:从微观角度理解溶液的形成过程解决措施:注重从生活实际和学生的生活经验出发,借助动画和演示实验境 【情景创设】播放图片:生理盐水的相关信息【提出问题】1.氯化钠注射液是无色的,它是纯净物还是混合物?2.氯化钠是怎样溶解于水中的?一探:【提问】将一定量的食盐放入水中,搅拌,静置,观察现象。
食盐去哪儿了?【微观探源-播放食盐溶解的动画】【微观探源-播放蔗糖溶解的动画】二探:液【展示图片-生活中常见的溶液】【提问】1.生理盐水的上部、中部、下部、任一处是否都一样咸?说明了溶液具有什么特征?2.如果把生理水密封,保存一个月、一年、两年,猜测会不会从中析出食盐颗粒?说明溶液具有什么特征?【提问】深入理解溶液的概念1、均一、稳定的液体一定是溶液吗?2、溶液一定是无色的吗?3、溶液一定是液态的吗?【讲解】溶液中溶质和溶剂的判断,并展示常见的溶液,让学生根据规则进行判断三探:质 时 的 【情境导入并提问】为什么摇一摇就能使饮料变冰呢?思考、判断【引导】设计实验【演示实验】氢氧化钠和氯化铵溶于水后溶液温度的变化【讲解】溶解过程中的微观变化【呈现图片】溶液在生产生活中的重要价值乳 化 【提问】洗涤剂为什么能除去餐具上的油污呢?【演示实验】洗涤剂和油污作用【讲解】乳化的原理【提问】洗涤剂和汽油都能洗掉油污,去污原理相同吗?归 纳 讨论、交流、表达、最后归纳出溶液化。




鲁教版九年级化学上册溶液的形成知识点溶液是由一种或几种物质分散到另一种物质里,组成的均一、稳定的混合物。
由为您提供的溶液的形成知识点,希望给您带来启发!知识点1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性的混合物注意:a、溶液不一定无色,如CuSO4为蓝色 FeSO4为浅绿色 Fe2(SO4)3为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量 = 溶质的质量 + 溶剂的质量溶液的体积溶质的体积 + 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒碘的酒精溶液)固体、气体溶于液体,液体为溶剂2、溶质和溶剂的判断有水,水为溶剂,液体溶于液体,无水,量多的为溶剂。
3、饱和溶液、不饱和溶液(1)概念:(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解(3)饱和溶液和不饱和溶液之间的转化注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl课后练习及解析1.(2013 莱芜中考)下列物质加入适量水中充分搅拌,能够得到溶液的是( )A.碳酸钙B.植物油C.面粉D.蔗糖【解析】选D。
本题考查对溶液相关知识的掌握能力。
解答本题的关键应明确两点:(1)溶液的概念;(2)常见物质的溶解性。
蔗糖能溶于水,加入适量的水可形成溶液,而碳酸钙、植物油和面粉都不溶于水,不能形成溶液。
2.可以作为溶质的是( )A.只有固体B.只有液体C.只有气体D.气体、液体、固体都可以【解析】选D。


鲁教版初三化学上册溶液的形成知识点液体溶液包括两种,即能够导电的电解质溶液和不能导电的非电解质溶液,网为您提供的溶液的形成知识点,希望给您带来启发!知识点一、溶液的形成1、溶液:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,叫做溶液。
①均一:各部分性质、浓度、密度、色泽等相同。
②稳定:当水分不蒸发、温度不变化时,溶液不分层、不沉淀。
溶质:被溶解的物质(可以是气体、液体和固体)。
溶剂:能溶解其它物质的物质(常见的溶剂:水、酒精、汽油;溶液中有水存在时,一般把水作为溶剂;)2、能区分溶液中的溶质、溶剂(如:碘酒、糖水、生理盐水、高锰酸钾的水溶液、石灰水);3、知道溶液、溶质、溶剂之间的质量关系(溶液质量=溶质质量+溶剂质量)及质量比。
4、知道生活中的一些常见的乳浊液:小液滴分散到液体里形成的混合物。
(不属于溶液)生活中常见的乳化现象:如:肥皂漂洗衣服、洗洁精洗碗筷、牛奶、农药等。
二、饱和溶液和不饱和溶液1、在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液是饱和溶液;反之为不饱和溶液。
2、饱和溶液和不饱和溶液之间的转换:①增加溶质;②蒸发溶剂;③降低温度;①增加溶剂;②升高温度;结晶:已溶解在溶液中的溶质从溶液中以晶体的形式析出的现象,叫做结晶。
(结晶和溶解都属于物理变化)。
(结晶方法:蒸发结晶和降温结晶)三、物质溶解与温度的关系⑴酸碱溶于水,放出热量,温度上升;如:硫酸、氢氧化钠等。
⑵绝大多数的盐溶于水,吸收热量,温度下降;如:硝酸钾、氯化铵等。
⑶蔗糖、食盐溶于水温度不变。
课后练习1.下列叙述中,正确的是( )A.悬浊液、乳浊液、溶液都是混合物B.溶液里溶质只能有一种C.溶质可以是固体、液体、气体,但溶剂只能是液体D.透明、澄清的液体都是溶液2. 下列物质中,属于溶液的是( )A.牛奶B.豆浆C.冰水D.糖水3.下列关于溶液的叙述中,正确的是( )A.溶液都是无色的B.溶液不一定是混合物C.溶液都是纯净物D.溶液一定是混合物4.下列关于蔗糖溶液的说法中,正确的是( )A.蔗糖溶于水就消失了B.蔗糖水下部的浓度比上部大C.蔗糖水恒温放置,不会析出晶体D.蔗糖水不具有蔗糖的化学性质5.对溶液基本特征叙述正确的是( )A.溶液是均一、稳定、无色透明的液体B.凡是均一、稳定透明的液体就是溶液C.一杯调好的糖水,喝第一口特别甜,越喝越不甜,说明后面喝的糖水含糖少D.当条件不变时,溶液虽然放置时间较长,溶质也不会从溶液中分离出来答案:1.A2.D3.D4.C5.D溶液的形成知识点的全部内容就是这些,预祝大家在新学期可以更好的学习。