小鼠常用采血方法
- 格式:pptx
- 大小:8.12 MB
- 文档页数:15

小鼠采血及给药方法
小鼠采血方法:
1. 选择小鼠的尾部静脉为采血点。
2.事先将小鼠置于温暖的环境中,保持鼠体温度较高,有助于
血流畅通。
3.用70%乙醇消毒小鼠尾部,待干后将尾部静脉突出。
4.使用一段带有注射器的采血针,将针尖插入静脉内,逐渐将
血吸入注射器中。
5.采取适当的采血量,通常不超过小鼠总体重的1%。
6.采血完毕后,将小鼠放回舒适的环境,并检查是否有出血或
感染。
小鼠给药方法:
1. 可以考虑口服给药:将给药物质制成溶液或混悬液,使用小鼠专用的给药针或胃管轻轻将药物注入小鼠口中。
2. 可以考虑皮下注射给药:使用一次性注射器和细针,轻轻将药物注射到小鼠的颈部、背部或腹部皮下。
3. 可以考虑静脉注射给药:将小鼠固定在注射台上,通过尾静脉或静脉突出的其他部位进行注射,使用适当大小的注射器和针头。
4. 可以考虑腹腔注射给药:将小鼠固定在注射台上,轻轻将药物注射到小鼠的腹腔内,使用适当大小的注射器和针头。
5. 必要时,可以使用气管插管或静脉插管等专业仪器辅助给药。
值得注意的是,在进行任何操作之前,应该对小鼠的器官位置、给药剂量和频率等进行仔细研究和规划,并严格遵守动物实验
伦理的相关规定。
在操作过程中要注意对小鼠的痛苦程度进行评估,并在必要时使用麻醉药物减轻疼痛。

大鼠和小鼠的采血方法1.麻醉方法:在采血前,先给大鼠或小鼠进行麻醉,以减少它们的疼痛感受。
常用的麻醉方法有以下几种:-静脉麻醉:将合适剂量的麻醉剂通过尾静脉或背静脉注射给大鼠或小鼠,使其进入麻醉状态。
-吸入麻醉:将麻醉气体或气溶胶通过麻醉箱或麻醉罩给大鼠或小鼠吸入,达到麻醉效果。
-局部麻醉:将麻醉剂涂抹在采血部位的皮肤上,使局部麻木,减少疼痛感。
2.采血部位:常用的大鼠采血部位有尾静脉、颈静脉、眼眶突静脉等,而小鼠采血部位则有尾静脉、颈静脉、眼眶突静脉、前肢静脉等。
3.采血工具和器材:-采血针:选择合适大小的采血针,不同大小的动物需要选择不同规格的针头。
-注射器:用于抽取和储存血液样本的容器。
常用的有离心管、毛细管等。
-注射器插管:将采集到的血液导入注射器中储存。
4.采血方法:-尾静脉采血:将大鼠或小鼠的尾巴用温水浸泡,使其尾部静脉扩张。
然后用酒精消毒尾巴,用手指轻轻压住尾部静脉靠近尾根的部位,使尾尖鼓胀,再用采血针针尖刺破尾尖的皮肤,顺着静脉方向将血吸入注射器中。
-颈静脉采血:将大鼠或小鼠定位于侧卧位,用酒精消毒颈部的皮肤。
手指轻轻压住颈侧的静脉,使其充血,然后用采血针针尖针插入触及到静脉,将血液吸入注射器中。
-眼眶突静脉采血:先给大鼠或小鼠进行眼眶突的局部麻醉,随后用消毒酒精将眼眶突部分消毒。
再用适当大小的针头插入眼眶突静脉,将血液抽取到注射器中。
5.采血后的处理:-停血:采血后需用无菌棉球或无菌纱布轻轻按住针刺处,让血液凝结停止流血。
-保存:将采集到的血液样本转入离心管中,用离心机离心,分离血浆和血细胞。
将血浆或血细胞储存在冷冻管中,冷冻保存。
以上就是大鼠和小鼠采血的最全方法。
在进行采血操作时,需要注意动物的麻醉和疼痛管理,操作要轻柔、快速、准确,以减少动物的痛苦和疼痛。
另外,为了确保采血的科学性和准确性,还需要遵守实验室的相关规范和伦理要求,确保实验与动物实验道德的合理性。

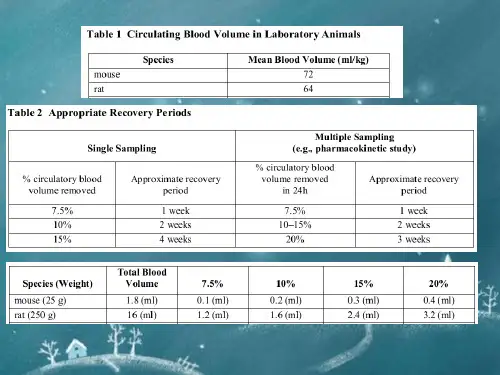
常见实验小鼠采血方法小鼠是科研实验中常用的实验动物,但由于其体积小,血管细,采血难度大,进而影响采血的质量,小编简要总结了常见的小鼠采血方法,仅供参考:一只成年小鼠的循环血量大约是1.5~2.5ml,大约体重的6~8%。
在对营养状况良好的小鼠进行采血时,单次采血量最多可以到达循环血量的10%,(例:若20克小鼠,它的总血量约占1.2-1.4毫升,即每次取120ul-140ul血液不会对小鼠有太大的影响)。
采血之后应该给予温热的等渗溶液补充,可以在2~3个星期内恢复原有的水平。
两周采血量小于血液循环的10%,单周小于7.5%,小鼠血液循环72ml/kg实验室常用抗凝剂:乙二胺四乙酸(EDTA)盐、枸橼酸盐、草酸盐、肝素实验室常用采血管:(采血后立即颠倒混匀8次)1.黑色:枸橼酸钠;血沉2.浅蓝色:枸橼酸钠;血凝试验(如PT、APTT)3.深蓝色:肝素钠或EDTA-Na2;血液微量元素4.紫色:EDTA-K2;血常规(血液细胞分析)5.绿色:肝素锂;大部分生化、血氨6.灰色:血糖降解抑制剂和EDTA-Na2;血糖7.棕色:肝素钠或EDTA-K2;血铅8.浅黄色ACD管:葡萄糖、抗凝剂;血库试验9.浅黄色SPS管:SPS液、氯化钠溶液;血液培养、微生物培养尾尖采血麻醉小鼠后,用温水(但水温不要过高)擦拭尾巴,引起轻微的血管扩张。
用无菌手术刀、刀片或锋利的剪刀,快速截断小鼠尾尖0.5-1cm。
如果需要多次采血,之后每次仅需截除2-3mm。
可以从尾部向尾尖方向按摩,以增加血流(但是,这会降低血样的质量,增加溶血的风险)。
可以用毛细采血管收集血液,或直接滴入收集管中。
采血结束后,按压伤口或使用止血剂(如硝酸银,6%液体火棉胶)来止血。
每次采血量大约可达0.1ml。
眼眶静脉丛采血优点:眼眶后静脉丛采血法方法简单,便于掌握。
血流较快,采血量多,能在较短时间内采约0.5mL血。
伤口较小,愈合较快。
成功率高,死亡率低。

小鼠眼球取血技巧小鼠摘除眼球采血及分离血清一.器材离心管,弯头镊子,离心机,移液器二.步骤1. 摘除眼球采血(1)左手拇、食指抓取小鼠双耳及颈后皮肤,小指固定尾部;(2)中指将小鼠左侧前肢轻压在胸骨心脏部位,无名指按在腹部,捻动拇指,轻压取血侧眼部皮肤,使眼球充血突出;(3)用弯头镊夹取眼球;(4)根据需要捻动拇指与食指的方向,使血液从眼眶内以不同速度垂直流入离心管;(5)同时用左手中指轻按小鼠心脏部位,以加快心脏泵血速度;(6)当血液流尽时,用脱臼法处死小鼠。
2. 分离血清(1)将离心管中的血置37℃温箱或水浴1小时,也可室温2小时;(2)再置4℃冰箱内3~4小时或过夜;(3)待血液凝固血块收缩后,4000rpm离心10分钟;(4)取上清于干净的离心管中,保存于-20℃,或加入防腐剂(0.01%硫柳汞或0.02%叠氮钠),置4℃冰箱中保存备用。
三.注意:1. 采血前,可给小鼠喂点水;2. 摘眼球采血取血量能达0.8~1.2ml,但老年和疾病小鼠血量会降低;3. 采血场所有充足的光线;室温夏季保持在25~28℃,冬季,15~20℃为宜;4. 防止血液浸入眼部周围毛发,否则会造成污染和溶血;5. 按压心脏时,用力一定要适度,若用力过度,一是会造成动物采血中途死亡,使采血不完全,二是有可能引起溶血现象发生,影响实验结果;6. 采血用的器材和试管必须保持清洁干燥;7. 采血时要防止小鼠挣扎,否则会损失比较多的血样;8. 血液凝固后不宜在4℃放置过久,否则会溶血。
另附其他几种采血方法1)尾尖取血:当所需血量很少时采用本法。
固定动物并历出鼠尾,将鼠尾在45℃温水中浸泡数分钟,也可用二甲苯等化学药物涂擦,使局新血管扩张。
将鼠尾擦干,剪去尾尖,血自尾尖流出,让血液滴入盛器或直接用移液器吸取。
如需间隔一定时间,多次采取鼠尾尖部血液,每次采血时,将鼠尾剪去很小一段,取血后,先用棉球压迫止血并立即用6%液体火棉胶涂于尾巴伤口处,使伤口外结一层火棉胶薄膜,保护伤口。

实验小鼠给药与采血方法1.实验小鼠给药方法:a.静脉注射:i.静脉注射是一种常用的给药方法,适用于需要迅速将药物输送到循环系统中的实验。
ii. 首先,选择小鼠尾静脉作为给药途径。
悬空小鼠尾部并握紧尾根,使用角度较小的针头(例如26G针头)直接注射药物。
iii. 注射前,可以先用温水或者温湿纱布预热小鼠的尾部,以增强血管的扩张和血流。
iv. 确认成功注射药物后,将小鼠放回饲养笼中,并观察其行为和健康状况。
b.口服给药:i.口服给药是一种常用的给药方法,适用于需要药物通过消化系统进行吸收的实验。
ii. 在给药前,可以在小鼠笼子的饮水中添加药物溶液,或将药物悬浮液灌注到小鼠胃部。
iii. 同时,在给药过程中,需要将小鼠固定住,可以使用实验动物颈环进行固定。
iv. 给药后,观察小鼠的饮食情况和健康状况,并适当调整药物剂量和给药方式。
2.实验小鼠采血方法:a.尾静脉采血:i.尾静脉采血是一种常用的、非常便捷的小鼠采血方法。
ii. 首先,选择小鼠尾部静脉作为采血部位。
悬空小鼠尾部并使用温湿纱布加热,以增加血管扩张和血流。
iii. 使用角度较小的针头,例如26G针头,刺入尾静脉,然后将血收集到适当的试管中。
iv. 在采血过程中,保持顺利的血流,可以使用温湿纱布加热尾部以保持血管扩张。
v.采集到所需血液样本后,用棉球或止血带对采血部位施加轻压,以避免出血和感染。
vi. 采血结束后,观察小鼠的健康状况,并给予适当的处理和护理。
b.眼窝静脉注射采血:i.眼窝静脉采血是一种比较特殊的小鼠采血方法,适用于需要大量血液样本的实验。
ii. 在采血前,可以使用温湿纱布加热小鼠眼部,以增加血管扩张和血流。
iii. 使用角度较小的针头,例如26G针头,插入眼窝静脉并拔回,将血液从针头收集到适当的试管中。
iv. 在采血过程中,保持稳定的手部和注射器位置,以避免对小鼠造成伤害。
v.采集到所需血液样本后,用棉球或止血带对采血部位施加轻压,并进行适当的处理和护理,以减少对小鼠的不适和伤害。

小鼠采血及给药方法一、小鼠采血方法1.静脉采血法:(1)静脉穿刺法:将小鼠固定在实验台上,清洁采血部位(常常是尾静脉),用适当的方法固定小鼠尾部,例如用取血夹固定。
用消毒棉球涂抹于采血部位,利用一只针筒或采集针对静脉进行穿刺。
(2) 尾静脉切割法:先用消毒棉球涂抹于小鼠尾部静脉附近,接着使用锋利的剪刀剪切尾部皮肤,直到出现静脉。
使用脱针管(micro-hematocrit tube)将血液抽吸出来。
采血结束后,可用消毒剂处理采血点,以防止感染。
2.额高度法:采用颅内针,固定小鼠在颅骨穿刺装置上,选用滑动固定针。
先用洗净针按住头部,再通过颅针插入到穿刺装置中。
同时使用抽吸器抽取出血液。
3.围尾车压法:将小鼠固定在一块平板上,用三个围绳将其尾部固定,留一个关节使小鼠尾部随意摆动。
在上方围绳旁边的固定处架设一只容器,用于收集滴下的尾血。
二、小鼠给药方法1.口服给药:该方法较简单,将药物以适当的剂量溶解于注射用水或生理盐水中,用灌胃针或注射器将药液直接灌入小鼠口腔中。
要确保给药的准确剂量和流量,避免嗓子喉咙堵塞。
2.腹腔注射法:将小鼠放在工作台上,用适当的方法固定小鼠身体,清洗注射部位。
用消毒棉球涂抹于腹部,使用22-25号注射针或微量注射器将药物缓慢注射入腹腔。
注射速度要控制得适当,避免损伤内脏器官。
3.尾静脉注射法:将小鼠固定在工作台上,清洁尾部毛发,用爪式血管夹固定尾部血管。
使用注射针插入尾静脉,并注意发现血斗标志。
缓慢将药物注射入尾静脉。
4.静脉注射法:将小鼠固定在工作台上,清洗注射部位。
用消毒棉球涂抹于注射部位(通常是尾静脉),固定小鼠尾部。
使用注射针或微量注射器将药物注射入静脉。
5.肌肉注射法:将小鼠放在工作台上,用适当的方法固定小鼠身体。
将药物以适当的剂量溶解后,使用注射针插入小鼠腹股沟或胫肌中缓慢注射。
以上是小鼠采血及给药的常用方法,注意采血和给药的操作应该规范、缓慢、准确,以避免对小鼠造成不必要的伤害。


小鼠取血方法范文小鼠是常用的实验动物之一,常需要从小鼠身上进行取血以获取血液样本进行分析和研究。
小鼠取血方法有多种,包括尾静脉取血、眼眶窝静脉取血、颈静脉穿刺取血等。
下面将对这些方法逐一进行详细介绍。
1.尾静脉取血方法:尾静脉取血是最常用且最方便的小鼠取血方法之一、具体步骤如下:1)麻醉小鼠:使用合适的麻醉方法麻醉小鼠,常见的方法有气体麻醉和注射麻醉剂。
2)准备工具:准备好所需的器械,如注射器、针头、72%医用酒精等。
3)清洗尾部:将小鼠放置在无菌条件下,用温水和肥皂轻轻清洗尾部,并用酒精擦拭消毒。
4)取血操作:将小鼠的尾部放置于温暖的环境恢复血流,用酒精擦拭尾部的静脉,然后用一只手控制住小鼠的尾巴,用另一只手将注射器针头的一端插入小鼠尾部的静脉中,缓慢地抽取所需的血样。
5)处理伤口:取血完成后,用棉球轻轻地按压尾部,使创口停止出血,并用消毒棉球擦拭尾部的酒精,帮助伤口愈合。
2.眼眶窝静脉取血方法:眼眶窝静脉取血适用于需要大量血样的实验。
具体步骤如下:1)麻醉小鼠:使用合适的麻醉方法麻醉小鼠,常见的方法有气体麻醉和注射麻醉剂。
2)准备工具:准备好所需的器械,如注射器、针头、72%医用酒精等。
3)定位小鼠:将小鼠的头部固定于工作台上,使眼眶窝静脉暴露。
4)消毒处理:用酒精擦拭眼眶窝上方的毛发,然后用酒精将取血点消毒。
5)取血操作:用一只手控制住小鼠的头部,用另一只手将注射器针头的一端插入眼眶窝静脉中,缓慢地抽取所需的血样。
6)处理伤口:取血完成后,用消毒棉球轻轻按压取血点,使创口停止出血,并用消毒棉球擦拭取血点的酒精,帮助伤口愈合。
3.颈静脉穿刺取血方法:颈静脉穿刺取血方法适用于表层静脉无法清晰可见或不方便取血的情况。
具体步骤如下:1)麻醉小鼠:使用合适的麻醉方法麻醉小鼠,常见的方法有气体麻醉和注射麻醉剂。
2)准备工具:准备好所需的器械,如注射器、针头、72%医用酒精等。
3)小鼠体位:将小鼠放置于工作台上,头部略微向后仰。

小鼠常用采血方法小鼠采血是实验动物学中非常常见的实验操作,用于获得血液样本进行生化分析、免疫学研究以及血液学指标检测等。
常用的小鼠采血方法有尾静脉采血、眼眶静脉窦采血和颌下静脉窦采血等。
尾静脉采血是小鼠采血最简单、最常用的方法之一、下面将详细介绍尾静脉采血方法步骤:1.镇静小鼠:合理使用合适的麻醉方法,如使用乙醚进行麻醉,在适当的安全条件下使用乙醚喷雾或置于乙醚浓度适宜的密闭培养箱内,使小鼠进入麻醉状态。
2.准备采血工具:如细针管、吸球和样本采集管等。
3.绑扎尾部:将小鼠放置在固定装置(如支架)上,用滑动环或橡皮筋等绑扎尾部,使尾静脉充血。
4.清洁采血部位:用70%酒精棉球擦拭尾部,以保持清洁。
5.采集血液样本:用细针管小心地刺破尾皮,迅速插入尾静脉,然后通过线性轻压尾部顶部,使血液进入针管中。
可以使用吸球来调节吸力,避免过度吸血,以免小鼠失血过多。
6.采完血样:迅速拔出针管,释放扎绑尾部的绳索或橡皮筋。
7.处理伤口:在采血后,可以用棉球轻轻按压以控制出血,并使用抗菌药膏涂抹伤口,加快伤口的愈合。
眼眶静脉窦采血是另一种常用的小鼠采血方法,这种方法更适合于需大量采血的实验。
具体步骤如下:1.镇静小鼠:使用适当的麻醉方法,如乙醚麻醉。
2.固定小鼠:将小鼠放置在固定装置上,使它的头部稳定。
3.准备采血工具:如微量注射器、吸球和注射针等。
4.清洁采血部位:用70%酒精棉球擦拭眼眶区域,以保持清洁。
5.采集血液样本:用微量注射器或注射针小心地插入眼眶角内,慢慢吸取血液样本。
可以使用吸球来调节吸力,避免过度吸血。
6.采完血样:迅速拔出注射器或注射针。
7.处理伤口:在采血后,可以用棉球轻轻按压以控制出血,并使用抗菌药膏涂抹伤口,加快伤口的愈合。
颌下静脉窦采血是适用于大鼠、小狗等大型小型动物的一种采血方法,下面是具体步骤:1.镇静动物:使用适当的麻醉方法,如乙醚麻醉。
2.准备采血工具:如采血针、血液采集管等。
3.清洁采血部位:用70%酒精棉球擦拭颌下区域,以保持清洁。

第1篇一、实验目的1. 掌握小鼠采血的方法和技巧。
2. 了解不同采血方法的特点和适用范围。
3. 提高动物实验操作的规范性和安全性。
二、实验材料1. 实验动物:健康小鼠若干只。
2. 实验器材:解剖显微镜、手术刀、剪刀、镊子、无菌手术器械、无菌棉球、液体火棉胶、注射器、无菌生理盐水、消毒液等。
三、实验方法1. 采血方法:本次实验主要采用剪尾采血和眼眶后静脉丛采血两种方法。
(1)剪尾采血:a. 将小鼠置于实验台上,用左手拇指和食指抓住小鼠颈部皮肤,将其头朝下。
b. 将小鼠尾巴浸泡于50℃热水中数分钟,使尾部血管充盈。
c. 擦干尾部,用剪刀或手术刀剪去尾尖1-2mm。
d. 用注射器吸取无菌生理盐水,注入伤口处,使血液流出。
e. 用无菌棉球压迫伤口处止血,并涂上液体火棉胶。
(2)眼眶后静脉丛采血:a. 将小鼠置于实验台上,用左手拇指和食指抓住小鼠颈部皮肤,将其头朝下。
b. 将麻醉药物滴入采血侧眼球,对小鼠眼部进行局部麻醉。
c. 用左手拇指和食指压迫小鼠颈部两侧,阻碍静脉回流,使眼球充分外突,眼眶后静脉丛充血。
d. 右手持硬质毛细玻璃管,沿眼角刺入眼眶底部,轻轻捻动毛细管,使其刺入眼眶静脉丛,可见血液流出。
e. 采集到所需血量后,用无菌棉球压迫伤口处止血。
2. 血液样本处理:a. 将采集到的血液样本注入无菌试管中。
b. 混匀血液样本,按照实验要求进行分离、检测等后续处理。
四、实验结果与分析1. 剪尾采血:a. 采血量:约0.1-0.2mL。
b. 采血时间:约5-10分钟。
c. 采血成功率:95%。
2. 眼眶后静脉丛采血:a. 采血量:约0.2-0.3mL。
b. 采血时间:约10-15分钟。
c. 采血成功率:90%。
五、实验讨论1. 剪尾采血方法操作简便,适用于少量多次采血,但可能导致小鼠尾部疼痛,影响动物福利。
2. 眼眶后静脉丛采血方法适用于中等量采血,成功率较高,但需要局部麻醉,可能对小鼠造成一定程度的刺激。
小鼠眼眶采血的正确方法
小鼠眼眶采血是一种常用的实验动物采血方法,以下是正确的小鼠眼眶采血方法:
1. 术前准备:在采血前,要先给小鼠适当的麻醉,通常使用合适的麻醉剂,如异氟醚,在充分麻醉后,将小鼠放在一个舒适的采血台上。
2. 术中操作:用一只手轻轻地按住小鼠头部,小鼠的眼眶区域会突出一些,用另一只手用消过毒的棉签或纱布在眼眶区域上轻轻搽拭,以保持清洁。
3. 采血:使用专业的眼眶采血针或毛细管,将其插入到小鼠眼眶下方的眶隔内,稍微向后侧运动并慢慢吸取血液。
注意要控制好采血的力度和速度,以免对小鼠产生过多伤害。
4. 采血后处理:完成采血后,用消毒纱布或棉签在小鼠的采血点轻轻按压几秒钟,以避免出血。
然后将小鼠放回适当的饲养环境,等待其从麻醉中恢复。
需要注意的是,小鼠眼眶采血是一项技术要求较高的操作,需要经过专业培训并遵循相关的实验动物使用和操作规范,以确保采血的成功率和对小鼠的伤害最小化。
常见小鼠给药和采血方法小鼠是广泛应用于生物医学研究的模式动物之一,其独特的生物学特性使其成为了研究各种疾病和药物疗效的重要工具。
在小鼠实验中,给药和采血是常见的操作步骤。
本文将介绍常见的小鼠给药和采血方法。
一、小鼠给药方法1.口服给药法:口服给药是最常见的小鼠给药方法之一,对于口服可吸收的药物非常有效。
给药时,首先选用合适的管子或针筒,将药物溶解在适量的溶剂中。
然后将小鼠固定住,用管子或针筒将药液缓慢地注入小鼠的口腔中,同时用手指轻轻按压小鼠的喉部,以保证药物进入食道而不是气管。
2.注射给药法:注射给药是给药的常见方法之一,适用于药物需要快速达到血液循环的情况。
常见的注射方法有以下几种:-皮下注射法:将药物注射到小鼠的皮下组织中。
操作时,首先选用合适的注射针和注射器,然后将药物注射到小鼠的腹部、背部或颈部的皮下组织中。
注射时需要注意,将针尖插入皮下组织中,然后缓慢注射药液,最后拔出针头。
-静脉注射法:将药物注射到小鼠的静脉系统中。
此方法可以快速达到血液循环,适用于药物需要迅速发挥作用的情况。
操作时,首先选用合适的注射针和注射器,然后将药物注射到小鼠的尾静脉中。
注射时需要注意,将针尖插入尾静脉中,然后缓慢注射药液,最后拔出针头。
-腹腔注射法:将药物注射到小鼠的腹腔中。
此方法适用于需要药物进入腹腔内脏器官的情况。
操作时,首先选用合适的注射针和注射器,然后将药物注射到小鼠的腹腔中。
注射时需要注意,将针尖插入腹腔中,然后缓慢注射药液,最后拔出针头。
除了以上的常见给药方法外,还有其他一些特殊的给药方法,如经鼻给药法、肌肉注射法等。
在给药前,需要根据药物的性质和实验要求选择合适的给药方法,并遵循良好的实验守则和伦理规定。
二、小鼠采血方法采血是小鼠实验中常见的操作步骤之一,用于获得小鼠的血液样本,以进行分析和检测。
常见的小鼠采血方法有以下几种:1.经尾静脉采血法:经尾静脉采血是最常见的小鼠采血方法之一,适用于需要少量血液样本的情况。
小白鼠采血三种方法的优缺点(1)眼眶后血管丛采血(2)摘除眼球采血(3)心脏采血1.采血部位:眼眶采血采血方法:将鼠固定在实验台边缘,左手抓紧鼠颈部皮肤固定头部,并轻轻向下压迫颈两侧,使眼球充血。
用事先准备好的10号金属针头顶端(针尖斜面朝内)垂直插入内眦并向眼底方向转动以便切开静脉丛,血液便会连续不断地滴入采血管。
用此法大约可取3~5mL 血液。
取血完毕,立刻用脱脂棉压迫止血。
优点:眼眶后静脉丛采血法方法简单,便于掌握。
血流较快,采血量多,能在较短时间内采到3~5mL血。
伤口较小,愈合较快。
成功率高,死亡率低。
缺点:不能避免组织液的混入,对于血样要求较高的研究应谨慎使用。
另外,多次使用易引起大鼠的感染。
对后续试验结果存在一定影响。
2.摘眼采血:鼠可以眼球取血,需要多多练习。
一般来说,可以三人配合取血。
取血前不需麻醉,用眼科剪剪掉大鼠的胡须(胡须过长,血液滴下的时候容易沾在胡须上,既浪费,又造成溶血,故应剪掉)。
所需器械:眼科小剪、眼科弯镊、止血钳。
一人抓大鼠并用眼科弯镊摘眼球,一人用止血钳夹住大鼠的嘴部以固定大鼠头部,另一个人拿试管接血。
大鼠在挣扎过程中,很容易导致血液丢失,因此固定头部很重要,否则只有眼看着血液乱飞,却不入试管。
摘眼球也需要技巧,否则眼球摘下来了,而血液却不流出来,应多多练习优缺点不太清楚啊,只知道我一个学长摘眼球的时候被咬了一口,挺残忍的3.采血部位:心脏取血(其实这个一般用在家兔)采血方法:将实验动物做仰卧有助手固定,术者在其左前肢腋下处剪毛及消毒。
在胸部心脏跳动最明显处,用一寸长的12好针头直刺心脏,感到以针头跳动或有血液内流动时。
即可抽血。
一次可采血15-20ml优点:抽血快,血液不易凝集,心区面积大, 进针准确性较高, 易一针见血, 且采血量能满足大量试验需要缺点:心脏损伤较大,难以迅速愈合,不利于短期连续采血。
3‘.采血部位:心脏采血(剪开皮肤)采血方法:从胸部正中剪开皮肤2.0~2.5cm。
实验小鼠给药与采血方法实验小鼠给药和采血是实验动物学中重要的实验操作,本文将详细介绍其中的方法和技巧。
实验小鼠给药是实验动物学研究中的重要环节。
正确的给药方法能够保证实验药物的正确投放和吸收,减少不必要的损失,提高实验的准确度和可靠性。
常见的小鼠给药方法包括:1. 饮水给药法饮水给药法是将药物溶解在小鼠饮用水中,让小鼠在饮水时进行自由摄取。
该方法操作简便,不需造口,适用于长期口服药物,长效治疗和组液注射等。
但该方法存在饮水量的波动和不稳定,因此需加入糖或盐以调控水的口感和促进饮水量,同时需对药物的稳定性和光敏性进行考虑。
2. 胃灌注法胃灌注法是将药物以液态形式通过硅胶管或灌胃管灌进小鼠口中,使其通过食管进入胃内。
该方法操作简单,可以精确控制药物的剂量和给药时间。
但该方法会造成不适和伤害,并可能引起呕吐反应,需对灌注量,灌入角度和灌注速度进行控制。
3. 腹膜注射法腹膜注射法是将药物注射到小鼠的腹膜腔内,并通过腹膜吸收进入血液循环系统。
该方法需对注射点,注射技术和药物剂量进行控制,可以减少药物的代谢和排泄,提高药物的利用率。
但该方法会造成一定的创伤和细胞损伤,需对注射量,注射时机和药物的准确性进行控制。
鼻腔给药法是将药物溶液通过鼻孔喷洒到小鼠的鼻腔内,再通过气道吸收进入血液循环系统。
该方法操作简便,可以克服口服和注射的局限性,适用于强效药物的给药和吸入药物研究。
但该方法存在对鼻腔的刺激和创伤,需对药物剂量和吸入速度进行控制和调节。
实验小鼠采血是实验动物学研究中的必要环节,得到血液样本能够反映小鼠体内药物的吸收,代谢和排泄程度,为实验结果的分析提供有力依据。
常见的小鼠采血方法包括:1. 轻微采血法轻微采血法是通过尾部切割,使血滴自然流出的方法,操作简单快捷,适用于采集小量血液的情况。
但该方法不能重复采集,在次数和时间上有很大的限制。
2. 悬胶胶体采血法悬胶胶体采血法是将小鼠的胶体中的血管挑选出来,以胶体替代原有的血管,实现血流畅通,并通过尾部切割获取血液样本的方法。
常见小鼠给药及采血方法常见的小鼠给药和采血方法是科研实验中非常常用的技术手段,在实验过程中对小鼠进行给药和采血可以获取药物的药代动力学信息,并且用于评估药物的疗效。
下面将详细介绍常见的小鼠给药方法和小鼠采血方法。
一、小鼠给药方法:1.口服给药:口服给药是最常见且简单的给药方法,适用于药物通过胃肠道吸收的情况。
通常使用胃管或者灌胃针将药物溶液灌入小鼠的胃中,可以精确控制给药剂量。
在给药前需要将小鼠禁食一段时间,以确保胃中没有食物。
2.稀释给药:稀释给药主要是用于药物溶解度较低的情况,通常使用溶剂将药物稀释后进行给药。
常用的稀释溶剂有PBS、麦芽糊精等。
在给药过程中需要控制好溶剂比例,避免对小鼠造成不必要的伤害。
3.注射给药:注射给药分为皮下注射、腹腔注射和静脉注射等。
皮下注射适用于需要给予较小剂量的药物,腹腔注射适用于需要给予中等剂量的药物,静脉注射适用于需要给予大剂量的药物。
注射给药需要掌握好注射技巧,避免对小鼠造成伤害。
4.气管给药:气管给药主要用于给药物通过呼吸道吸收的情况,通常使用雾化器将药物转化为粒径合适的颗粒进行给药。
此方法可以避免药物通过其他途径的代谢和消除,提高药物的生物利用度。
给药时需要注意控制好呼吸机的参数。
二、小鼠采血方法:1.尾静脉采血:尾静脉采血是最常用的小鼠采血方法,适用于需要采集较小量血液的情况。
通常使用尾静脉切口钳夹住小鼠的尾部,然后用刀片或者盖玻片划破尾静脉进行采血。
在采血前可以将小鼠的尾部浸泡在温水中,以扩张血管。
2.空心针穿刺静脉采血:空心针穿刺静脉采血适用于需要采集较大量血液的情况。
通常选择小鼠的颈静脉或者股静脉进行穿刺。
在采血前需要消毒采血部位,并使用无菌技术进行采血操作。
3.心脏穿刺采血:心脏穿刺采血是最常用于大量采血的方法,但是操作较为复杂且有一定难度,需要具备一定的技术经验。
在采血前需要消毒采血部位,并使用无菌技术进行采血操作。
给药和采血对小鼠的健康和生长状态有一定的影响,需要在实验过程中注意动物的福利和保护动物的权益,严格按照实验伦理和动物保护法规进行操作,以确保实验结果的准确性和可靠性。