专题 含杂质物质的化学计算
- 格式:doc
- 大小:37.50 KB
- 文档页数:2
有关含杂质物质的计算
1•为了测定某赤铁矿石中氧化铁的质量分数,取矿石样品40g,加入盐酸,恰好完全反应时,共
用去盐酸219g,过滤、洗涤、干燥后得滤渣8g(矿石中的杂质既不溶于水也不与盐酸反应)。
计
算:赤铁矿石中氧化铁的质量分数。
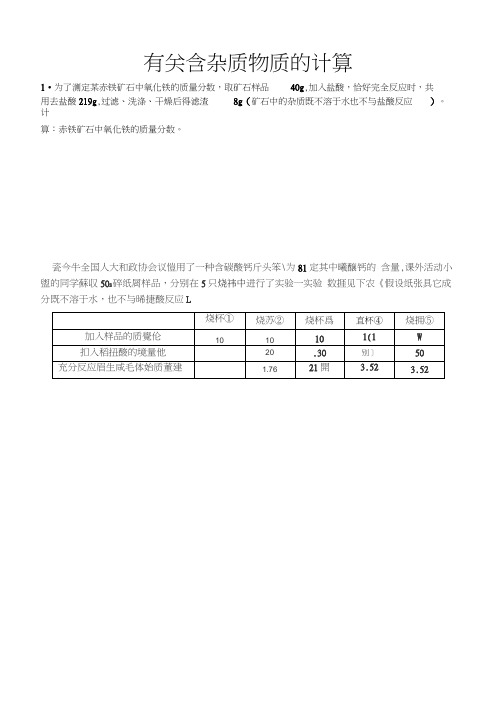
瓷今牛全国人大和政协会议愷用了一种含碳酸钙斤头笨\为81定其中曦醸钙的含量,课外活动小盥的同学蘇収50S碎纸屑样品,分别在5只烧祎中进行了实验一实验数捱见下农《假设纸张具它成分既不溶于水,也不与晞捷酸反应L
与足量稀盐酸反应最多能生成________ 胃气津;
〔2)求样晶中碳酸钙的质量甘数;
3•课题小组为测定某石灰石样品中CaC03的含量,取10g
石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样
品充分反应(杂质不参与反应)•随反应进行, 注入稀盐酸的质量与反应得到气
体的质量呈右图所示关系•计算样品中CaCO3的含量是多少?
工业上,高温煅烧石灰石(CaCO 3)可制得生石灰(CaO)和二氧化碳
(CO?)。
如果要制取
065.7稀.卷酸屬量咽10t 氧化钙,需要碳酸钙多少吨?
1.在“绿色氧化剂”双氧水(H22)的溶液中加入二氧化锰后,常温下即可产生大量氧气,若
制取48g 氧气需消耗纯净的双氧水多少克?。


含杂质的化学方程式的计算《含杂质的化学方程式的计算:一场奇妙的化学之旅》嗨,小伙伴们!今天咱们来聊聊含杂质的化学方程式的计算,这就像是在化学世界里玩一场有趣又有点烧脑的游戏呢。
我记得有一次啊,我们在化学课上做实验,要通过一个化学方程式来计算最终产物的量。
可是呢,原料不是纯净的,里面有杂质。
就好比我们要做水果沙拉,水果里却混着一些小树枝和烂叶子一样讨厌。
我们化学里的杂质就是这么个让人头疼的东西。
老师在黑板上写了一个化学方程式,比如说碳和氧化铜反应的方程式:C + 2CuO =高温= 2Cu + CO₂↑。
如果氧化铜是纯净的,那按照方程式计算就很简单啦。
就像走一条平坦的大道,一步一步按照比例算就行。
可是啊,要是氧化铜里有杂质呢?这就像路上突然出现了好多小石子和坑洼,计算的时候就得小心了。
我同桌就特别好奇,他问老师:“老师,这杂质就像捣蛋鬼一样,怎么才能把它给弄清楚呢?”老师笑了笑说:“这就需要我们先知道杂质占了多少呀。
比如说杂质的质量分数是10%,那剩下的90%就是我们真正能用来反应的氧化铜。
”我当时就在想,这就好像是在一群混杂的小动物里,要挑出我们想要的那种小动物。
要是总共有100只小动物,其中10只是别的种类,那剩下90只就是我们要找的那种。
在化学里,这个比例关系可重要啦。
再比如说,我们有100克含杂质的锌粒,杂质的质量分数是5%。
那这里面真正的锌的质量就是100×(1 - 5%) = 95克。
当锌和稀硫酸反应的时候:Zn + H₂SO₄ = ZnSO₄+ H₂↑,我们计算氢气的产量就得根据这95克锌来算,而不是100克整个的东西。
要是按照100克来算,那可就大错特错啦,就像你本来要数95个苹果能装几袋,你却当成100个苹果来算,结果肯定不对呀。
有一次我们小组做实验,要根据含杂质的碳酸钙和稀盐酸反应来计算二氧化碳的产量。
碳酸钙的样品里有杂质。
我们组里的小敏就特别细心,她把碳酸钙样品称好,然后按照杂质的比例算出了纯碳酸钙的质量。

含杂质物质的计算公式在咱们学习化学的过程中,经常会碰到一些含杂质物质的计算,这可真是个让人又爱又恨的“家伙”。
先来说说啥叫含杂质物质。
比如说,咱从矿山里挖出来的铁矿石,那可不会是纯纯的铁,里面肯定会有一些杂质,像石头啦、沙子啦之类的。
这时候,要算出纯铁的含量,就得用上咱们的计算公式啦。
就拿一个简单的例子来说吧。
假设咱有100 克的铁矿石,经过检测,知道里面铁元素的质量分数是 70%。
那纯铁的质量就是 100 克乘以70%,等于 70 克。
这个计算是不是还挺简单的?但实际情况往往会更复杂一些。
比如说,给你一堆混合的物质,告诉你其中一种成分的质量分数,然后让你算另一种成分的质量,这就得好好动动脑筋啦。
我记得有一次,我在课堂上给学生们出了这样一道题:有 50 克含碳酸钙 80%的石灰石,问能生成多少克二氧化碳?同学们一开始都有点懵,抓耳挠腮的。
我就引导他们一步一步来,先算出纯碳酸钙的质量,50 克乘以 80%等于 40 克。
然后根据化学方程式,碳酸钙和二氧化碳的比例关系,算出二氧化碳的质量。
最后,同学们恍然大悟,一个个脸上露出了开心的笑容。
再比如说,在工业生产中,要计算某种产品的纯度。
假如生产出来的一批铜矿石,总质量是 1000 千克,经过检测含铜量是 750 千克,那这批铜矿石的纯度就是 750 千克除以 1000 千克再乘以 100%,等于75%。
含杂质物质的计算在生活中也有不少用处呢。
就像去买金首饰,咱得知道这金子纯不纯,是不是?商家告诉你这首饰总重多少,含金量多少,你就能算出纯金的质量,心里就有底啦。
总之,掌握含杂质物质的计算公式,不仅能在考试中拿高分,还能在生活里派上用场。
所以,同学们可得好好学,多做几道练习题,把这个知识点牢牢掌握在手里。
这样,以后碰到类似的问题,就能轻松应对,不会被难倒啦!。


初中化学有关杂质计算一、 有关元素的计算:1、相对分子质量=(相对原子质量×原子个数)之和例如:求Na 2CO 3·10H 2O 的相对分子质量解 Na 2CO 3·10H 2O 的相对分子质量=23×2+12×1+16×3+10×(1×2+16×1)=286 再如:计算2CuSO 4·5H 2O 的总相对分子质量2CuSO 4·5H 2O 的总相对分子质量=2×[64+32+16×4+5×(1×2+16)]=2×250=500 2、组成元素的质量比=(相对原子质量×原子个数)之比 注意:在计算时要注意标清元素的顺序。
【例】求葡萄糖(C 6H 12O 6)中各元素的质量比解 C:H:O =12×6:1×12:16×6=6:1:83、原子个数之比=(元素质量÷相对原子质量)之比4、化合物中某元素的质量分数=%100⨯⨯量该化合物的相对分子质原子个数该元素的相对原子质量【例】求硝酸铵(NH 4NO 3)中氮元素的质量分数解 氮元素的质量分数=的相对分子质量氮的相对原子质量342NO NH ⨯×100%=8028×100%=35%. 5、某元素的质量=某化合物的质量×某元素质量分数=%100⨯⨯⨯量该化合物的相对分子质原子个数该元素的相对原子质量某化合物的质量【例】多少吨的氧化亚铁(FeO )中所含铁元素质量和100t 中氧化铁所含铁元素的质量相同? 解:设需氧化铁的质量为x 。
t90%10016042t 100%1007256%100316256256t 100%100165656=⨯⨯=⨯⨯⨯⨯+⨯⨯⨯=⨯+⨯x x x 答:需氧化亚铁的质量为90t 。
【注意】列方程时所设未知数不能带有单位。
初中化学杂质计算教案
主题:杂质计算
目标:学生能够理解化学中杂质计算的基本概念和方法。
教学重点:杂质计算的基本公式和步骤。
教学难点:理解杂质计算中的公式的运用。
教具准备:教案、黑板、粉笔、计算器、化学试题。
教学过程:
一、引入
教师向学生介绍杂质计算的概念和重要性,引导学生认识到杂质计算在化学实验和生产中的重要作用。
二、讲解
1. 介绍杂质计算的基本公式:杂质含量 = (杂质的质量 / 样品的质量) × 100%。
2. 讲解杂质计算的步骤:首先测量样品的质量和杂质的质量,然后代入公式进行计算。
三、示范
教师通过一个简单的例子示范如何进行杂质计算,让学生掌握计算的方法。
四、练习
让学生在黑板上做一些杂质计算的练习题,帮助学生加深对公式和方法的理解。
五、巩固
让学生用自己的话复述杂质计算的步骤和公式,并进行讨论和解答疑问。
六、作业
布置作业:让学生完成一些杂质计算的试题,并要求学生写出详细的解题过程。
七、反馈
在下节课开始前对学生的作业进行批改,对学生的表现进行评价和反馈,帮助学生进一步巩固学习成果。
教案结束。
含杂质物质的化学计算专题
一、专家引领,思路导航:
知识点1:利用化学方程式的简单计算的一般方法:
(1)根据化学方程式计算的依据:理论基础是质量守恒定律,计算时依据化学方程式中反应物、生成物各物质之间的质量比。
(2)利用化学方程式计算的一般步骤:①设(未知量)②写(化学方程式)③比(有关物质的式量、已知量和未知量)④列(比例式)⑤答(简明地写答)
(3)根据化学方程式计算应该注意的事项①正确书写化学方程式,准确列出有关反应物或生成物的质量比;②列式时,各物质的质量单位必须统一,对应关系要正确;③反应物、生成物都必须是纯净物,否则,应该将不纯物的质量按题意转化为纯净物的质量;④解题的过程要完整,规范,计算结果要正确。
⑤设未知数是要指明物理量,不要带单位。
知识点2:常见的计算类型:根据化学方程式的计算类型:
【1】有关反应物和生成物质量的计算,利用化学方程式的简单计算;
【2】含有杂质的反应物或生成物的计算,首先把不纯的物质换算成纯净的物质。
有关计算公式:
①不纯物总质量中含有纯净物的质量分数(纯度)计算公式:
杂质的质量分数
1100%物质质的总质
纯物质的质量纯物质的质量分数-=⨯=
②纯净物的质量=不纯物的质量×纯净物的质量分数=不纯物的质量×(1-杂质的质量分数) ③一定体积的气体换算成一定质量的气体:气体的体积=气体的质量/气体的密度。
解题思路:
①审题:认真阅读题目,反复推敲关键字句,准确理解题意。
②析题:运用所学知识剖析题目,理清层次,挖掘隐含信息,排除干扰条件,分析已知和待求。
明确物质间关系,寻找解题突破口。
③解题:解题时要做到思路清楚,方法正确,步骤清晰(设未知、写化学方程式、找关系量、列比例式、求未知、写答案),计算准确,书写规范。
④验题:检查所用条件是否符合题意,是否全部解出所求问题,单位是否统一,计算是否正确等。
二、名师点津,知能提升: A 部分:
(1)实验室用5.2克锌与足量的稀硫酸反应,最多可以制的氢气多少克?这些氢气在标准状况下的体积是多少升?(氢气的密度是0.09g/L,结果精确到0.01)
(2)将氯酸钾和二氧化锰的混合物15.5克装入大试管中,加热制取氧气待反应完全后,冷却称量剩余固体的质量为10.7克,计算:生成氧气的质量多少克?剩余固体中有哪些物质,各多少克?
(3)氯化钠溶液在通电的条件发生反应生成次氯酸钠消毒液。
若要制取5000克质量分数为0.298%的次氯酸钠消毒液,则需要多少克的氯化钠?(NaCl + H 2O
电解
NaClO + H 2↑)
(4)工业上用电解氧化铝的方法生产金属铝。
问电解20.4吨氧化铝,最多能生产含杂质4%
的金属铝多少吨?(2Al 2O 3
电解
4Al + 3O 2 ↑)
(5)为测定某固体样品中CaO 2的质量分数,称取20克样品加入足量的水中,结果生成3.2克氧气(假如样品中其它成分不与水反应)。
试计算样品中CaO 2的质量分数。
(2CaO 2 + 2H 2O=2Ca(OH)2 + O 2↑)
(6)某同学为探究一种牙膏摩擦剂中所含碳酸钙的质量分数,称取500克样品,放在电炉上高温煅烧至不再发生变化,称量剩余物的质量为302克(假如石灰石样品中杂质不参加反应)。
据此计算(1)生成二氧化碳的质量;(2)此样品中碳酸钙的质量分数。
(7)为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g 该样品与0.5g 二氧化锰混合,加热该混合物t 1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,
(1)在________时间后,该样品中的氯酸钾已经完全反应 (2)完全反应后产生氧气的质量 (3)该样品中氯酸钾的质量分数
B部分:
1.(1)现有含Fe2O380%的赤铁矿石2000t,问其中含有纯Fe2O3多少t?
(2)在多少t含杂质5%的生铁中,含有纯铁为190t?
2、含碳酸钙80%的石灰石100t,高温煅烧后,可得生石灰多少t?
3、要生产56t生石灰,需含杂质20%的石灰石多少t?
4、某炼铁厂日产含碳4%的生铁350t,问该厂每天至少需要含氧化铁80%的赤铁矿石多少t?
5、含四氧化三铁85%的磁铁矿200t,用一氧化碳作还原剂,充分反应后能炼出含杂质2%的生铁多少t?
6、某炼铁厂用含三氧化二铁的赤铁矿200t(赤铁矿中的杂质不含铁)来炼铁,炼出的生铁中含铁105t,求该铁矿石中三氧化二铁的质量分数。
7、某钢样1.1g在纯氧中完全燃烧,得到0.022g的二氧化碳,求此钢样中碳的质量分数。
8、为测定Cu-Zn合金中的铜质量分数,小华取合金的粉末65g与足量该盐酸充分反应,经测定产生了0.4g气体,请求出该合金中铜的质量分数。
9、小科同学为测定某铁合金的含铁量,称取11.4g样品,放入质量为50.0g烧杯中,再往烧杯中加入足量的100.0g稀盐酸(杂质不与酸反应,也不溶于水),反应后烧杯总质量为161.0g。
求:(1)反应产生的氢气的质量;(2)该铁合金中铁的质量分数。
10、一块质量为3.0g含有铁锈的铁片,与25g稀硫酸恰好完全反应生成0.1g氢气。
请计算:(1)该铁片中铁的质量;(2)该铁片中铁的质量分数。
11、测定大理石含CaCO3的质量分数,取大理石12.5g,加入盛有100g稀盐酸的烧杯中,两者恰好完全反应(假设其他杂质不与盐酸反应,也不溶解)。
烧杯内物质的质量变为108.1g。
试计算大理石样品中CaCO3的质量分数。