高考化学一轮复习第八章水溶液中的离子平衡第二节水的电离和溶液的酸碱性学案新人教版
- 格式:doc
- 大小:1.58 MB
- 文档页数:37





学习资料第二节水的电离和溶液的酸碱性考纲定位要点网络1。
了解水的电离,离子积常数。
2.了解溶液pH的定义及其测定方法,能进行pH的简单计算.3.掌握酸碱中和滴定实验及其应用。
水的电离与水的离子积知识梳理1.水的电离(1)水是极弱的电解质,其电离方程式为H2O+H2O H3O++OH-,可简写为H2O H++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7mol·L-1;任何水溶液中,由水电离出的c(H+)与c(OH-)都相等。
2.水的离子积[辨易错](1)任何水溶液中,水电离出的c(H+)与c(OH-)一定相等。
()(2)纯水中c(H+)随温度升高而增大,水的酸性增强。
( )(3)酸溶液中水电离出的c(H+)等于溶液中c(OH-)。
() (4)K w与溶液的酸碱性无关,与温度有关。
() [答案](1)√(2)×(3)√(4)√3.外界条件对水的电离平衡的影响体系变化条件平衡移动方向K w水的电离程度c(OH-)c(H+)外加酸碱酸逆不变减小减小增大碱逆不变减小增大减小外加可水解的盐Na2CO3正不变增大增大减小NH4Cl 正不变增大减小增大温度升温正增大增大增大增大降温逆减小减小减小减小其他:如加入Na 正不变增大增大减小1.甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。
乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H +)增大,H+与OH-中和,平衡右移。
你认为哪种说法正确?并说明原因。
[答案]甲正确,温度不变,K w是常数,加入H2SO4,c(H+)增大,c(H+)·c(OH-)>K w,平衡左移。
或加入酸,H+与OH-反应生成H2O,水增多,实质仍是水的电离左移。
2.25 ℃时,pH=4的醋酸溶液与NH4Cl溶液中c(H+)H2O相等吗?为什么?[答案]不相等,醋酸电离出的H+抑制水的电离,而NH4Cl电离出的NH错误!结合OH-,促进了水的电离.知识应用在不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。


第二节水的电离和溶液的酸碱性(对应学生用书第152页)[考纲知识整合]1.水的电离(1)电离方程式:H2O H++OH-或2H2O H3O++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7_mol·L-1,任何水溶液中由水电离出来的c(H+)=c(OH-)。
2.水的离子积常数(1)表达式:K w=c(H+)·c(OH-)。
25 ℃时,K w=10-14,100 ℃时,K w=10-12。
(2)影响因素:只与温度有关,升高温度,K w增大。
(3)适用范围:适用于纯水、酸、碱、盐的稀溶液。
(4)意义:K w揭示了在任何水溶液中均存在H+和OH-,只要温度不变,K w不变。
提醒:在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离产生的c(H+)、c(OH-)总是相等的。
在K w的表达式中,c(H+)、c(OH-)均表示整个溶液中H+、OH-总的物质的量浓度而不是单指由水电离出的c(H+)、c(OH-)。
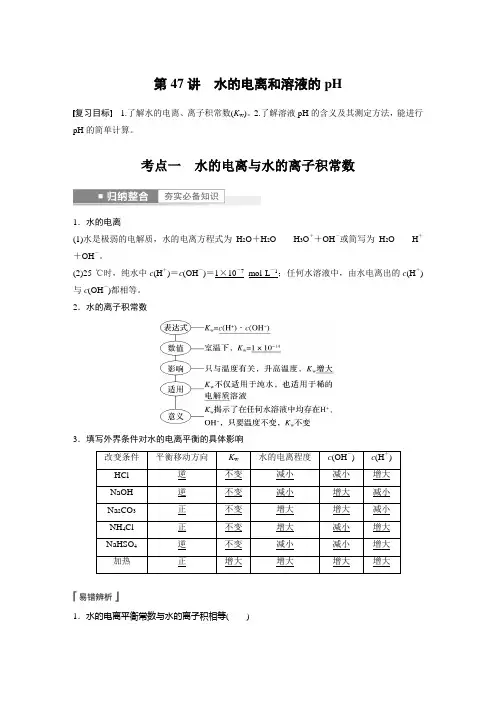
3.外界条件对水的电离平衡的影响提醒:25 ℃,pH=3的盐酸、NH4Cl溶液中,水电离出的c(H+)H2O分别为1×10-11 mol/L、1×10-3 mol/L。
[应用体验]正误判断(正确的打“√”,错误的打“×”)。
(1)纯水中c(H+)随温度升高而增大,酸性增强。
( )(2)酸、碱性溶液中水电离出的c(H+)H2O=c(OH-)H2O一定比纯水中的小。
( )(3)向水中加入酸式盐,溶液呈酸性,是因为促进了水的电离。
( )(4)25 ℃时,0.10 mol·L-1NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积变大。
( )(5)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度始终增大。
第47讲水的电离和溶液的pH复习目标 1.了解水的电离、离子积常数(K w)。
2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
考点一水的电离与水的离子积常数1.水的电离(1)水是极弱的电解质,水的电离方程式为H2O+H2O H3O++OH-或简写为H2O H++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7_mol·L-1;任何水溶液中,由水电离出的c(H+)与c(OH-)都相等。
2.水的离子积常数3.填写外界条件对水的电离平衡的具体影响改变条件平衡移动方向K w水的电离程度c(OH-) c(H+) HCl 逆不变减小减小增大NaOH 逆不变减小增大减小Na2CO3正不变增大增大减小NH4Cl 正不变增大减小增大NaHSO4逆不变减小减小增大加热正增大增大增大增大1.水的电离平衡常数与水的离子积相等()2.25 ℃时CH 3COONa 溶液的K w 大于100 ℃时NaOH 溶液的K w ( ) 3.NaCl 溶液和CH 3COONH 4溶液均显中性,两溶液中水的电离程度相同( ) 4.温度一定时,在纯水中通入少量SO 2,水的电离平衡不移动,K w 不变( )5.室温下,0.1 mol·L -1的HCl 溶液与0.1 mol·L -1的NaOH 溶液中水的电离程度相等( ) 答案 1.× 2.× 3.× 4.× 5.√22H O H O (H )(OH )c c +-一或、的计算1.室温下,计算下列溶液中水电离出的2H O (H )c +。
(1)0.01 mol·L-1的盐酸中,2H O (H )c +=___________________________________。
(2)pH =4的亚硫酸溶液中,2H O (H )c +=___________________________________。


高考化学一轮复习:第二节水的电离和溶液的酸碱性最新考纲:1.了解水的电离和水的离子积常数。
2.了解溶液pH的定义。
3.了解测定溶液pH的方法,能进行pH的简单计算。
核心素养:1.变化观念与平衡思想:认识水的电离有一定限度,是可以调控的。
能多角度、动态地分析水的电离,运用平衡移动原理解决实际问题。
2.科学探究与创新意识:能发现和提出酸碱中和滴定中有探究价值的问题;能从问题和假设出发,确定探究目的,设计探究方案,进行实验探究;在探究中学会合作,面对“异常”现象敢于提出自己的见解,进行误差分析。
知识点一水的电离1.水的电离水的电离方程式为H2O+H2O H3O++OH-,简写为H2O H++OH-。
25 ℃时,纯水中c(H+)=c(OH-)=1×10-7_mol·L-1。
任何水溶液中,由水电离出来的c(H+)与c(OH-)都相等。
2.水的离子积常数(1)水的离子积常数:K w=c(H+)·c(OH-)。
25 ℃时,K w=1×10-14,100 ℃时,K w=1×10-12。
(2)影响因素:只与温度有关,升高温度,K w增大。
(3)适用范围:K w不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
(4)K w揭示了在任何水溶液中存在H+和OH-,只要温度不变,K w不变。
3.影响水电离平衡的因素(续表)判断正误(正确的打“√”,错误的打“×”)1.在蒸馏水中滴加稀硫酸和浓H2SO4,K w不变( ×)提示:滴浓硫酸时温度升高,K w增大。
2.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( ×)提示:醋酸铵促进水的电离。
3.K w=1×10-14( ×)提示:常温时才有K w=1×10-14。
4.25 ℃时NH4Cl溶液的K w大于1×10-14( ×)提示:常温时纯水或稀溶液的K w均为1×10-14。
5.纯水的pH=7( ×)提示:25 ℃时,水的pH=7。
6.由水电离出的c(H+)=1×10-14mol·L-1的溶液一定是碱溶液( ×)提示:也可能是酸溶液。
7.水的离子积常数K w=c(H+)·c(OH-)中H+和OH-一定是水电离出来的( ×)提示:K w=c(H+)·c(OH-)中c(H+)和c(OH-)均是指溶液中的氢离子和氢氧根离子的总浓度。
1.水的离子积常数K w=c(H+)·c(OH-),不仅适用于纯水,也适用于一切酸、碱、盐的稀溶液。
在任何酸、碱、盐的稀溶液中,只要温度一定,K w就一定。
2.在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离产生的c(H+)、c(OH -)总是相等的。
在Kc(H+)、c(OH-)均表示整个溶液中H+、OH-总的物质的量浓w的表达式中,度而不是单指由水电离出的c(H+)、c(OH-)。
3.水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
4.水的电离是吸热过程,升高温度,水的电离平衡向电离方向移动,c(H+)和c(OH-)都增大,故K w增大,但溶液仍呈中性;对于K w的有关计算,若未注明温度,一般认为在常温下,即25 ℃。
1.一定温度下,水存在H2O H++OH-ΔH>0的平衡,下列叙述一定正确的是( B ) A.向水中滴入少量稀盐酸,平衡逆向移动,K w减小B.将水加热,K w增大,pH减小C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低D.向水中加入少量固体硫酸钠,c(H+)=10-7mol·L-1,K w不变解析:A项,K w应不变;C项,平衡应正向移动;D项,由于没有指明温度,c(H+)不一定等于10-7mol·L-1。
2.在一定条件下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-a mol·L-1和1.0×10-b mol·L-1,在此温度下,下列说法正确的是( D )A.a<bB.a=bC.水的离子积为1.0×10-(7+a)D.水的离子积为1.0×10-(b+a)解析:加酸抑制水的电离,加易水解的盐促进水的电离,则a>b,A、B选项错误;由题意可知,两种溶液的pH=b,即硫酸溶液中c(H+)是1.0×10-b mo l·L-1,而水电离产生的c(H-(b +)等于水电离产生的c(OH-),所以硫酸溶液中c(OH-)是1.0×10-a mol·L-1,Kw=1.0×10+a),C选项错误、D选项正确。
3.(2020·泉州模拟)某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2mol·L-1。
下列对该溶液的叙述不正确的是( D )A .该温度高于25 ℃B .由水电离出来的H +的浓度为1×10-10mol·L -1C .加入NaHSO 4晶体抑制水的电离D .取该溶液加水稀释100倍,溶液中的c (OH -)减小解析:该温度下蒸馏水中c (H +)=1×10-6mol·L -1,大于25 ℃时纯水中c (H +),故温度高于25 ℃,A 项正确;此温度下K w =1×10-12,故该NaHSO 4溶液中c (OH -)=1×10-121×10-2=1×10-10mol·L -1,由水电离出的c (H +)与溶液中的c (OH -)相等,B 项正确;加入NaHSO 4后,NaHSO 4电离出的H +抑制了水的电离,C 项正确;加水稀释时,c (H +)减小,而K w 不变,故c (OH -)增大,D 项错误。
4.25 ℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH ③H 2SO 4 ④(NH 4)2SO 4,其中水的电离程度按由大到小顺序排列的一组是( C ) A .④>③>②>① B .②>③>①>④ C .④>①>②>③D .③>②>①>④解析:②③分别为碱、酸,抑制水的电离;④中NH +4水解促进水的电离,①NaCl 不影响水的电离。
5.(2020·北京东城区质检)如图表示水中c (H +)和c (OH -)的关系,下列判断错误的是( D )A .两条曲线间任意点均有c (H +)·c (OH -)=K w B .M 区域内任意点均有c (H +)<c (OH -) C .图中T 1<T 2D .XZ 线上任意点均有pH =7解析:由水的离子积的定义知两条曲线间任意点均有c (H +)·c (OH -)=K w ,A 项正确;由图中纵横轴的大小可知M 区域内任意点均有c (H +)<c (OH -),B 项正确;温度越高,水的电离程度越大,电离出的c (H +)与c (OH -)越大,所以T 2>T 1,C 项正确;XZ 线上任意点都有c (H +)=c (OH -),只有当c (H +)=10-7mol·L -1时,才有pH =7,D 项错误。
6.一定温度下,水溶液中H +和OH -的浓度变化曲线如图。
下列说法正确的是( C )A .升高温度,可能引起由c 向b 的变化B .该温度下,水的离子积常数为1.0×10-13C .该温度下,加入FeCl 3溶液可能引起由b 向a 的变化D .该温度下,稀释溶液可能引起由c 向d 的变化解析:A.c 点溶液中c (OH -)>c (H +),溶液呈碱性,升温,溶液中c (OH -)不可能减小,错误;B.由b 点对应c (H +)与c (OH -)可知,K w =c (H +)·c (OH -)=1.0×10-7×1.0×10-7=1.0×10-14,错误;C.FeCl 3溶液水解显酸性,溶液中c (H +)增大,因一定温度下水的离子积是常数,故溶液中c (OH -)减小,因此加入FeCl 3溶液可能引起由b 向a 的变化,正确;D.c 点溶液呈碱性,稀释时c (OH -)减小,同时c (H +)应增大,故稀释溶液时不可能引起由c 向d 的变化,错误。
7.水的电离常数如图两条曲线所示,曲线中的点都符合c (H +)·c (OH -)=常数,下列说法错误的是( C )A .图中温度T 1>T 2B .图中五点K w 间的关系:B>C>A =D =EC .曲线a 、b 均代表纯水的电离情况D .若处在B 点时,将pH =2的硫酸溶液与pH =12的KOH 溶液等体积混合后,溶液显碱性解析:D 项,B 点K w =10-12,H 2SO 4中c (H +)=10-2mol·L -1,KOH 中c (OH -)=10-1210-12 mol·L-1=1 mol·L -1,等体积混合后,KOH 过量,溶液呈碱性,正确。
素养定量计算水电离的c(H+)或c(OH-)1.任何溶液中水电离的c(H+)=c(OH-)2.当抑制水的电离时(如酸或碱溶液)在溶液中c(H+)、c(OH-)较小的数值是水电离出来的。
如下表:溶液(25 ℃)c(H+)mol·L-1c(OH-)mol·L-1水电离出来的c(H+)或c(OH-)mol·L-1pH=2盐酸10-210-1210-12 pH=13的NaOH溶液10-1310-110-13 3.当促进水的电离时(如盐的水解)在溶液中c(H+)、c(OH-)较大的数值是水电离出来的。
如下表:溶液(25 ℃)c(H+)mol·L-1c(OH-)mol·L-1水电离出来的c(H+)或c(OH-)mol·L-1pH=5的NH4Cl溶液10-510-910-5 pH=10的Na2CO3溶液10-1010-410-41.(2020·长沙市雅礼中学检测)25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( A )A.1∶10∶1010∶109B.1∶5∶(5×109)∶(5×108)C.1∶20∶1010∶109D.1∶10∶104∶109解析:H 2SO 4与Ba(OH)2抑制水的电离,Na 2S 与NH 4NO 3促进水的电离。