化学实验报告 实验__市售钙片中钙含量的测定
- 格式:doc
- 大小:53.00 KB
- 文档页数:2

分析化学实验--钙片中钙含量的测定--实验报告
一、实验目的:
本实验旨在测定钙片中钙含量,以掌握有关元素含量的科学数据,进而运用于化学分
析和日常生活中的一些重要技术需要。
二、实验原理
以此次实验中的催化电量法为例,测定钙含量的原理:钙被分解成氢钙和水,在催化
极电量(在此实验中即钠极)的作用下,氢钙水解成氢气和氧气,氧气被阴极收集起来计算
所得氧气的量就可以求出原本钙的量,所以通过计算所得钙片中钙的含量。
三、实验材料
硝酸钠、氢氧化钠、1M醋酸铜、2M醋酸钠及0.014N硫酸钠等;检验样品是一片由元
重确定的钙片。
四、实验步骤
(1)将待测样品轻轻放入研磨瓶中,同时添加1mL硝酸钠,用棉等织物将样品表面,
磨细,重复操作该步骤2次;
(2)向样品中添加2mL 2M醋酸钠和4mL氢氧化钠,将该组合物混合均匀,并加热至
沸腾;
(3)将0.014N硫酸钠边滴边搅拌,尽可能多的滴入悬浮液中,直至反应液出现均匀
的褐色;
(4)将1M醋酸铜滴入反应液中,持续搅拌至棕橙色定色;
(5)将样品放入含有催化极电流的实验装置中,并安装电解质滴定筒,根据技术指
标确定电流,直至实验30min;
(6)除去极板上附着的残余物,用50mL 0.1N硫酸铜液将极板内残余物溶解,50mL
标样滴定,确定实验结果。
五、实验结果
检测结果:钙片中钙含量为___g/L。
本实验使用催化电量法测定了钙片中钙含量,结果表明,测定出的钙片中的钙含量为
___g/L,满足实验要求的标准。
从而,我们可以利用本实验获取有关元素含量的参考数据,运用于化学分析和日常技术需要。

综合实验——分析化学部分补钙制剂中Ca 含量的测定(共12课时)钙片的主要成分为碳酸钙、甘露醇、乳糖、淀粉、维生素d 、甜橙香精、柠檬酸、阿斯马甜(含苯丙氨酸)、苋菜红。
钙主要以碳酸钙形式存在,可与HCl 发生反应而溶解。
钙的测定方法有酸碱滴定法(返滴定)、络合滴定法(直接滴定)和氧化还原滴定法(间接滴定)以及原子吸收光谱法、电化学分析法等。
本实验欲采用三种滴定分析方法进行测定,并对各种方法的有略加以比较。
方法Ⅰ 酸碱滴定法测定补钙制剂中Ca 的含量——返滴定法一、实验目的1. 学习用酸碱滴定方法测定CaCO 3的原理及指示剂选择。
2. 巩固滴定分析基本操作。
二、实验原理补钙制剂中钙主要以碳酸钙形式存在,可与HCl 发生反应而溶解2322CaCO 2H Ca CO H O +++→+↑+ 过量的酸可用标准NaOH 回滴,据实际与CaCO 3反应标准盐酸体积求得钙片中Ca 含量,以Ca 质量分数表示。
三、试剂浓HCl (A .R ),NaOH (A .R ),0.1%甲基橙。
四、实验方法(1)0.1mol ·L -1NaOH 配制:称2gNaOH 固体于小烧杯中,加H 2O 溶解后移至试剂瓶中用蒸馏水稀释至500mL ,加橡皮塞,摇匀。
(2)0.1 mol ·L -1HCl 配制:用量筒量取浓盐酸4.5mL 于500mL 试剂瓶中,用蒸馏水稀释至500mL ,加盖,摇匀。
(3)酸碱标定:A.HCl 标准溶液的标定:准确称取基准Na 2CO 3 0.15~0.2g 3份于锥形瓶中,分别加入20~30mL 煮沸去CO 2并冷却的去离子水,摇匀,温热使溶解,后加入1~2滴甲基橙指示剂,用以上配制的HCl 溶液滴定至橙色为终点,计算HCl 溶液的精确浓度。
B.NaOH 标准溶液的标定:准确移取NaOH 标准溶液25mL 于250mL 的锥形瓶中,加2d 甲基橙指示剂,此时溶液呈黄色,用HCl 滴定标准溶液滴定至在加下半滴HCl 后溶液由黄色变为橙色,即为终点,计算NaOH溶液的精确浓度。

钙片中Ca含量的测定摘要钙是人体内必需的常量元素,除形成骨架之外,主要是通过Ca2 +发挥重要的生理作用。
长期以来,人们错误地认为钙这种常量元素比比皆是,能从食物中充分供应而不缺乏。
但医学研究的结果表明,人体容易缺钙,其中以儿童和老人最甚。
现如今补钙已成为一种时尚,市场上补钙的产品种类繁多,含钙量是一项最基本的鉴别其好坏的重要指标,所以测定补钙制剂的钙含量非常重要,寻求一种快速、准确、简便的测定方法也至关重要.本研究通过EDTA 滴定法测定钙片中的钙含量,简单、准确、干扰小,适合中小型实验室。
关键词钙片,EDTA,滴定引言食品中钙含量的测定通常采用火焰原子吸收光谱法或EDTA 滴定法。
火焰原子吸收光谱法测定速度快,干扰小,但因仪器昂贵、需要专门的操作技术,基层实验室难以普及。
本实验采用EDTA 滴定法测定钙片中的钙含量,经过实验发现检测结果的准确度和精密度均有提高,得到满意的效果。
1实验部分1.1实验原理在pH= 12 的条件下,用EDTA 标准溶液滴定Ca2 +,利用钙指示剂指示滴定终点,溶液颜色由红色变为蓝色。
1.2仪器和试剂1.2.1仪器分析天平;25.00 mL 碱式滴定管;吸量管和移液管。
1.2.2试剂0.101 mol/ L EDTA 标准溶液;CaCO3 (分析纯);5 mol/ L NaOH 溶液;6 mol/ L HCl 溶液;5 g/ L钙指示剂溶液;200 g/ L 三乙醇胺溶液;钙片(样) 。
0.101 mol/ L EDTA 标准溶液浓度的标定:常量滴定法标定和微型滴定法标定。
2实验方法2.1钙片中钙含量测定2.1.1钙片溶液配制:将钙片粉碎,研磨均匀后准确称取样品0.13 g 左右,先以少量水润湿,再逐滴加入6 mol/ L HCl 至无气泡产生为止,定量转入250 mL 容量瓶中,以水稀释至刻度,摇匀,备用。
2.1.2常量滴定法测定:准确移取上述溶液20.00 mL 于150 mL 锥形瓶中,加入三乙醇胺溶液1 mL ,5 mol/ L NaOH 溶液1 mL ,摇匀,加入钙指示剂3~4 滴,用0101mol/ L EDTA 标准溶液滴定至溶液变蓝色为止,平行测定5 次。

分析化学实验钙片中钙含量的测定实验报告钙片中钙含量的测定
实验目的
1. 了解硫酸亚铁用于检测钙含量的原理。
2. 根据钙片中钙含量的测定,通过简便而准确的方法测定钙含量,指导临床治疗。
实验原理
硫酸亚铁的氧化和还原反应,将硫酸亚铁的褐色氧化物(Fe2+)氧化为无色还原物(Fe3+)。
硫酸亚铁实验中,硫酸亚铁能反应和氧化钙,这是因为硫酸亚铁的Fe2+会与Ca2+发生氧化反应,当硫酸亚铁在水溶液中,有显色反应发生,而且检测钙含量反应时,用目视观察检测溶液有没有氧化效果,根据检测结果,来计算钙片中钙含量。
实验步骤
1. 将指定体积的样品加入容量瓶中,加水,稀释。
2. 加入硫酸亚铁溶液,用搅拌棒搅拌,当溶液颜色变黄时,搅拌时间不要太久,避免溶液变浑浊。
3. 加入指定体积的硝酸钠溶液,再加入酸性高碘酒石酸钠溶液,搅拌均匀。
4. 检测溶液是否有氧化效果,根据检测结果,来计算钙含量。
实验结果
观察硝酸钠溶液中加入硫酸亚铁溶液和酸性高碘酒石酸钠溶液后,由黄色沉淀形成蓝绿色溶液,说明实验室为正常的青绿色,表明该样品的钙片中钙含量为正常水平。
结论
本实验将硝酸钠水溶液与硫酸亚铁溶液混合,再加入酸性高碘酒石酸钠溶液,用此方法测定钙片中钙含量,通过观察溶液颜色变化判断钙含量是否正常,结果表明钙含量基本符合正常水平。
经过分析,本实验证实了硫酸亚铁用于检测钙含量的原理,可以依据实验结果进行简便准确的测定钙含量,从而指导临床治疗。

无机及分析化学实训报告钙片中钙含量的测定班级:化工101组员:曹莹莹刘杨指导教师:张孟存杨金梅张辉日期:2010年12月25日钙片中钙含量的测定1实验背景钙制剂与人体关系碳酸钙:含钙量高,副作用小,价格便宜,吸收率高,可以达到40%,与牛奶相似,是广泛应用的一种钙制剂。
还可以多食一些含钙的食物(骨头汤、虾皮、小鱼),补一些维生素D类的食物(海鱼、动物肝脏、蛋黄和瘦肉中。
另外像脱脂牛奶、鱼肝油、乳酪、坚果和海产品、添加维他命D的营养强化食品)。
还要多晒太阳。
这是最安全的办法,用于预防和治疗钙缺乏症,如骨质疏松、手足抽搐症、骨发育不全、佝偻病以及儿童、妊娠和哺乳期妇女、绝经期妇女、老年人钙的补充下面是通过实验得出验证进行钙片中钙含量的测定。
二、实验原理EDTA能和大多数金属离子形成1:1的稳定化合物,所以配位滴定中通常使用EDTA及其钠盐作为配位剂。
配制EDTA标准溶液一般采用间接法,即先配成近似浓度,再用基准物标定其准确浓度。
配制的钙标准溶液浓度:三、主要试剂和仪器试剂:NaOH 5%(用电子秤称取5.00gNaOH溶解到100ml的水中搅拌至完全溶解放入试剂瓶中备用);1:1 HCl(用一体积的浓盐酸与一体积的水混合而配制成的溶液);钙片:钙、羧基淀粉钠、硬脂酸镁、淀粉。
钙指示剂:少量钙指示剂固体。
仪器:分析天平,研钵,酸式滴定管,500ml 容量瓶,锥形瓶。
四、实验步骤1、0.02mol/L EDTA 溶液的配制和标定(1)配制:称取4g EDTA 二钠盐于250ml 的烧杯中,加水微热溶解,冷却后稀释定容至500ml 容量瓶中。
理论依据:mol/L0.020.25372.244V M m C EDTA ≈⨯=⨯=(2) 标定:用减量法准确称取1.0849g CaCO 3于150ml 烧杯中,先用少量水润湿,盖好表面皿,从杯嘴慢慢滴加1:1 HCl 溶液使之完全溶解,加热煮沸驱尽CO 2,冷却后定量转入500ml 容量瓶,加水稀释至刻度线,充分摇匀,计算钙溶液的准确浓度。

钙中钙含量的测定分析报告1 前言1.1背景介绍钙是人体必需的营养元素,在人体健康和代谢中起着非常的重要作用。
钙片是矿物质类非处方药,主要用于预防和治疗钙缺乏症,如骨质疏松、手足抽搐症、骨发育不全、佝偻病以及妊娠和哺乳期妇女、绝经期妇女钙的补充。
1.2人体补钙的原因及补钙的途径钙的作用钙是我们的生命之源,是人体健康必不可少的重要元素。
1、心动节律的维持:(小白鼠及危重病人的例子)。
2、神经冲动的传递:大脑支配人的行动,支配人的肢体,如果缺钙可造成人体动作的缓慢,以及老年痴呆症、健忘症、儿童多动症等。
3、肌肉的伸缩:缺钙人就没有力量,就不能产生爆发力。
4、加快白细胞的吞噬:提高人体的免疫力。
补钙首先应该从丰富食物种类入手,尽量通过改善饮食结构,达到从天然食品中获取足量钙的目的其次才是选择补钙产品1.3国家对非处方类药的相关规定1、非处方药药品自药品监督管理部门核发《非处方药药品审核登记证书》之日起12个月后,其药品标签、使用说明书、内包装、外包装上必须印有非处方药专有标识2、经营非处方药药品的企业在使用非处方药专有标识时,必须按照国家药品监督管理局公布的坐标比例和色标要求使用3、使用非处方药专有标识时,药品的使用说明书和大包装可单色印刷,标签和其他包装必须按国家药品监督管理局公布的色标要求印刷。
单色印刷时,非处方药专有标识下方必须标示"甲类"或"乙类"字样1.4文献资料综述(1)管美英.双氨酸钙片中钙含量的测定.采用EDTA络合滴定法测定钙含量[1](2)李玉.氨基酸钙片钙含量的测定.采用EDTA络合滴定法测定钙含量[2](3)汪凤云.原子吸收分光光度法测碳酸钙钙片中钙含量.采用火焰原子吸收分光光度法测定钙片中的钙[3]2 具体方案2.1实验原理实验样品经消化后,导入原子吸收分光光度计中,再经火焰原子化,吸收422.7nm的共振线,其吸光度与含量成正比,然后与标准系列比较定量,即可求出钙的具体含量2.2实验试剂及设备试药和试剂:盐酸,高纯度的氧化镧,优级纯度的硝酸,高氯酸,高钙片(批号为20040301-120040910)。

无机及分析化学实训报告钙片中钙含量的测定班级:化工101组员:曹莹莹刘杨指导教师:张孟存杨金梅张辉日期:2010年12月25日钙片中钙含量的测定1实验背景钙制剂与人体关系碳酸钙:含钙量高,副作用小,价格便宜,吸收率高,可以达到40%,与牛奶相似,是广泛应用的一种钙制剂。
还可以多食一些含钙的食物(骨头汤、虾皮、小鱼),补一些维生素D类的食物(海鱼、动物肝脏、蛋黄和瘦肉中。
另外像脱脂牛奶、鱼肝油、乳酪、坚果和海产品、添加维他命D的营养强化食品)。
还要多晒太阳。
这是最安全的办法,用于预防和治疗钙缺乏症,如骨质疏松、手足抽搐症、骨发育不全、佝偻病以及儿童、妊娠和哺乳期妇女、绝经期妇女、老年人钙的补充下面是通过实验得出验证进行钙片中钙含量的测定。
二、实验原理EDTA能和大多数金属离子形成1:1的稳定化合物,所以配位滴定中通常使用EDTA及其钠盐作为配位剂。
配制EDTA标准溶液一般采用间接法,即先配成近似浓度,再用基准物标定其准确浓度。
配制的钙标准溶液浓度:三、主要试剂和仪器试剂:NaOH 5%(用电子秤称取5.00gNaOH溶解到100ml的水中搅拌至完全溶解放入试剂瓶中备用);1:1 HCl(用一体积的浓盐酸与一体积的水混合而配制成的溶液);钙片:钙、羧基淀粉钠、硬脂酸镁、淀粉。
钙指示剂:少量钙指示剂固体。
仪器:分析天平,研钵,酸式滴定管,500ml 容量瓶,锥形瓶。
四、实验步骤1、0.02mol/L EDTA 溶液的配制和标定(1)配制:称取4g EDTA 二钠盐于250ml 的烧杯中,加水微热溶解,冷却后稀释定容至500ml 容量瓶中。
理论依据:mol/L0.020.25372.244V M m C EDTA ≈⨯=⨯=(2) 标定:用减量法准确称取1.0849g CaCO 3于150ml 烧杯中,先用少量水润湿,盖好表面皿,从杯嘴慢慢滴加1:1 HCl 溶液使之完全溶解,加热煮沸驱尽CO 2,冷却后定量转入500ml 容量瓶,加水稀释至刻度线,充分摇匀,计算钙溶液的准确浓度。

原子吸收光谱分析钙片中钙含量的测定高伟环境工程0801200829090119钙离子在人体中的作用钙离子是维持机体细胞正常功能的非常重要的离子,它对于维持细胞膜两侧的生物电位,维持正常的神经传导功能。
维持正常的肌肉伸缩与舒张功能以及神经-肌肉传导功能,还有一些激素的作用机制均通过钙离子表现出来。
1、维持正常的肌细胞功能,保证肌肉的收缩与舒张功能正常。
2、对于心血管系统,钙离子通过细胞膜上的钙离子通道,进入胞内,通过一系列生化反应,主要是有加强心肌收缩力,加快心率,加快传导的作用。
因而,细胞外钙离子浓度高则会升高血压,使心收缩力加强,每博输出量增大,因而血压也会相应增高。
重要的抗高血压药物有一种便是钙离子拮抗剂,它使得钙离子通过细胞膜上的钙通道的数量减少,使得心肌收缩力减弱,心率降低,血压下降。
其他心血管系统疾病还有充血性心力衰竭、心律失常等,病因均与钙离子关系密切。
4、钙离子对与骨骼的生长发育有着重要的作用,在年轻时,这主要受激素(降钙素、甲状旁腺素等)的调节。
老年人骨骼钙易流失,因此骨骼变脆,变得容易骨折。
科学补钙:据全国营养调查,我国31个省、市、自治区平均每人每天摄入钙为406mg。
儿童、幼儿钙摄入量为平均每天322mg,低于全国人平均钙摄入量,仅为国家推荐量的40%。
(我国钙日标准推荐量:6个月以下的婴儿为400mg,6个月~3岁为600mg,3~11岁为800mg,11~13岁为1000mg,13~16岁为1200mg)新生儿新生儿的体重和身高增长速度较快,需要补钙。
3.0-2岁的宝宝户外活动时间少,饮食还不够丰富,对钙的吸收就会缺乏,此阶段因缺钙而发生佝偻病或佝偻病症状的可能性特别高,因此也需要服用补钙产品。
女性女性缺钙从30岁开始,到了40岁以后,每年丧失骨质约1%,在更年期后,骨质丧失进一步加重,导致骨质疏松。
目前我国孕妇和哺乳妇女平均每日钙摄入量仅为国家钙日推荐量的50%(我国钙日推荐量孕妇早期为1000mg、晚期及乳母为1500mg)。

西南交通大学本科毕业设计(论文)第I页榆林职业技术学院神木校区2011级毕业论文钙片中钙含量的测定摘要钙离子是人体中必不可少的微量元素,无论男女老少都需要合理补充钙离子,而补充钙离子的方法多种多样,可以通过食物补充,也可以通过服用钙片或液体钙来进行补充。
但是补钙过量又会对身体造成一定危害,因此本文主要介绍了利用铬黑T 作指示剂的EDTA络合滴定法测定钙片中的钙含量,得出具体结论,并与钙片说明书中所给的钙含量进行比较,以便人们合理更科学的补钙。
关键词:钙片;钙含量;EDTA络合滴定法;试剂;仪器AbstractCalcium is an essential trace element in human body, both men and women, old and young, need reasonable calcium ion and calcium ion methods varied, can pass food supplement, also can through to take calcium tablet or liquid calcium supplement. But calcium overload will cause certain harm to the body, so this article mainly introduced the chrome black T is used as the indicator of EDTA complexometric titration method for determination of calcium in calcium content, specific conclusions, and calcium tablet instructions given in the calcium content of comparison, so that people are more reasonable scientific calcium supplements.Keywords:Calcium tablet; The calcium content; EDTA complexometric titration; The reagent;The instrument目录摘要 (I)Abstract (II)第1章绪论 (1)1.1 课题研究的背景和意义 (1)1.1.1 课题研究的背景 (1)1.1.2 课题研究的目的和意义 (1)1.2 研究对象的性质和作用 (1)1.2.1 物理性质 (1)1.2.2 化学性质 (1)1.2.3 钙离子在人体中的作用 (3)1.3 理论基础和处理技术 (5)1.3.1 原子吸收光谱法 (5)1.3.2 高锰酸钾法 (5)1.3.3 酸碱滴定法 (6)1.4 本课题研究的内容和方法 (7)第2章试验仪器和试剂 (8)2.1 主要试剂 (8)2.2 主要仪器 (8)第3章试验原理 (9)4.1 EDTA浓度的标定 (10)4.2 钙制剂中钙含量的测定 (10)第5章数据分析与讨论 (11)5.1 EDTA的标定实验数据记录 (11)5.1.1 数据记录 (11)5.1.2 数据处理 (11)5.2 钙含量的测定数据记录 (12)5.2.1 数据记录 (12)5.2.2 数据处理 (13)5.3 钙含量计算 (13)结论 (14)致谢 (15)参考文献 (16)榆林职业技术学院神木校区毕业论文第1章绪论1.1 课题研究的背景和意义1.1.1 课题研究的背景目前,市场上的补钙制剂中大量有效成分为碳酸钙和葡萄糖酸钙。

补钙食品中钙含量的测定魏晓琴1,唐志华2(1.汉中职业技术学院,陕西汉中723001;2.陕西理工学院化学与环境科学学院,陕西汉中723001)摘要:分别以分光光度法、高锰酸钾滴定法、ED T A滴定法三种不同的方法对两种补钙药片和两种奶粉中钙的含量进行测定。
实验过程和测得结果表明分光光度法比另外两种方法更简单、更准确。
关键词:食品;钙;测定钙是人体内必需的常量元素,除形成骨架之外,主要是通过Ca2+发挥重要的生理作用[1]。
长期以来,人们错误地认为钙这种常量元素比比皆是,能从食物中充分供应而不缺乏。
但医学研究的结果表明,人体容易缺钙,其中以儿童和老人最甚。
现如今补钙已成为一种时尚,市场上补钙的产品种类繁多,含钙量是一项最基本的鉴别其好坏的重要指标,所以测定补钙制剂的钙含量非常重要,寻求一种快速、准确、简便的测定方法也至关重要。
本研究将采用分光光度法、KMnO4滴定法和EDTA滴定法三种方法对市面上出售的几种补钙制剂进行钙含量的测定。
以鉴定这些食品是否合格,并对这三种测定方法进行比较。
1材料和方法1.1实验药品盖天力钙片(每片约含50m g),纳诺卡钙片(每片约含500mg),秦俑奶粉(每100g约含700 mg),雀巢豆奶(每100g约含1200mg);浓硝酸;浓高氯酸;浓硫酸;重铬酸钾;酸性络蓝K (0.002mol/l);氯化钙(0.02mol/l);氢氧化钠;四硼酸钠;盐酸;硫脲;柠檬酸;盐酸;钙指示剂;蒸馏水;EDTA(0.02m ol/l);硫酸;氨水;草酸氨;甲基红;高锰酸钾(0.02mo l/l);1.2主要的设备及仪器T6新世纪紫外可见分光光度计;722N可见分光光度计;pH s-3c型酸度计;分析天平(0.0001g);坩埚(瓷制);容量瓶(100m L);酸式滴定管(50m L);烘箱等。
1.3样品的消化处理分别准确称取7.9398g(盖天力16粒), 4.6030g(纳诺卡2粒),1.1832g(秦俑),1.7121g (雀巢),将试样分别放于瓷坩埚中,加入高氯酸和浓硝酸的混合液(1:4)[2],放置过夜,于200e下加热2h,再于100e下加热1h,使样品液变为无色,将样品液分别移入100ml的容量瓶中,洗涤坩埚3-4次,洗涤液移入容量瓶中,加水至刻线,备用。
原子吸收光谱分析钙片中钙含量的测定高伟环境工程0801200829090119钙离子在人体中的作用钙离子是维持机体细胞正常功能的非常重要的离子,它对于维持细胞膜两侧的生物电位,维持正常的神经传导功能。
维持正常的肌肉伸缩与舒张功能以及神经-肌肉传导功能,还有一些激素的作用机制均通过钙离子表现出来。
1、维持正常的肌细胞功能,保证肌肉的收缩与舒张功能正常。
2、对于心血管系统,钙离子通过细胞膜上的钙离子通道,进入胞内,通过一系列生化反应,主要是有加强心肌收缩力,加快心率,加快传导的作用。
因而,细胞外钙离子浓度高则会升高血压,使心收缩力加强,每博输出量增大,因而血压也会相应增高。
重要的抗高血压药物有一种便是钙离子拮抗剂,它使得钙离子通过细胞膜上的钙通道的数量减少,使得心肌收缩力减弱,心率降低,血压下降。
其他心血管系统疾病还有充血性心力衰竭、心律失常等,病因均与钙离子关系密切。
4、钙离子对与骨骼的生长发育有着重要的作用,在年轻时,这主要受激素(降钙素、甲状旁腺素等)的调节。
老年人骨骼钙易流失,因此骨骼变脆,变得容易骨折。
科学补钙:据全国营养调查,我国31个省、市、自治区平均每人每天摄入钙为406mg。
儿童、幼儿钙摄入量为平均每天322mg,低于全国人平均钙摄入量,仅为国家推荐量的40%。
(我国钙日标准推荐量:6个月以下的婴儿为400mg,6个月~3岁为600mg,3~11岁为800mg,11~13岁为1000mg,13~16岁为1200mg)新生儿新生儿的体重和身高增长速度较快,需要补钙。
3.0-2岁的宝宝户外活动时间少,饮食还不够丰富,对钙的吸收就会缺乏,此阶段因缺钙而发生佝偻病或佝偻病症状的可能性特别高,因此也需要服用补钙产品。
女性女性缺钙从30岁开始,到了40岁以后,每年丧失骨质约1%,在更年期后,骨质丧失进一步加重,导致骨质疏松。
目前我国孕妇和哺乳妇女平均每日钙摄入量仅为国家钙日推荐量的50%(我国钙日推荐量孕妇早期为1000mg、晚期及乳母为1500mg)。
高锰酸钾滴定法测定补钙制品中的钙含量.doc目前, 我国居民摄入钙量严重不足, 尤其是儿童青少年和老年人缺钙比例很高[1]。
为了补充钙, 补钙类保健食品及补钙制品在国内外发展很快。
因此, 钙是保健食品、钙剂制品及乳品中常规营养分析必须检测的质量指标, 而准确提供钙制品中钙的含量, 也是衡量钙制品质量的主要依据。
食品中钙含量的测定通常采用火焰原子吸收光谱法或EDTA 滴定法测定[2- 4]。
火焰原子吸收光谱法适宜测定钙含量较低( 以mg/kg 计) 的含钙食品。
该法虽干扰小, 速度快, 效果好, 但因仪器昂贵、操作技术难掌握, 普通实验室难以普及应用。
对于含量较高的( 以g/100 g 计) 食品, 国家标准方法为EDTA 容量滴定法, 该法虽操作简单, 但存在着干扰现象严重、终点变化不明显、指示剂水溶液不稳定( 固体指示剂用量不易掌握) 且易封闭等问题, 使得测定结果的准确度不高[5]; 并且, 使用剧毒的KCN 易导致环境污染。
关于应用草酸盐沉淀分离、高锰酸钾滴定法测定钙剂制品中的钙含量的研究未见有相关报道。
为此, 笔者进行了高锰酸钾容量滴定法测定补钙制品中钙含量的方法的研究。
1 材料与方法1.1 材料宁波纽斯康药业有限公司生产的脑力通牌高钙片( 执行标准: Q/NSK015) , ESJ60!4 型电子分析天平( 上海龙腾电子有限公司生产) ; 定量滤纸: 中速, 7~9 cm; KMnO4标准溶液: 浓度为0.02 mol/L, 称取KMnO4 试样1.6 g, 溶于500 ml 水中, 盖上表面皿, 加热至沸并保持微沸状态1 h, 冷却后用微孔玻璃漏斗过滤, 滤液贮于棕色玻璃瓶中, 暗处放置1 周后用经105~110 ℃烘干2 h 的Na2C2O4 基准物质标定其浓度; HAc!NH4Ac 缓冲溶液: pH 值为3.5~4.5, 77g NH4Ac 溶于200 ml 水中, 加冰HAc 59 ml, 用水稀释至1 000 ml;H2SO4 溶液: 浓度为1 mol/L; HCl 溶液: 浓度为3 mol/L; 氨水溶液: 浓度为3 mol/L; 甲基橙指示剂: 浓度为1 g/L;( NH4) 2C2O4 溶液: 浓度为40、1 g/L; EDTA 溶液: 浓度为200 g/L;MnSO4 溶液: 浓度为1 mol/L。
实训三盖片中钙含量的测定(高锰酸钾间接滴定法)一、实验目的1.了解沉淀分离的基本要求及操作。
2.掌握氧化还原法间接测定钙含量的原理及方法。
二、实验原理利用某些金属离子(如碱土金属、Pb2+、Cd2+等)与草酸根能形成难溶的草酸盐沉淀的反应,可以用高锰酸钾法间接测定它们的含量。
反应如下:Ca2++C2O42-=CaC2O4↓CaC2O4+H2SO4 =CaSO4+H2C2O45H2C2O4+2MnO42-+6H+= 2Mn2++10 CO2↑+ 8H2O三、试剂仪器试剂:KMnO4溶液 0.02 mol·L-1;草酸胺(NH4C2O4)5 g·L-1;氨水 10%;HCl (1+1),浓H2SO4 1 mol·L-1;甲基橙 2 g·L-1;硝酸银 0.1 mol·L-1。
仪器:分析天平、干燥器、称量瓶、烧杯、水浴锅、漏斗、量杯、酸式滴定管、洗瓶。
四、实验步骤准确称取钙片三份(每份含钙约0.05 g),研碎后分别置于250 mL烧杯中,加入适量蒸馏水及HCl溶液,加热促使其溶解。
于溶液中加入2~3滴甲基橙,以氨水中和溶液由红转变为黄色,趁热逐滴加约50 mL (NH4)2C2O4,在低温电热板(或水浴)上陈化30 min。
冷却后过滤(先将上层清液倾入漏斗中),将烧杯中的沉淀洗涤数次后转入漏斗中,继续洗涤沉淀至无Cl-(承接洗液在HNO3介质中以AgNO3检查),将带有沉淀的滤纸铺在原烧杯的内壁上,用50 mL 1 mol·L-1 H2SO4把沉淀同滤纸上洗入烧杯中,再用洗瓶洗2次加入蒸馏水使总体积约100 mL,加热至70~80℃,用KMnO4标准溶液滴定至溶液呈淡红色,再将滤纸搅入溶液中,若溶液褪色,则继续滴定,直至出现的淡红色30 s内不消失即为终点。
五、数据处理钙的含量= 5 C (V1-V2)40.08/2m ×100%C ——高锰酸钾的浓度V1——消耗高锰酸钾的体积V2——空白消耗的体积m ——奶粉的质量。
测钙片中钙含量的实验原理测钙片中钙含量的实验原理及方法可以通过滴定法进行测量。
滴定法是一种常用的定量分析方法,通过添加一种化学试剂与待测样品反应,从而确定待测物质的含量。
常用的滴定试剂有以亚硝酸盐为主的硬水试剂和以螯合剂为主的柔水试剂,其中硬水试剂常用于测量浓度较高的钙离子,柔水试剂用于测量浓度较低的钙离子。
测量钙片中钙含量的实验步骤如下:1. 准备工作:- 称取适量的钙片样品,并记录样品的质量。
- 预先准备好所需的试剂溶液:硬水试剂或柔水试剂。
- 清洗和准备好所有用于滴定的仪器,如烧杯、滴定管、酒精灯等。
2. 滴定过程:- 取一定量的钙片样品,将其溶解在适量的水中,搅拌至完全溶解。
- 取一定量的溶液,并加入适量的指示剂(如钴硝酸盐指示剂),使溶液呈现明显的颜色变化。
- 通过滴定管,滴加试剂到待测溶液中,同时轻轻搅拌。
- 当溶液颜色由浅变深并保持一段时间后,停止滴定,并记录滴定所需的试剂用量。
3. 计算计算:- 根据滴定所需的试剂用量,计算出待测样品中钙的含量。
- 根据滴定方程式和滴定试剂的浓度,可以计算出每滴试剂对应的钙离子的含量。
- 根据滴定所需的试剂用量和反应方程式,计算出待测样品中钙的摩尔浓度。
- 最后,根据样品的质量,可以计算出待测样品中钙的重量浓度。
需要注意的是,在进行滴定实验时,应注意以下几点:1. 试剂的选择:根据待测样品中钙的浓度,选择合适的试剂溶液进行滴定,以确保实验的准确性和结果的可靠性。
硬水试剂适用于浓度较高的钙离子,柔水试剂适用于浓度较低的钙离子。
2. 指示剂的选择:选择适合的指示剂对颜色的变化进行观察,以确定滴定的终点。
常用的指示剂有钴硝酸盐指示剂和酸碱指示剂等。
3. 滴定过程中的操作:在滴定过程中,应保持溶液的搅拌均匀,以确保反应的充分和均匀,同时还应控制滴定的速度,避免滴加过快或过慢而影响实验结果。
4. 数据处理:根据滴定所需的试剂用量、浓度和样品质量,进行数据的计算和处理,最终得到钙含量的测定结果。
竭诚为您提供优质文档/双击可除钙盐中钙含量的测定实验报告篇一:分析化学实验钙片中钙含量的测定实验报告实验报告姓名:班级:同组人:项目钙片中钙含量的测定课程:分析化学学号:一、实验目的1、掌握标定eDTA方法。
22、掌握eDTA法测定水中ca含量的原理和方法。
二、实验原理eDTA(na2h2Y)标准溶液可用直接法配制,也可先配制粗略浓度,再用金属Zn,Zno,caco3或mgso4·7h2o等基准物质来标定。
当用caco3标定时,用铬黑T(h3In)做指示剂,在ph=12~13的缓冲溶液中进行,滴定到溶液呈蓝色而指示终点。
钙制剂一般用酸溶解后调节ph=12-13,减少mg2+干扰。
以钙指示剂为指示剂,指示剂与钙离子生成酒红色络合物,当用eDTA注定终点时,游离出指示剂,溶液呈现蓝色。
若测定时室温过低,可将水样加热至30-40℃,滴定时要注意速度不可太快,并不断摇动,使充分反应。
三、仪器和药品仪器:250mL锥形瓶3个,50mL酸式滴定管1支,25、50mL 移液管1支,10mL量筒1个,250ml,烧杯1个。
研钵、250mL 容量瓶2个、250mL细口瓶试剂:0.01mol/LeDTA标准溶液、caco3标准溶液、6mol/Lnaoh溶液、铬黑T指示剂、钙指示剂、6mol/Lhcl、糖钙片四、内容及步骤1.以caco3为基准物标定eDTA(1)配制0.01000mol/L钙标准溶液准确称取caco30.25~0.26g,置于250mL烧杯中,加几滴水,滴加6mol/Lhcl5mL直至caco3完全溶解,再过量1~2滴,用水冲洗烧杯内壁,然后将溶液移入250mL容量瓶中,再加水至刻度,摇匀。
(2)eDTA(0.01mol/L)配制:称取2geDTA二钠盐于250ml的烧杯中,加水溶解后稀释至500ml,储于聚乙烯瓶中备用。
(3)eDTA溶液浓渡的标定用25mL移液管吸钙标准溶液置于250mL锥形瓶中,再加ph=10的缓冲溶液5mL,加水稀释至100mL,加少许(约0.1g)铬黑T指示剂,用待标定的eDTA溶液滴定至溶液由酒红色变为纯蓝色,即为滴定终点。
实验报告姓名:班级:同组人:项目钙片中钙含量的测定课程:分析化学学号:一、实验目的1、掌握标定EDTA方法。
2、掌握EDTA法测定水中Ca2含量的原理和方法。
二、实验原理EDTA(Na2H2Y)标准溶液可用直接法配制,也可先配制粗略浓度,再用金属Zn,ZnO,CaCO3或MgSO4·7H2O等基准物质来标定。
当用CaCO3标定时,用铬黑T(H3In)做指示剂,在PH=12~13的缓冲溶液中进行,滴定到溶液呈蓝色而指示终点。
钙制剂一般用酸溶解后调节pH=12-13,减少Mg2+干扰。
以钙指示剂为指示剂,指示剂与钙离子生成酒红色络合物,当用EDTA注定终点时,游离出指示剂,溶液呈现蓝色。
若测定时室温过低,可将水样加热至30-40℃,滴定时要注意速度不可太快,并不断摇动,使充分反应。
三、仪器和药品仪器:250mL锥形瓶3个,50mL酸式滴定管1支,25、50mL移液管1支, 10mL量筒1个,250ml,烧杯1个。
研钵、250mL容量瓶2个、250mL细口瓶试剂:0.01mol/LEDTA标准溶液、CaCO3标准溶液、6mol/LNaOH溶液、铬黑T指示剂、钙指示剂、6mol/L HCl、糖钙片四、内容及步骤1.以CaCO3为基准物标定EDTA(1)配制0.01000mol/L钙标准溶液准确称取CaCO30.25~0.26g,置于250mL烧杯中,加几滴水,滴加6mol/L HCl 5mL直至CaCO3完全溶解,再过量1~2滴,用水冲洗烧杯内壁,然后将溶液移入250mL容量瓶中,再加水至刻度,摇匀。
(2)EDTA(0.01mol/L)配制:称取2g EDTA二钠盐于250ml的烧杯中,加水溶解后稀释至500ml,储于聚乙烯瓶中备用。
(3)EDTA溶液浓渡的标定用25mL移液管吸钙标准溶液置于250mL锥形瓶中,再加PH=10的缓冲溶液5mL,加水稀释至100mL,加少许(约0.1g)铬黑T指示剂,用待标定的EDTA溶液滴定至溶液由酒红色变为纯蓝色,即为滴定终点。
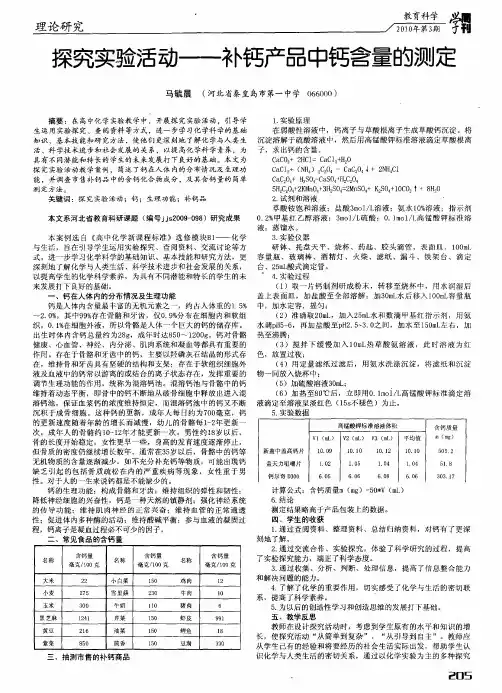
实 验 报 告
姓名: 班级: 同组人: 自评成绩: 项目: 市售钙片中钙含量的测定 课程: 学号:
一、实验目的
1. 掌握用所学知识解决实际问题的方法,提高分析问题、解决问题的能力。
2. 掌握配位滴定法中加入辅助指示剂指示滴定终点的原理。
3. 掌握滴定分析方法和操作技术。
二、实验原理
市售的钙片中,钙通常以葡萄糖酸钙和磷酸氢钙的形式存在,二者均较难溶于水。
测定其含量时,先将试样加稀硫酸或盐酸处理成溶液。
[CH 2OH(CHOH)4COO]2Ca + 2H + ══ 2CH 2OH(CHOH)4COOH + Ca 2+
CaHPO 4 + H + ══ Ca 2+ + 42PO H
钙片中Ca 2+的含量测定可采用EDTA 法,以NH 3・H 2O-NH 4Cl 为缓冲液(pH=10),
以铬黑T 为指示剂,MgY 2-为辅助指示剂,EDTA 标准溶液为滴定剂进行测定。
因为铬黑T 在pH=10的条件下,与Ca 2+形成的配合物不够稳定,会使终点提前,而且显色不够敏锐,而铬黑T 与Mg 2+形成的显色配合物相当稳定,因此,在pH=10的条件下用EDTA 标准溶液滴定Ca 2+时,常于溶液中加入少量的MgY 2-作辅助指示剂。
在滴定过程中,MgY 2-并不消耗EDTA ,只是起到辅助铬黑T 指示终点的作用。
当在含有Ca 2+的试液中加入铬黑T 及MgY 2-混合液后,发生下列反应: Mg 2+ + HIn 2- (纯蓝色)══ MgIn -(酒红色)+ H +
MgIn ˉ(酒红色)+H 2Y 2- ══ MgY 2- + HIn 2- (纯蓝色)+ H + MgY 2- + Ca 2+ ══ CaY 2- + Mg 2+
滴定时,EDTA 标准溶液先与游离的Ca 2+配位,故终点前溶液显MgIn ˉ的酒红色。
当到达滴定终点时,EDTA 夺取MgIn -中的Mg 2+生成更加稳定的MgY 2-,从而置换出铬黑T 指示剂使其游离,结果使溶液由酒红色变为纯蓝色:
H 2Y 2- + MgIn -(酒红色)══ HIn 2- (纯蓝色)+ MgY 2- + H +
注意事项:钙片溶解慢,要等充分溶解后再滴定。
三、仪器和药品
仪器: 酸式滴定管(50mL ),研钵,烧杯,容量瓶(250mL),移液管(25mL),锥形瓶,玻璃棒,电炉,硬质玻璃瓶。
试剂: 钙片,EDTA 标准溶液(0.05mol/L),HCl(1mol/L),铬黑T 指示剂或钙指示剂,NH 3・H 2O-NH 4Cl 缓冲液(pH=10),稀MgSO 4试剂。
四、内容及步骤 1. 溶解钙片
准确称取市售钙片5~8g ,研细放入烧杯中,加入大约10mL 蒸馏水,然后逐滴加入约5mL1mo1/L HCl ,边加边搅拌,至溶解,若溶解较慢,可适当加热,加水定容于250mL 容量瓶中。
2. 配制辅助指示剂
50mL 蒸馏水中加NH 3・H 2O-NH 4Cl 缓冲液50mL ,稀MgSO 4试液5滴,铬黑T 指示剂适量(约0.5g),用EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色。
3. 滴定
用移液管准确量取25mL 供试液于锥形瓶中,加5mL pH=10的NH 3・H 2O-NH 4Cl 缓冲液缓冲液,加入辅助指示剂20mL ,摇匀,用EDTA 标准溶液滴定至酒红色变为纯蓝色为止,记录EDTA 用量,平行测定三次。
五、实验结果记录与计算
%100250
1000%/Ca
EDTA EDTA Ca ⨯⨯
⨯
⨯=
试样m M V c ω (08.40Ca
=M
)
六、思考题:
1.为什么滴定Ca 2+时要控制溶液pH=12?
2、对Ca 2+的测定还可用哪种指示剂指示终点?为什么?
教师评语: 年 月 日。