生物化学实验六——酵母RNA的提取与含量测定 山东大学实验报告
- 格式:doc
- 大小:68.50 KB
- 文档页数:3
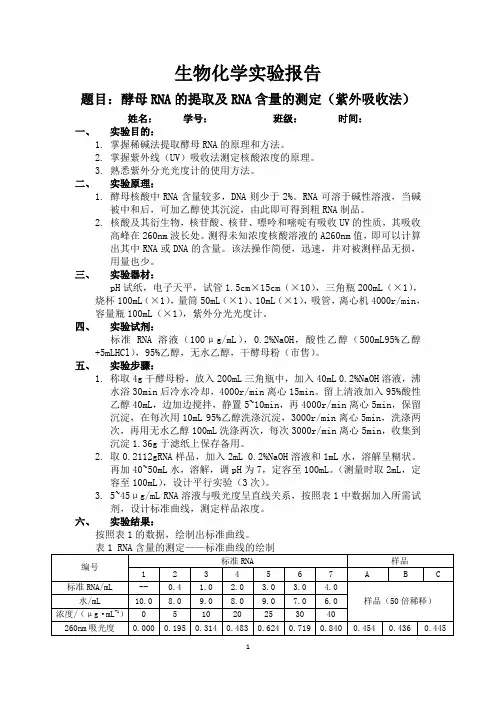
生物化学实验报告题目:酵母RNA的提取及RNA含量的测定(紫外吸收法)姓名:学号:班级:时间:一、实验目的:1.掌握稀碱法提取酵母RNA的原理和方法。
2.掌握紫外线(UV)吸收法测定核酸浓度的原理。
3.熟悉紫外分光光度计的使用方法。
二、实验原理:1.酵母核酸中RNA含量较多,DNA则少于2%。
RNA可溶于碱性溶液,当碱被中和后,可加乙醇使其沉淀,由此即可得到粗RNA制品。
2.核酸及其衍生物,核苷酸、核苷、嘌呤和嘧啶有吸收UV的性质,其吸收高峰在260nm波长处。
测得未知浓度核酸溶液的A260nm值,即可以计算出其中RNA或DNA的含量。
该法操作简便,迅速,并对被测样品无损,用量也少。
三、实验器材:pH试纸,电子天平,试管1.5cm×15cm(×10),三角瓶200mL(×1),烧杯100mL(×1),量筒50mL(×1)、10mL(×1),吸管,离心机4000r/min,容量瓶100mL(×1),紫外分光光度计。
四、实验试剂:标准RNA溶液(100μg/mL),0.2%NaOH,酸性乙醇(500mL95%乙醇+5mLHCl),95%乙醇,无水乙醇,干酵母粉(市售)。
五、实验步骤:1.称取4g干酵母粉,放入200mL三角瓶中,加入40mL 0.2%NaOH溶液,沸水浴30min后冷水冷却,4000r/min离心15min。
留上清液加入95%酸性乙醇40mL,边加边搅拌,静置5~10min,再4000r/min离心5min,保留沉淀,在每次用10mL 95%乙醇洗涤沉淀,3000r/min离心5min,洗涤两次,再用无水乙醇100mL洗涤两次,每次3000r/min离心5min,收集到沉淀1.36g于滤纸上保存备用。
2.取0.2112gRNA样品,加入2mL 0.2%NaOH溶液和1mL水,溶解呈糊状。
再加40~50mL水,溶解,调pH为7,定容至100mL。

酵母RNA的提取和含量测定一、实验原理1、RNA的提取工业上提取RNA通常选用低成本、适于大规模操作的稀碱法或浓盐法,这两种方法提取的核酸均为变性的RNA,主要用作制备单核苷酸的原料,工艺较简单。
酵母细胞富含核酸,且核酸主要为RNA,含量为干菌体的2.7%-10%,而DNA 含量较少,仅为0.3%-0.5%,故常用酵母作提取RNA的原料。
稀碱法是用NaOH使酵母细胞壁变性、裂解,然后用酸中和。
偏酸性条件下RNA进入水相,而蛋白质和菌体沉淀。
除去蛋白质和菌体的溶液用乙醇沉淀RNA 或调pH至等电点(2.5)附近使RNA沉淀。
2、RNA含量的测定(苔黑酚法)RNA与浓盐酸共热时,即发生降解。
分子中的核糖转变为α-呋喃甲醛(糠醛),后者在氯化铁催化下与苔黑酚(3,5-二羟甲基苯)作用生成绿色复合物,可在670nm下用比色法测定含量。
在RNA浓度为10~100μg/mL范围内,产物浓度与吸光度呈线性关系。
本法特异性较差,凡属戊糖均有此反应。
某些己糖在持续加热后生成的羟甲基糖醛也能与苔黑酚反应,产生显色复合物。
微量DNA无影响,较多DNA存在时,亦有干扰作用。
可以利用RNA和DNA显色复合物的最大吸光吸收不同,且在不同时间显示最大色度加以区分。
反应2min后,DNA在600nm呈现最大光吸收,而RNA在反应15min后,在670nm呈现最大光吸收。
二、实验器材1、仪器:电子天平、抽滤瓶、布氏漏斗、离心机、烧杯若干、量筒(10mL、50mL)、pH试纸(1~14)、5mL吸管;试管*8、紫外分光光度计、水浴锅。
2、试剂:市售干酵母粉、0.2%氢氧化钠溶液、乙酸(A.R)、95%乙醇、无水乙醚(A.R);标准RNA溶液(100μg/mL)、苔黑酚-三氯化铁试剂。
三、操作记录1、RNA的提取称取8.05g干酵母粉于100mL烧杯中,加入0.2%NaOH溶液40mL,沸水浴加热30min,加热过程中经常搅拌冷却,加入乙酸数滴,使提取液呈微酸性(pH5~6),离心10~15min(4000r/min)。

RNA的提取及含量测定一、实验目的与要求1、了解并掌握稀碱法提取RNA的原理和方法;2、了解测量核酸浓度不同方法的原理;3、熟悉和掌握紫外吸收法测定核酸含量原理和操作方法;4、熟悉紫外分光光度计的基本原理和使用方法。
二、实验原理1、RNA提取原理:由于RNA的来源和种类很多,因而提取制备方法也很各异。
一般有苯酚法、去污剂法和盐酸胍法。
其中苯酚法又是实验是最常用的。
组织匀浆用苯酚处理并离心后,RNA即溶于上层被酚饱和的水相中,DNA和蛋白质则留在酚层中。
向水层加入乙醇后,RNA即以白色絮状沉淀析出,此法能较好的除去DNA和蛋白质。
上述方法提取的RNA具有生物活性。
工业上常用稀碱法和浓盐法提取RNA,用这两种方法所提取的核酸均为变性的RNA,主要用作制备核苷酸的原料,其工艺比较简单。
浓盐法使用10%左右氯化钠溶液,90℃提取3-4h,迅速冷却,提取液经离心后, 上清液用乙醇沉淀RNA。
稀碱法使用稀碱使酵母细胞裂解,然后用酸中和,除去蛋白质和菌体后的上清液用乙醇沉淀RNA或调pH2.5利用等电点沉淀。
酵母含RNA达2.67-10.0%,而DNA含量仅为0.03-0.516%,为此,提取RNA多以酵母为原料。
2、测定RNA含量的方法:(1)紫外吸收法原理:核酸具有吸收紫外线的性质,在波长260纳米处有最大吸收,且在一定浓度范围内光吸收值与浓度成正比(0—50微克/毫升),符合朗伯-比尔定律。
优点样品用量少,不用显色,测完后样品可以继续使用。
(2)地衣酚显色法:核酸与浓盐酸共热,放生降解,生成糠醛,后者与地衣酚反应,在三价铁离子或二价铜离子作用下,生成鲜绿色的复合物,670纳米处有最大吸收,且光吸收值与浓度成正比,符合朗伯-比尔定律。
缺点反应特异性差,易受干扰。
(3)定磷法:在酸性环境中,定磷试剂中的钼酸铵以钼酸形式与样品中无机磷酸生成磷钼酸,当有还原剂存在时,磷钼酸立即被还原生成蓝色的还原产物--钼蓝,其最大吸收在660纳米处,当无机磷含量在每毫升1-25微克范围内,光吸收与含磷量成正比。


酵母RNA的提取实验报告实验报告:酵母RNA的提取一、实验目的1.学习和掌握酵母RNA的提取基本原理和方法。
2.了解RNA在生物体内的生物功能及其重要性。
3.培养实验技巧和操作能力,提高实验素养。
二、实验原理RNA(核糖核酸)是生物体内的重要生物分子之一,它参与蛋白质合成、基因表达等重要生命活动。
酵母是一种常用的真核生物模型,其RNA提取方法与人体、植物等真核生物类似。
本实验采用氯仿-异戊醇法提取酵母RNA。
主要步骤包括细胞破碎、离心分离、有机溶剂抽提、乙醇沉淀等。
三、实验步骤1.准备试剂和器材(1)试剂:氯仿、异戊醇、无水乙醇、DEPC水、RNA酶。
(2)器材:研钵、离心管、移液器、玻璃棒、氮气吹干器、分光光度计等。
2.酵母细胞破碎(1)在冰上用研钵将酵母细胞研磨成粉末。
(2)加入适量DEPC水,搅拌均匀。
(3)用玻璃棒将细胞碎片挑出,弃去上清液。
(4)加入适量DEPC水,搅拌均匀,重复上述步骤,直到细胞完全破碎。
3.离心分离(1)将破碎的酵母细胞溶液转移到离心管中。
(2)在4℃下,以12000rpm的转速离心15分钟。
4.有机溶剂抽提(1)用移液器将上清液小心地转移到另一个离心管中。
(2)加入等体积的氯仿-异戊醇混合液(氯仿:异戊醇=24:1),用玻璃棒搅拌均匀。
(3)在4℃下,以12000rpm的转速离心15分钟。
5.乙醇沉淀(1)将上清液转移到新的离心管中,并加入等体积的无水乙醇,用玻璃棒搅拌均匀。
(2)在4℃下,以12000rpm的转速离心15分钟。
6.洗涤和干燥(1)用移液器小心地将上清液吸出,留下沉淀物。
(2)加入适量75%乙醇,用玻璃棒搅拌均匀,去除残留的乙醇和水分。
(3)在氮气吹干器下将沉淀物吹干约5分钟。
7.RNA溶解与定量(1)加入适量DEPC水,将沉淀物溶解。
(2)用分光光度计测定RNA溶液的吸光度值(A260nm),计算RNA浓度。
四、实验结果与分析表1:酵母RNA提取结果本实验通过氯仿-异戊醇法成功地提取出了高浓度的酵母RNA。

酵母rna的提取实验报告酵母RNA的提取实验报告引言:RNA是一种重要的生物分子,它在细胞内承担着转录和翻译的重要功能。
在分子生物学研究中,提取RNA是一项常见的实验操作。
本实验旨在通过提取酵母细胞中的RNA,探究RNA的提取方法和应用。
材料与方法:1. 实验材料:酵母细胞、细胞裂解缓冲液、RNA提取试剂盒、异丙醇、氯仿、异丁醇、乙醇、载玻片、显微镜等。
2. 实验步骤:a. 酵母细胞的培养与收获:将酵母细胞培养于培养基中,通过离心将细胞收获。
b. 细胞裂解:将收获的细胞用细胞裂解缓冲液裂解,以释放RNA。
c. RNA提取:使用RNA提取试剂盒,按照说明书中的步骤进行RNA提取。
d. 纯化RNA:通过异丙醇沉淀和氯仿萃取,去除DNA和蛋白质等杂质。
e. 洗涤与干燥:使用异丁醇和乙醇进行洗涤,最后将RNA干燥。
f. 检测RNA:将提取得到的RNA溶解于适当的缓冲液中,使用紫外可见光谱仪或显微镜观察RNA的浓度和纯度。
结果与讨论:通过上述实验步骤,我们成功地提取到了酵母细胞中的RNA。
在实验过程中,我们注意到以下几点:1. 细胞裂解的缓冲液选择:细胞裂解缓冲液的选择对RNA提取至关重要。
合适的缓冲液可以有效地破坏细胞膜,释放细胞内的RNA。
在本实验中,我们选择了一种经充分验证的缓冲液,以确保细胞能够完全裂解。
2. RNA提取试剂盒的使用:RNA提取试剂盒是一种常用的RNA提取方法。
它通过特定的试剂和离心步骤,将RNA从细胞裂解物中分离出来。
在本实验中,我们按照试剂盒的说明书进行操作,成功地提取到了RNA。
3. RNA的纯化:RNA的纯化是为了去除细胞裂解物中的杂质,如DNA和蛋白质。
在本实验中,我们使用了异丙醇沉淀和氯仿萃取的方法,成功地纯化了RNA。
这些方法可以有效地去除DNA和蛋白质,提高RNA的纯度。
4. RNA的检测:在实验中,我们使用紫外可见光谱仪或显微镜对提取得到的RNA进行检测。
通过观察RNA的浓度和纯度,我们可以评估提取的RNA是否适用于后续的实验操作。

酵母RNA的提取紫外吸收法测RNA浓度实验报告一、实验目的1、掌握稀碱法提取酵母RNA的原理和方法。
2、掌握紫外线(UV吸收法测定核酸浓度的原理。
3、熟悉紫外分光光度计的使用方法。
二、实验原理核酸是生命的最基本物质之一,广泛存在于所有动植物细胞、微生物体内。
对核酸的研究是更深入研究生命体的基本前提之一。
研究核酸需要纯度很高的核酸,所以核酸的提取方法也就在生物学研究中相当重要。
本次实验提取酵母的核糖核酸(RNA o RNA离体后稳定性很差,含量低,所以在提取的时候就要注意防止核酸的降解和变性,防止过酸、过碱、避免剧烈搅拌,尤其重要的是防止RNA 酶的作用。
本实验是医药卫生领域与大工业生产的基础方法。
核酸(RNA都是由核苷酸组成的多聚核苷酸化合物,而核苷酸是由糖、碱基和磷酸以等分子比例构成的,故测定组成核苷酸的任意一种组分即可以测定生物体内核酸的含量或者是提取出来的核酸的含量。
提取RNA的方法很多,在工业生产上常用的是稀碱法和浓盐法。
前者是利用碱使细菌细胞壁溶解,是RNA释放出来,后者是在加热的条件下,利用高浓度的盐改变细胞膜的通透性,使RNA释放出来。
使用浓盐法提取RNA勺时候应该注意掌握温度,直接至90~100C浸提,避免在20~70C的时间过长,因为这是磷酸二酯酶和磷酸单酯酶的作用活跃的温度范围,会使RNA降解而降低提取率。
这两种方法是从废弃的啤酒酵母中提取RNA的—般方法。
但是这两种方法各有利弊,如浓盐法提取的RNA纯度高,而稀碱法提取的时间短,提取率高,更利于工业化生产。
RNA在260nm处有最大吸收峰,一定浓度范围内其浓度与吸光度成正比,故可以用紫外分光光度计通过比色来测定RNA t量。
由于蛋白质在280nm波长处也有光吸收,对RNA测定有一定的干扰作用,但蛋白质的最大吸收峰在280nm 处,如同时测定280nm的光吸收,通过计算可消除其对RNA M定的影响。
因此如其中含有蛋白质时必须同时测定280nm和260nm的吸光度,可通过计算测定溶液中RNA的含量。

酵母RNA的提取和含量测定姓名:周超学号:201100140067班级:11级生命基地同组者:刘炳煜时间:2011年3月26日【实验目的】1.掌握稀间法提取酵母RNA的原理和方法2.了解测量核算浓度的不同方法的原理3.掌握紫外吸收法测定核酸浓度的原理和技术4.学会使用紫外分光光度计5.学会使用离心机【实验原理】1.酵母RNA提取的原理:(1)酵母核酸中RNA含量较多,DNA则少与2%(2)RNA可溶于碱性溶液,当碱被中和后,可加入乙醇使其沉淀,由此可制得粗RNA制品。
(3)用碱提取的RNA有不同程度的降解。
2.紫外吸收法测RNA含量的原理:(1)核酸具有吸收紫外线的性质,在波长260nm处有最大吸收,且在一定浓度范围内光吸收值与浓度成正比(5-45ug/ml),符合朗伯-比尔定律。
(2)优点:操作简单,样品用量少,不用显色,测完后样品可以继续使用。
(3)缺点:当有大分子物质存在时,也会有一定的吸收,会影响测量精确度。
【实验试剂】1.提取试剂:0.2% NaOH溶液酸性乙醇:5ml浓HCl加入到500ml95%乙醇中混匀 95%乙醇无水乙醇2.含量测定试剂:0.2% NaOH溶液pH试纸(1-14)标准核酸:200ug/ml待测样品核酸【实验步骤】1.酵母RNA的提取:(1)将4g干酵母粉放入200ml锥形瓶中,加入40ml 0.2%的NaOH溶液混匀。
(2)沸水浴30min,然后用流水冷却(3) 4000转/分离心 15秒,保留上清液(4)在上清液中加入40ml酸性乙醇,边加边搅拌,静置5分钟左右,再4000转/分离心5分钟,保留沉淀(5)用20ml 95%乙醇分两次洗涤沉淀,每次洗后3000转/分离心5分钟(6)用20ml无水乙醇分两次洗涤,每次洗后3000转/分离心5分钟(7)收集沉淀于滤纸上备用。
2.RNA含量的测定:(1)准确称取0.2-0.25g(因提取到的RNA粗品量太少,本次实验使用的RNA 量仅为0.1910g)样品核酸,加2ml 0.2% NaOH溶液和1ml水溶解,调成糊状(2)再加入50ml左右的水溶解,边溶解边转移到100ml烧杯中,用0.2% NaOH 调至中性,定容至100ml(3)再分3次取2.5ml定容至100ml备用,做平行实验(4)取200ug/ml的标准RNA 20ml,加水定容至100ml,得到40ug/ml的RNA 备用(5)再将40ug/ml的RNA按表一加样稀释,得到5ug/ml、10 ug/ml、20 ug/ml、30 ug/ml、40 ug/ml的标准溶液(6)用紫外分光光度计测量吸光值,绘制标准曲线,计算样品纯度。


酵母rna的提取实验报告酵母RNA的提取实验报告。
实验目的,通过实验研究酵母RNA的提取方法,为后续的基因表达调控研究提供技术支持。
实验材料与方法:1. 实验材料,酵母细胞培养物、TRIzol试剂、异丙醇、氯仿、乙醇、DEPC水等。
2. 样品制备,取酵母培养物,离心收集酵母细胞,冰上洗涤去除培养基。
3. 细胞破碎,向酵母细胞中加入TRIzol试剂,用离心管摇匀,静置离心管5分钟。
4. RNA提取,加入氯仿,摇匀,离心分离上清液,上清液转移至新离心管中,加入异丙醇沉淀RNA。
5. RNA沉淀,离心沉淀RNA,弃上清液,加入乙醇洗涤RNA,再次离心沉淀RNA。
6. RNA溶解,用DEPC水溶解RNA,测定纯度和浓度。
实验结果:1. 细胞破碎,经过加入TRIzol试剂处理后,酵母细胞成功破碎,形成混浊的混合液。
2. RNA提取,通过氯仿萃取法,成功分离出上清液中的RNA,得到透明的上清液。
3. RNA沉淀,加入异丙醇后,观察到RNA在离心管底部形成白色沉淀。
4. RNA溶解,最终得到溶解度较高的RNA样品,纯度和浓度符合实验要求。
实验分析:本次实验采用的酵母RNA提取方法较为简单,通过TRIzol试剂的使用,成功实现了酵母细胞的破碎和RNA的提取。
氯仿的加入有效分离出RNA,异丙醇的沉淀步骤也取得了良好的效果。
最终得到的RNA样品纯度高,浓度适宜,可以用于后续的实验研究。
实验结论:本实验成功建立了一种适用于酵母细胞的RNA提取方法,为后续的基因表达调控研究提供了可靠的技术支持。
该方法操作简便,提取效果良好,适用于大规模样品的提取工作。
参考文献:1. Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem. 1987Apr;162(1):156-9.2. Schmitt ME, Brown TA, Trumpower BL. A rapid and simple method for preparation of RNA from Saccharomyces cerevisiae. Nucleic Acids Res. 1990 Jan25;18(10):3091-2.。

酵母中RNA的提取与含量测定酵母是一类广泛应用于工业生产中的微生物,具有高温抗性、高碱性和高盐度等特殊环境适应能力,可生产出酵母菌辅酶、乳酸、醋酸、酒精、面包等产品。
酵母的研究也成为生物学、生物技术等领域的重要课题之一。
RNA(核糖核酸)是生命体中发挥重要生物学功能的分子之一,能够参与DNA复制、转录和翻译等生命过程,是研究生物学、分子生物学和基础医学等领域的重要手段之一。
因此,酵母中RNA的提取与含量测定是酵母研究的重要内容之一。
酵母中RNA的提取方法主要包括以下几个步骤:1.预处理样品:将培养的酵母细胞通过离心和去除培养基中的各种杂质,得到净化后的酵母细胞。
2.细胞破碎:通过化学方法或物理方法对细胞膜进行破坏,将细胞内的RNA暴露出来。
3.溶解RNA:加入适量的含有RNA保护剂(如二硫苏糖)的缓冲液,使RNA得到保护,不会受到核酸酶的影响,可以得到RNA溶液。
4.精制RNA:通过酚/氯仿提取及异丙醇沉淀的方法分离出纯化的RNA。
5.分析RNA:通过吸光度测定、电泳或荧光分析等方法检测RNA的纯度和含量。
酵母中RNA的含量测定可通过紫外吸收光度法进行。
该方法利用RNA在260nm处的吸收峰和RNA在280nm处的吸收峰的比值,来计算RNA的浓度。
其计算公式为:RNA浓度 = OD260值× 40 ug/ml × 稀释倍数其中,OD260值为RNA样品的吸光度值;40ug/ml为RNA样品在260nm处的吸收系数;稀释倍数为样品的稀释倍数。
除紫外吸收光度法外,也可以采用其他方法如电泳或荧光分析来测定RNA的含量。
总之,酵母中RNA的提取和含量测定可为酵母研究提供重要的实验基础和理论支持,为探索酵母生物学和基因工程等应用领域提供更为广阔的前景和新的研究突破。
酵母rna提取实验报告酵母RNA提取实验报告引言RNA提取是分子生物学研究中的重要步骤,它可以用于分析基因表达、克隆和测序等多种应用。
酵母RNA作为一种常见的模式生物体,在研究中也经常需要进行RNA提取实验。
本实验旨在通过酵母细胞提取RNA的方法,探索酵母RNA的纯化和分析技术。
材料和方法1. 酵母细胞培养液2. 离心管3. 离心机4. 细胞破碎液5. 氯仿6. 异丙醇7. 乙醇8. DEPC水9. 热盖式混合器10. 磁珠11. 离心管架12. 离心管架13. 紫外可见分光光度计实验步骤1. 收集酵母细胞并离心2. 加入细胞破碎液并用热盖式混合器破碎细胞3. 加入氯仿并离心,收集上清液4. 加入异丙醇和磁珠,混合悬浮5. 使用离心管架将磁珠沉淀,去除上清液6. 加入乙醇洗涤磁珠7. 用DEPC水溶解RNA8. 使用紫外可见分光光度计检测RNA浓度和纯度结果通过本实验方法,成功提取了酵母细胞中的RNA,并且得到了较高的纯度和浓度。
实验结果表明,所提取的RNA可用于后续的实验分析和研究。
讨论本实验采用了经典的酵母RNA提取方法,通过破碎细胞、沉淀RNA、洗涤和溶解等步骤,成功地提取了酵母细胞中的RNA。
实验结果表明,所提取的RNA具有较高的纯度和浓度,可以满足后续实验的需要。
然而,也需要注意到在实验过程中可能存在的污染和损失,需要进一步优化实验条件和技术。
结论通过本次实验,我们成功地提取了酵母细胞中的RNA,并得到了较高的纯度和浓度。
这为我们进一步研究酵母基因表达和调控提供了重要的实验基础。
同时,也为其他研究人员在酵母RNA提取方面提供了一种可靠的实验方法和参考。
总结酵母RNA提取实验是分子生物学研究中的重要步骤,通过本次实验,我们成功地提取了酵母细胞中的RNA,并得到了较高的纯度和浓度。
这为我们的研究提供了重要的实验基础和技术支持。
希望通过我们的努力,能够为相关领域的研究工作做出一定的贡献。
酵母rna的提取实验报告实验目的:本实验旨在通过提取酵母细胞中的RNA,研究酵母细胞的基因表达情况。
实验步骤:1. 准备工作:将所需试剂及设备准备好。
包括酵母细胞培养液、收集酵母细胞的离心管、琼脂糖、Rnase-free水、DTE溶液、Tris-HCl缓冲液、氯仿、异丙醇、盐溶液等。
2. 收集酵母细胞:将酵母培养液离心,将细胞沉淀至离心管中。
使用离心机将细胞沉淀。
3. 细胞破碎:向离心管中加入30μL DTE溶液,充分混合。
将离心管置于冰上,加入等体积的琼脂糖。
轻轻翻转管子,使细胞与琼脂糖充分混合。
继续在冰上离心。
4. 分层:将离心管放入冰上15分钟,离心10000g,4°C,15分钟,将上清转移至新离心管中。
5. 分液:加入等体积的Tris-HCl缓冲液,混合均匀。
加入等体积的氯仿,轻轻翻转混合。
在冰上离心15分钟,以分离上层水相和下层有机相。
6. 收集RNA:将上层水相转移至新离心管中,加入等体积的异丙醇,充分混合。
在-20°C放置30分钟,使RNA充分沉淀。
离心12000g,4°C,15分钟,将上清抽离。
7. 洗涤:加入70%乙醇洗涤一次,离心12000g,4°C,5分钟,弃上清。
重复此步骤一次。
8. 干燥:将离心管开盖,室温下干燥15分钟。
加入Rnase-free水,重悬RNA。
实验结果:完成实验后,得到1μg/μL浓度的酵母RNA。
使用NanoDrop 光度计检测RNA纯度,A260/A280比值为2.0,显示RNA被成功提取。
使用琼脂糖凝胶电泳分析酵母RNA,显示主要为2个明显的条带,符合预期。
实验结论:本实验成功地提取了酵母细胞中的RNA,并证实RNA的纯度和完整性。
这为进一步研究酵母细胞的基因表达提供了基础。
实验六——酵母RNA的提取与含量测定13生物基地 201300140059 刘洋 2015-05-10同组者:张奕一、实验目的1.掌握稀碱法提取酵母RNA的原理和方法。
2.掌握紫外分光光度计的使用。
3.了解和掌握紫外吸收法测定RNA浓度的原理。
二、实验原理酵母核酸中RNA含量较多,DNA则少于2%。
RNA可溶于碱性溶液,当碱被中和后,可加乙醇使其沉淀,由此即可得到RNA制品。
但是用碱液提取的RNA有不同的降解。
核酸及其衍生物,核苷酸、核苷、嘌呤和嘧啶有吸收紫外光的性质,其吸收高峰在260nm 左右,且一定浓度范围内其浓度与吸光度成正比(浓度为5µg/ml—45µg/ml吸光度与浓度成正比),利用此性质,可用RNA标准液绘制RNA吸光标准曲线(标准曲线的斜率为0.022-0.024左右),测定样品RNA浓度。
由于蛋白质在280nm的光吸收,对核酸测定有一定的干扰作用,最大吸收峰在280nm处,原因是蛋白质组成中常含有酪氨酸和色氨酸等芳香族氨基酸。
所以如果有蛋白质的干扰必须得先测260nm处的吸光度,再测280nm处的吸光度,通过计算消除其对核酸的影响。
三、实验器材干酵母粉电子天平量筒容量瓶100ml 磁力搅拌器试管100℃水浴锅pH试纸(pH1-14)烧杯离心机722型分光光度计锥形瓶离心管四、实验试剂0.2%氢氧化钠溶液95%乙醇无水乙醚酸性乙醇(5ml浓Hcl加入到500ml95%乙醇中混匀)RNA标准蛋白溶液(200µg/ml)1.RNA的提取(1)称取4g干酵母粉,放入200ml锥形瓶中,加入40ml0.2%的氢氧化钠溶液混匀,在沸水浴中煮沸30min中并冷却;(2)冷却后,把液体倒入离心管中,在4000r/min的条件下离心15min;(3)离心后留上清液加入95%的酸性乙醇40ml,边加边搅拌,静置5min左右,再4000r/min的条件下离心5min;(4)离心后保留沉淀,用20ml 95%乙醇分两次洗涤沉淀,每次洗后在3000r/min的条件下离心5min;(5)离心后的沉淀再用无水乙醇10ml洗涤两次,每次用3000r/min离心5min;(6)离心结束后,收集沉淀与滤纸上,称重备用。
实验六——酵母RNA的提取与含量测定
13生物基地 201300140059 刘洋 2015-05-10
同组者:张奕
一、实验目的
1.掌握稀碱法提取酵母RNA的原理和方法。
2.掌握紫外分光光度计的使用。
3.了解和掌握紫外吸收法测定RNA浓度的原理。
二、实验原理
酵母核酸中RNA含量较多,DNA则少于2%。
RNA可溶于碱性溶液,当碱被中和后,可加乙醇使其沉淀,由此即可得到RNA制品。
但是用碱液提取的RNA有不同的降解。
核酸及其衍生物,核苷酸、核苷、嘌呤和嘧啶有吸收紫外光的性质,其吸收高峰在260nm 左右,且一定浓度范围内其浓度与吸光度成正比(浓度为5µg/ml—45µg/ml吸光度与浓度成正比),利用此性质,可用RNA标准液绘制RNA吸光标准曲线(标准曲线的斜率为0.022-0.024左右),测定样品RNA浓度。
由于蛋白质在280nm的光吸收,对核酸测定有一定的干扰作用,最大吸收峰在280nm处,原因是蛋白质组成中常含有酪氨酸和色氨酸等芳香族氨基酸。
所以如果有蛋白质的干扰必须得先测260nm处的吸光度,再测280nm处的吸光度,通过计算消除其对核酸的影响。
三、实验器材
干酵母粉
电子天平
量筒
容量瓶100ml 磁力搅拌器
试管
100℃水浴锅pH试纸(pH1-14)烧杯
离心机
722型分光光度计锥形瓶
离心管
四、实验试剂
0.2%氢氧化钠溶液95%乙醇
无水乙醚酸性乙醇(5ml浓Hcl加入到500ml95%乙醇中混匀)RNA标准蛋白溶液(200µg/ml)
1.RNA的提取
(1)称取4g干酵母粉,放入200ml锥形瓶中,加入40ml0.2%的氢氧化钠溶液混匀,在沸水浴中煮沸30min中并冷却;
(2)冷却后,把液体倒入离心管中,在4000r/min的条件下离心15min;
(3)离心后留上清液加入95%的酸性乙醇40ml,边加边搅拌,静置5min左右,再4000r/min的条件下离心5min;
(4)离心后保留沉淀,用20ml 95%乙醇分两次洗涤沉淀,每次洗后在3000r/min的条件下离心5min;
(5)离心后的沉淀再用无水乙醇10ml洗涤两次,每次用3000r/min离心5min;
(6)离心结束后,收集沉淀与滤纸上,称重备用。
2.RNA样液的配制
(1)取粗RNA0.2-0.25g与烧杯中,加入5mlNaOH溶液,搅拌,溶解,调成糊状。
(2)再加入蒸馏水40ml,搅拌混匀,调PH至7.0后,放入100ml容量瓶中定容。
(3)再分3-4次分别取2ml定容后溶液于100ml容量瓶中继续定容待测,并且把容量瓶依次编号为A、B、C。
3.RNA标准曲线的绘制
(1)取洁净的试管,依次标号为1-10、A、B、C后,按照下表分别往各试管中加所需液体,并用磁力搅拌器混匀。
(2)混匀后以0号试管为参比液,在260nm下测各试管的吸光度A,并根据0-9试管的吸光值绘制出RNA标准曲线,并最终得出样品的浓度。
六、注意事项
1.离心机的使用,使用前一定要将两离心液(包括外壳)在天平上调平,对称放置在离
心机上,防止力臂不对称而损坏离心机。
2.紫外分光光度计的使用,要先预热10分钟,往比色皿中到液体只需到三分之二即可,
防止液体溢出腐蚀仪器,爱护仪器。
1.RNA样液的配制
称取RNA样品的质量:0.200g
2.RNA标准曲线的绘制
表一紫外光测RNA标准溶液配制表
表二紫外光测样品RNA浓度溶液配制表
样品A260nm = 0.470
计算得浓度C=1424.24μg/ml
质量=0.142g
质量分数=71.2%
八、讨论与结论
1.提取的RNA干燥后,最终得到是乳白色的块状固体,而纯度较高的RNA干燥后应为白色,根据其颜色可分析出其纯度较低,含有杂质较多,原因为洗涤时未洗干净。
2.在测定RNA样液时,一定要避免假重复,不是取二次定容后的样液连测三次,而是
取第一次定容后的样液取三次,分别再定容一次,分别测定,这样可以消除定容误差、移取溶液时的误差,如果分别测定的结果相差较大,可以再取第一次定容后的溶液继续定容,,取最接近的三组(由于操作误差太大,只选了两组)。
3.由回归直线可知,本次实验的数据基本在一条直线上,说明实验结果较准确。