第三单元 物质构成的奥秘课题1分子和原子
- 格式:ppt
- 大小:833.50 KB
- 文档页数:47

第三单元物质构成的奥秘课题一、分子和原子一、物质由微观粒子构成(分子、原子、离子)1、物质是由分子、原子、离子微观粒子构成的。
2、微观粒子的质量和体积都很小。
3、微观粒子总是在不断运动着;温度越高,运动越快。
4、微观粒子之间存在间隔;一般气>液>固,间隔慢慢变小。
5、同种分子的化学性质相同,不同种分子的化学性质不同。
二、分子可以分为原子1、由分子构成的物质,分子是保持其化学性质的最小粒子。
2、分子是由原子构成的。
3、原子是化学变化中的最小粒子。
4、分子与原子分子原子定义分子是保持物质化学性质最小的微粒原子是化学变化中的最小微粒。
相同点体积小、质量小;不断运动;有间隙联系分子是由原子构成的。
分子、原子都是构成物质的微粒。
区别化学变化中,分子可分,原子不可分。
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
课题二、原子的结构一、原子的构成原子是由居于原子中心的原子核与核外电子构成的。
原子核是由质子和中子构成的。
(氢除外)1、原子不显电性。
每个质子带一个单位正电荷,中子不带电,所以原子核带正电;每个电子带一个单位负电荷。
质子和核外电子数量相等、电性相反,所以整个原子不带电。
2、原子中有:质子数=核外电子数=核电荷数=原子序数二、原子核外电子的排布1、原子核外电子是分层排布的,可用原子结构示意图简单表示,右图表示的是铝原子的结构——核电荷数为13,质子数13,核外总的电子数13,核外第一电子层上有2个电子,第二电子层上有8个电子,第三电子层(最外层)上有3个电子。
原子整体不带电。
分子由原子构成,分子也不带电。
不带电的微粒有:中子、原子、分子。
2、电子电子层的规律:(1)原子的核外电子最少一层,最多七层。
离核最近的为第一层,依次类推;最远的也叫最外层。
(2)第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子。
(3)最外层电子层不超过8个,(只有一层的不超过2个)3、元素性质特别是化学性质与原子核外电子的排布,特别是最外层上的电子数有密切关系。

九年级化学第三单元《物质构成的奥秘》知识梳理课题1 分子和原子1、构成物质的微粒:、、。
⑴由分子构成的物质:气液态非金属、非金属氧化物;如:O2、N2、CO2等。
⑵由原子构成的物质:金属、固体非金属、稀有气体;如:Cu、C、S、He等。
⑶由离子构成的物质:金属氧化物、酸、碱、盐;如:MgO、HCl、Ca(OH)2等。
2、分子(原子)的基本性质:①____________________________________________;对应实例____________________________________.②____________________________________________;对应实例____________________________________.③____________________________________________;对应实例____________________________________.④____________________________________________;对应实例____________________________________.3、分子和原子的联系、区别:联系:分子由原子构成,分子可分裂成原子,原子可以结合成分子。
区别:在化学变化中,分子分解成原子,原子结合成新的分子,但原子不能再分。
由分子构成的物质,分子是保持其化学性质的最小微粒。
化学变化的实质:_____________________________________________________________原子是化学变化中的最小粒子。
在化学变化前后,___________________________________________一定不变,____________________一定改变课题2 原子的构成1、原子的结构:原子中的相等关系:质子数=______________=______________=___________________2、原子核外电子排布:最多7层。





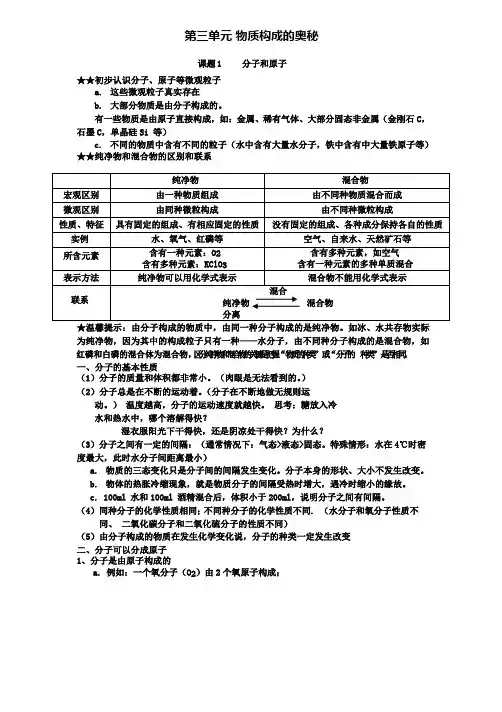
第三单元物质构成的奥秘课题1 分子和原子★★初步认识分子、原子等微观粒子a. 这些微观粒子真实存在b. 大部分物质是由分子构成的。
有一些物质是由原子直接构成,如:金属、稀有气体、大部分固态非金属(金刚石C,石墨C,单晶硅Si 等)c. 不同的物质中含有不同的粒子(水中含有大量水分子,铁中含有中大量铁原子等)★★纯净物和混合物的区别和联系★温馨提示:由分子构成的物质中,由同一种分子构成的是纯净物。
如冰、水共存物实际为纯净物,因为其中的构成粒子只有一种——水分子,由不同种分子构成的是混合物,如红磷和白磷的混合体为混合物,区分纯净物和混合物的关键是把握“物质的种类”或“分子的种类”是否相同。
一、分子的基本性质(1)分子的质量和体积都非常小。
(肉眼是无法看到的。
)(2)分子总是在不断的运动着。
(分子在不断地做无规则运动。
)温度越高,分子的运动速度就越快。
思考:糖放入冷水和热水中,哪个溶解得快?湿衣服阳光下干得快,还是阴凉处干得快?为什么?(3)分子之间有一定的间隔:(通常情况下:气态>液态>固态。
特殊情形:水在4℃时密度最大,此时水分子间距离最小)a. 物质的三态变化只是分子间的间隔发生变化。
分子本身的形状、大小不发生改变。
b. 物体的热胀冷缩现象,就是物质分子的间隔受热时增大,遇冷时缩小的缘故。
c. 100ml 水和100ml 酒精混合后,体积小于200ml,说明分子之间有间隔。
(4)同种分子的化学性质相同;不同种分子的化学性质不同. (水分子和氧分子性质不同、二氧化碳分子和二氧化硫分子的性质不同)(5)由分子构成的物质在发生化学变化说,分子的种类一定发生改变二、分子可以分成原子1、分子是由原子构成的a. 例如:一个氧分子(O2)由2 个氧原子构成;一个水分子(H2O)由1 个氧原子和2 个氢原子构成的。
b. 分子不一定比原子大。
★★用分子观点解释物理变化和化学变化。
物理变化:没有新分子生成的变化(例如:水蒸发时水分子的间隔变大,但水分子本身没有变化,故为物理变化;气体被压缩为液态,分子间距离变小,分子本身大小也没有变化等)。

第三单元物质构成的奥秘课题1 分子和原子【学习目标】1.认识物质是由分子、原子等微小粒子构成的。
2.认识分子是保持物质化学性质的最小粒子,原子是化学变化中的最小粒子。
3.运用微粒的观点解释某些常见的现象。
【重点难点】1.用微粒的观点解释日常生活中的问题。
2.化学反应的实质。
学习内容一分子【学习指导】阅读课本第48-50页的有关内容,完成下列填空。
1.物质是由分子、原子等微小的粒子构成的。
2.分子的概念:分子是保持物质化学性质的最小粒子。
分子的性质:分子的体积和质量都很小;分子之间有一定间隔,且分子之间的间隔受热增大,遇冷减小;分子不停地运动,且温度越高运动越快。
【讨论交流】1.某兴趣小组做以下实验探究分子的运动,请完成实验中的有关问题。
(1)实验一:在盛有少量蒸馏水的小烧杯中滴入2至3滴酚酞试液,再向其中滴加浓氨水。
由实验一得出的结论有:________。
(2)实验二(如图甲所示):烧杯B中的现象是________,产生这一现象的原因是:________。
(3)为使实验结论准确可靠,该兴趣小组设计了实验三(如图乙所示)作为对比实验,你认为有无必要________,理由是________。
2.用分子的观点解释物理变化和化学变化?【温馨点拨】1.(1)酚酞遇蒸馏水不变色,酚酞遇氨水变红色。
(2)溶液变成红色;氨分子不断运动到B烧杯中,溶于水形成氨水,酚酞遇氨水变红色。
(3)没有必要,此实验已经做过。
2.由分子构成的物质在发生物理变化时,只是分子之间的间隔发生了变化,分子本身不变;由分子构成的物质在发生化学变化时,分子本身发生了变化,变成了别的物质的分子。
【名师归纳】分子具有以下特征:(1)分子的质量和体积都很小;(2)分子总是不断地运动;(3)分子间有间隔。
【反馈练习】1.下列事实不能用分子的观点解释的是(A)A.柳絮纷飞B.花香四溢C.给轮胎打气时气体被压缩D.1滴水中大约有1.67×1021个水分子2.吸烟有害健康,非吸烟者往往会因吸烟者吸烟而造成被动吸烟,这是因为(A)A.分子在不断运动B.分子之间有间隔C.分子的体积很小D.分子的质量很小3.如图所示实验主要说明(B)A.分子很小B.分子间有间隔C.分子在不断运动D.分子可以分成原子学习内容二原子【学习指导】阅读课本第50页的有关内容,完成下列填空。

第三单元物质构成的奥秘课题1 分子和原子一、构成物质的微粒:分子、原子、离子1、由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质2、由原子构成的物质:金属、稀有气体、金刚石、石墨等物质3、有离子构成的物质:氯化钠NaCl硫酸锌ZnSO(显著特征:含有SO,CO^NO OH NH 4 4334PO4 Cl等原子团)4、物质构成的描述:物质由XX分子(或原子、离子)构成。
例如:铁由铁原子构成;氧气由氧分子构成。
氯化钠由氯离子和钠离子构成二、分子1、基本性质:⑴质量、体积都很小;⑵在不停地运动(与温度有关)。
温度越高,运动速率越快例:水的挥发、品红的扩散、闻到气味等;⑶分子间存在间隔。
同一物质气态时分子间隔最大,固体时分子间隔最小;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
⑷同种物质间分子的性质相同,不同物质间分子的性质不同。
分子相同物质相同,分子不同物质不同2、分子的构成:分子由原子构成。
分子构成的描述:①XX分子由XX原子和XX原子构成。
例如:水分子由氢原子和氧原子构成②一个XX分子由几个XX原子和几个XX原子构成。
例如:一个水分子由一个氧原子和二个氢原子构成3、含义:分子是保持物质化学性质的最小微粒。
例:氢分子是保持氢气化学性质的最小粒子,水分子是保持水的化学性质的最小粒子。
4、从分子和原子角度来区别下列几组概念⑴物理变化与化学变化由分子构成的物质,发生物理变化时,分子种类不变。
发生化学变化时,分子种类发生了改变。
(学会从分子和原子的角度描述物理变化和化学变化)⑵纯净物与混合物由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
⑶单质与化合物单质的分子由同种原子构成;化合物的分子由不同种原子构成。
三、原子1、含义:原子是化学变化中最小的微粒。
例:氢原子、氧原子是电解水中的最小粒子课题2 原子1、原子的构成(1)原子结构的认识质质子(带正电)丁原子核(带正电)Y原子Y I中子(不带电)「电子(带负电)(2)在原子中由于原子核带正电,带的正电荷数(即核电荷数)与核外电子带的负电荷数(数值上等于核外电子数)相等,电性相反,所以原子不显电性因此:核电荷数=质子数= 核外电子数(=原子序数)(3)原子的质量主要集中在原子核上注意:①原子中质子数不一定等于中子数②并不是所有原子的原子核中都有中子。

第三单元物质构成的奥秘课题1分子和原子第1课时物质由微观粒子构成分子的基本性质1.分子的________和________都很小。
2.分子总是在不停地________。
温度越高,分子运动速率越________。
3.分子间有________。
一般来说,气体分子间间隔﹥液体分子间间隔﹥固体分子间间隔。
温度升高,分子间间隔________。
压强增大,分子间间隔________。
4.同种分子化学性质________,不同种分子化学性质________。
第2课时分子可分为原子)一、分子与原子1.分子的概念:由分子构成的物质,分子是__________________________________。
2.原子的概念:原子是__________________________________。
3.本质区别:在化学变化中分子可分,原子不可再分。
4.联系:(1)分子由原子构成。
(2)分子和原子都是构成物质的粒子。
二、物理变化与化学变化的微观解释1.物理变化:分子种类________,如水的三态变化只是分子间间隔________。
2.化学变化:分子种类________。
课题2 原子的结构 第1课时 原子的构成原子的构成 1.原子的结构原子⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧ (带 电)中子( ) (带 电)2.在原子中,核电荷数=质子数=核外电子数。
注意:①质子数不一定等于中子数。
②原子的质量主要集中在原子核上。
第2课时原子核外电子的排布离子一、原子核外电子排布1.原子结构示意图2. 原子结构与原子化学性质之间的关系原子的分类最外层电子数得失电子趋势化学性质稀有气体原子______个(氦为______个) 不易得失稳定金属原子一般小于______个易______最外层电子不稳定非金属原子一般大于______个易______电子不稳定结论:原子的化学性质与__________________关系密切二、离子1.定义:__________原子(或原子团)称为离子。
第三单元物质构成的奥秘知识总结课题一分子和原子考点一:物质是由微观粒子构成的。
1、物质是由微观粒子构成的,微观粒子主要是分子、原子和离子。
2、微观粒子是真实存在的。
3、微观粒子的性质:①粒子的质量、体积都很小。
②粒子总是运动的(温度越高,粒子的运动速率越快)说明:利用此知识点可以解释:气味、扩散、挥发、液体蒸发、气化、溶解等常见现象。
③粒子之间存在着间隔。
(一般情况下,对于同一物质的三种状态,间隔顺序为:气体>液体>固体。
特别注意的是,同质量的水,冰的体积比水的体积大)说明:利用此知识点可以解释:热胀冷缩现象、气体可以压缩、同质量的物质、一般情况下物质在固态、液态、气态时所占据的体积不同。
以上可以总结为“两小、一动、一间隔”,它是所有粒子都具有的性质。
④同种分子的化学性质相同,不同种分子的化学性质不同。
例如:过氧化氢分子的化学性质和水分子的化学性质不同。
考点二:分子可以分为原子(分子是由原子构成的)1、由分子构成的物质有以下几种:①大部分的气体:例如:氧气()氮气()氢气()氯气()臭氧()二氧化碳()一氧化碳()氨气()氯化氢()②水()过氧化氢()③有机物:甲烷()乙醇【俗称酒精】()乙酸【俗称醋酸】()葡萄糖()④其他物质:氧化汞()足球烯()【要求写出上述物质的化学符号】从上可以看出:有些物质的分子是由同一种原子构成的,有些物质的分子是由不同的原子构成的。
2、由分子构成的物质在发生物理变化时,分子本身不变,只是分子的运动速率或者分子之间的间隔发生了变化。
例如:水蒸发仅仅是水分子运动到了空气中,同时水分子之间的间隔变大了,但是分子本身不变化。
由分子构成的物质在发生化学变化时,分子分开变成了原子,原子重新进行了新的组合产生了新的分子。
例如:过氧化氢分解时,过氧化氢分子分开变成了氢原子和氧原子,氢原子和氧原子重新组合变成了水分子和氧分子。
水分子和氧分子就不能够保持过氧化氢的化学性质了。
分子与原子说课稿尊敬的各位评委、老师:大家好!今天我说课的内容是《分子与原子》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教学方法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析《分子与原子》是人教版九年级上册化学教材第三单元《物质构成的奥秘》的课题 1。
本课题是学生对微观世界的首次了解,是从宏观世界走向微观世界的开端,为学生以后学习化学变化的实质、质量守恒定律等内容奠定了基础。
通过本课题的学习,学生能够用微观的观点解释一些常见的现象,增强对化学学习的兴趣。
二、学情分析在学习本课题之前,学生已经对物质的变化和性质有了一定的了解,也具备了一定的观察能力和思维能力。
但是,对于微观粒子的概念和性质,学生还比较陌生,需要通过形象直观的方式来帮助他们理解。
此外,九年级的学生正处于好奇心强、求知欲旺盛的阶段,他们渴望探索未知的世界,这为本课题的学习提供了良好的契机。
三、教学目标1、知识与技能目标(1)认识物质是由分子、原子等微小粒子构成的。
(2)了解分子、原子的基本性质,并能用分子、原子的观点解释一些常见的现象。
(3)学会运用分子、原子的观点来区分物理变化和化学变化。
2、过程与方法目标(1)通过实验探究和观察分析,培养学生的观察能力、思维能力和实验操作能力。
(2)通过对分子、原子概念的建立,培养学生抽象思维能力和微观想象力。
3、情感态度与价值观目标(1)激发学生对微观世界的好奇心和探究欲,培养学生的科学态度和创新精神。
(2)增强学生对物质世界的认识,使学生认识到世界的物质性,从而树立唯物主义世界观。
四、教学重难点1、教学重点(1)分子、原子的基本性质。
(2)用分子、原子的观点解释一些常见的现象。
2、教学难点(1)建立微观粒子运动的想象表象,体会它与宏观物体运动的不同点。
(2)理解化学变化的实质是分子的破裂和原子的重新组合。
五、教学方法为了实现教学目标,突破教学重难点,我将采用以下教学方法:1、实验探究法通过实验让学生亲身体验分子、原子的存在和性质,激发学生的学习兴趣,培养学生的实验操作能力和观察分析能力。