最新酶的本质和特性
- 格式:doc
- 大小:52.00 KB
- 文档页数:4

《酶》知识清单一、酶的定义和作用酶是生物体内产生的具有催化作用的蛋白质或 RNA 分子。
它们在生物体内扮演着至关重要的角色,能够加速化学反应的进行,使生命活动得以顺利进行。
酶的作用就像是一把“钥匙”,能够精准地打开化学反应的“锁”,降低反应所需的活化能,从而使反应在温和的条件下快速、高效地进行。
比如,在我们消化食物的过程中,唾液中的淀粉酶能够将淀粉分解为麦芽糖,胃中的蛋白酶能够将蛋白质分解为多肽,这些都是酶在发挥作用。
二、酶的化学本质大多数酶是蛋白质,少数酶是 RNA。
作为蛋白质的酶,其结构和功能密切相关。
蛋白质的一级结构决定了酶的氨基酸组成,而二级、三级和四级结构则共同决定了酶的活性中心和催化机制。
RNA 酶也被称为核酶,它们在一些特定的生物过程中发挥着催化作用。
三、酶的特性1、高效性酶具有极高的催化效率,比一般的无机催化剂高出成千上万倍甚至更多。
例如,过氧化氢酶催化过氧化氢分解的效率比无机催化剂铁离子高约 10^10 倍。
2、专一性一种酶通常只能催化一种或一类化学反应。
这是因为酶的活性中心具有特定的结构,只能与特定的底物结合并发生反应。
3、反应条件温和酶催化反应通常在常温、常压和接近中性的条件下进行,相比之下,许多化学反应需要高温、高压和极端的 pH 条件才能发生。
4、可调节性酶的活性可以受到多种因素的调节,包括底物浓度、产物浓度、酶的浓度、pH 值、温度、抑制剂和激活剂等。
四、酶的命名和分类1、命名酶的命名通常根据其所催化的反应或底物来进行。
例如,催化水解反应的酶通常被称为“水解酶”,催化氧化还原反应的酶被称为“氧化还原酶”。
2、分类根据国际酶学委员会的分类方法,酶可以分为六大类:(1)氧化还原酶类:参与氧化还原反应,如过氧化氢酶、脱氢酶等。
(2)转移酶类:催化基团转移反应,如转氨酶等。
(3)水解酶类:催化水解反应,如蛋白酶、淀粉酶等。
(4)裂解酶类:催化从底物分子中移去一个基团或原子形成双键的反应或其逆反应,如碳酸酐酶等。

酶的本质与特性被分解;实验组:反应物+等量的相应酶溶液检测反应物被分解。
•2.酶的专一性实验搽究此实验中的自变量可以是不同反应物,也可以是不同酶溶液,因变量是反应物是否被分解。
•(1)设计思路一:换反应物不换酶•实验组:反应物+相应酶溶液检测反应物被分解;•对照组:另一反应物+等量相同酶溶液检测反应物不被分解。
•(2)设计思路二:换酶不换反应物•实验组:反应物+相应酶溶液检测反应物被分解;•对照组:相同反应物+等量另一种酶溶液检测反应物不被分解。
•3.酶的高效性实验探究•对照组:反应物+无机催化剂检测底物分解速率;•实验组:反应物+等量酶溶液检测底物分解速率。
•实验中自变量是无机催化剂和酶,因变量是底物分解速率。
•4.酶作用的适宜条件的探究•(1)最适温度的探究实验原理•①淀粉+淀粉酶——麦芽糖;麦芽糖+斐林试剂—一产生砖红色沉淀;淀粉+碘——蓝色。
•②温度影响淀粉酶活性,从而影响淀粉的分解,滴加碘液后,根据蓝色深浅来判断淀粉分解状况,进而推断出酶活性变化。
•(2)最适pH的探究实验原理•①2H202+过氧化氢酶——2H2O+O2•②pH影响酶的活性,从而影响氧气的生成速度,可用点燃但无火焰的卫生香燃烧的情况来检验氧气生成速度的快慢。
•(3)实验探究思路•①最适温度的探究思路••②最适pH的探究思路•2、易错点拨:(1)在酶的最适pH探究实验中,操作时必须先将酶置于不同环境条件下(加清水、加氢氧化钠、加盐酸),然后再加入反应物。
不能把酶加入反应物在酶的作用下先发生水解。
(2)在酶的最适温度探究实验中,酶溶液和反应物混合之前,需要把两者先分别放在各自所需温度下保温一段时间。
若选择淀粉和淀粉酶来探究酶的最适温度,检测的试剂宜先用碘液,不应该选用斐林试剂。
因选用斐林试剂需热水浴加热,而该实验中需严格控制温度。
•知识拓展:••1、利用酶的专一性也可探究某种酶的化学本质是蛋白质还是RNA:将某种酶用蛋白酶或核糖核酸酶处理,根据处理后的酶液是否还有催化作用予以判断。

酶的作用和本质酶是一类生物大分子催化剂,能够加速化学反应过程、提高反应速率,降低反应活化能。
酶具有高度的特异性,在反应中只作用于特定的底物,并可在相对温和的条件下使底物发生化学变化。
酶的本质是蛋白质,由氨基酸构成,通过二级、三级、四级结构的折叠形成其特定的三维构象。
酶的催化作用与其形成的空间结构密切相关,酶分子中的活性位点与底物结合,形成酶底物复合物,借助于专有的反应机制,使底物发生化学转化反应,最终形成产物。
酶催化反应的本质是降低反应的活化能,因此酶可在相对低的温度和压力等温和条件下催化反应,降低反应的能量消耗,并提高反应中的选择性和效率。
酶在生物体内广泛存在于细胞质、线粒体、叶绿体、内质网、高尔基体等细胞器中,参与细胞代谢、物质合成、信号转导等生命活动,是生物学中一个重要的研究对象。
酶的催化机制与底物结合、酶结构和催化反应的化学性质密切相关。
一般来说,酶催化反应可分为两个步骤:底物与酶结合、催化反应。
底物与酶结合是由于酶分子具有特定的活性中心,可与底物的分子结构相互配合,并形成酶底物复合物。
催化反应的过程中,酶分子对底物分子进行定向作用,调节反应的速度和方向,使其转化为产物。
酶在反应过程中与底物分子的相互作用是基于键的形成和断裂进行的,这些键的转变可能涉及电子的转移、共价键的形成和断裂、氢键的形成等过程。
酶的催化过程通常分为两类:羟化作用和氧化或脱氢作用。
羟化作用是指酶在催化过程中会将水分子发生加成反应,将底物的双键转化为单键,如丙酮酸羟化酶催化丙酮酸转化为乳酸。
氧化或脱氢作用是指酶在催化过程中会将底物中的氢离子转移至辅助化合物,如辅酶NAD+,将底物氧化为相应的羧酸或醛,如葡萄糖脱氢酶催化葡萄糖转化为葡萄糖酸。
总之,酶是一类催化性质强、底物特异性高的生物大分子,参与生物体内众多代谢和信号传递过程。
酶的本质是蛋白质,通过特定的三维结构和活性中心与底物分子结合,发挥催化作用,提高反应速率、选择性和效率。



高中生物酶的知识点酶指具有生物催化功能的高分子物质,在酶的催化反应体系中,反应物分子被称为底物,底物通过酶的催化转化为另一种分子。
几接下来店铺为你整理了高中生物酶的知识点,一起来看看吧。
高中生物酶的知识点一、酶的作用和本质1、概念:酶通常是指由活细胞产生的、具有催化活性的一类特殊的蛋白质,又称为生物催化剂。
(少数核酸也具有生物催化作用,它们被称为“核酶”)。
2、控制变量:①人为改变的变量称作自变量。
②随自变量变化而变化的变量叫因变量3、同无机催化剂相比,酶降低活化能的作用更显著,因而催化效率更高。
4、大多数酶是蛋白质,少数是RNA。
二、酶的特性酶的特性主要四点:1、酶具有高效率的催化能力;其效率是一般无机催化剂的10的7次幂~~10的13次幂。
2、酶具有专一性;(每一种酶只能催化一种或一类化学反应。
)3、酶在生物体内参与每一次反应后,它本身的性质和数量都不会发生改变(与催化剂相似);4、酶的作用条件较温和。
(1)酶所催化的化学反应一般是在比较温和的条件下进行的。
(2)在最适宜的温度和PH条件下,酶的活性最高。
温度和PH偏高或偏低,酶活性都会明显降低。
一般来说,动物体内的酶最适温度在35~40℃之间;植物体内的酶最适温度在40~50℃之间;动物体内的酶最适PH大多在6.5~8.0之间,但也有例外,如胃蛋白酶的最适PH为1.5;植物体内的酶最适PH大多在4.5~6.5之间。
(3)过酸、过碱或温度过高,会使酶的空间结构遭到破坏,使酶永久失活。
0℃左右时,酶的活性很低,但酶的空间结构稳定,在适宜的温度下酶的活性可以升高。
酶对化学反应的催化效率称为酶活性。
5、活性可调节性。
6、有些酶的催化性与辅因子有关。
7、易变性:大多数酶都是蛋白质,因而会被高温、强酸、强碱等破坏。
酶的特性酶的特性主要四点:1、酶具有高效率的催化能力;其效率是一般无机催化剂的10的7次幂~~10的13次幂。
2、酶具有专一性;(每一种酶只能催化一种或一类化学反应。


《酶》知识清单一、酶的定义酶是由活细胞产生的、对其底物具有高度特异性和高度催化效能的蛋白质或 RNA。
酶的化学本质是蛋白质或 RNA,这一特点决定了酶具有不同于一般催化剂的独特性质。
二、酶的作用酶在生物体内发挥着至关重要的作用,几乎参与了所有的生命活动过程。
1、催化代谢反应酶能够加速生物体内的化学反应,使得原本需要在苛刻条件下才能进行的反应在温和的生理条件下迅速完成。
例如,消化酶能够帮助我们分解食物中的大分子物质,使其变成能够被吸收的小分子。
2、调节生理功能通过调节酶的活性和含量,可以控制生物体内的各种生理过程。
比如,某些激素可以通过激活或抑制特定的酶来调节细胞的代谢和功能。
3、参与物质运输一些酶参与物质的跨膜运输,帮助细胞摄取或排出所需的物质。
4、维持细胞结构和功能某些酶参与细胞结构的构建和维护,保证细胞的正常形态和功能。
三、酶的特性1、高效性酶的催化效率极高,通常比非催化反应高 10⁸ 10²⁰倍。
这使得生物体内的各种代谢反应能够快速进行,以适应生命活动的需要。
2、特异性酶对底物具有严格的选择性,一种酶通常只能催化一种或一类特定的化学反应。
这种特异性分为绝对特异性和相对特异性。
绝对特异性是指酶只作用于一种底物,产生一定的反应;相对特异性则是指酶作用于一类底物或一种化学键。
3、可调节性细胞可以根据内外环境的变化,通过多种方式调节酶的活性和含量,从而改变代谢的速度和方向。
4、不稳定性大多数酶是蛋白质,其活性容易受到多种因素的影响,如温度、pH 值、抑制剂等。
在极端条件下,酶可能会变性失活。
四、酶的分类根据酶催化反应的类型,酶可以分为六大类:1、氧化还原酶类参与氧化还原反应,如细胞呼吸中的脱氢酶。
2、转移酶类催化基团转移反应,例如甲基转移酶、氨基转移酶等。
3、水解酶类催化水解反应,如蛋白酶、淀粉酶等。
4、裂解酶类催化从底物分子中移去一个基团或原子形成双键的反应或其逆反应。
5、异构酶类催化同分异构体之间的相互转化。
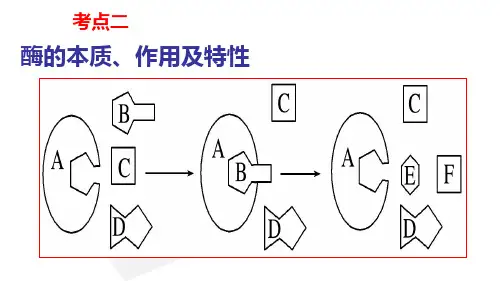
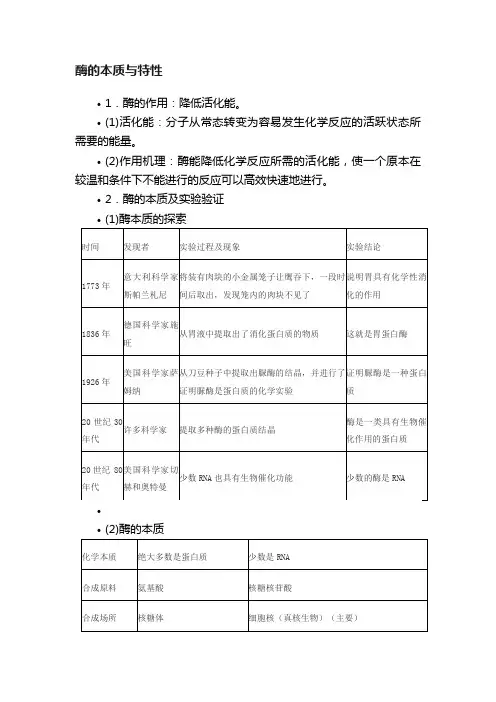
酶的本质和特性考情分析知识梳理一、酶的发现历程1.关于酶本质的探索(1)1857年,法国微生物学家巴斯德认为,没有活细胞的参与,糖类不可能变成酒精.(2)德国化学家李比希认为,引起发酵的物质是酵母细胞中的某些物质,但这些物质只有在酵母细胞死亡并裂解后才能发挥作用.(3)德国化学家毕希纳从酵母活细胞中提取出引起发酵的物质,称为酿酶.(4)1926年,美国科学家萨姆纳从刀豆种子中提取出了脲酶,并证明脲酶是蛋白质.(5)20世纪80年代,美国科学家切赫和奥特曼发现少数RNA也具有生物催化功能.二、酶的概念和本质1. 酶的概念酶是活细胞产生的具有催化作用的有机物,其中绝大多数是蛋白质.(1)酶概念的三要素:酶的来源——是由活细胞产生的;酶的化学本质——绝大多数是蛋白质,少数是RNA;酶的生理功能——具有催化作用.(2)酶的产生与激素产生的关系活细胞一般都能产生酶,但是不都能产生激素.所以,能产生激素的细胞一定能产生酶,但能产生酶的细胞不一定能产生激素.2.酶的本质3.酶本质的实验验证(1)酶是蛋白质的实验验证实验组:待测酶液+双缩脲试剂一一→是否出现紫色对照组:已知蛋白液+双缩脲试剂一一→出现紫色反应通过对照,实验组若出现紫色,证明待测酶是蛋白质;否则,不是蛋白质.(2)酶是RNA的实验验证实验组:待测酶液+吡罗红染液一是否呈现红色对照组:已知RNA溶液+吡罗红染液一呈现红色通过对照,若实验组呈现红色,则证明待测酶是RNA;否则,不是RNA.三、酶的特性1.高效性(1)含义酶的催化效率大约是无机催化剂的107-1013倍,说明酶的催化作用具有高效性.酶的高效性保证了生物体内的生化反应能快速、顺利地进行.(2)图解①加入酶和加无机催化剂相比较,说明酶催化的高效性.②加入酶和未加酶相比较,说明酶具有催化性.(3)意义保证细胞代谢顺利进行.2.专一性(1)含义每一种酶只能催化一种或一类化学反应.(2)图解①A表示酶,B表示被催化的反应物②反应前后酶的结构和性质不变③酶和被催化的反应物分子都是特定的结构(3)曲线①在反应物A中加入酶A,反应速率较未加酶时明显加快,说明酶A催化反应物A的反应.②在反应物A中加入酶B,反应速率与未加酶时相同,说明酶B不催化反应物A的反应.3.作用条件较温和(1)含义酶作用需要较温和的条件.绝大多数酶是蛋白质,过酸、过碱和高温都能使蛋白质分子的空间结构遭到破坏,从而引起酶活性的改变(2)图解①在一定温度范围内,随温度的升高,酶的催化作用增强,超过这一范围酶的催化作用将减弱.②在最适pH时,酶的催化作用最强,高于或低于最适pH,酶的催化作用都减弱.③过酸、过碱和高温都会使酶失活,而低温只是抑制酶的活性,酶分子结构未被破坏,温度升高可恢复活性.④反应液pH的变化不影响酶作用的最适温度.【易错提醒】(1)不要误认为具有分泌功能的细胞才能产生酶;(2)不要误认为酶只在细胞内起作用;(3)低温只会影响酶的活性,酶不会变性失活;(4)酶的高效性一般是通过酶与无机催化剂对照来说的;(5)酶的高效性验证实验中,所用的生物材料必须是新鲜的.趣味生物神奇的酶可将A型血和B型血转化成O型血生物通报道,加拿大英属哥伦比亚大学的研究人员在人类肠道中发现了一种神奇的酶,能够将A型或B型血转化成O型血,并且效率比之前报道的酶高了30倍.他们在本周召开的美国化学学会的年会上展示了这一成果,有望在紧急情况下将血液调整成通用的O型,让更多患者受益.这项研究的负责人、英属哥伦比亚大学的生物化学教授Stephen Withers表示:“我们对那些能够从红细胞中去除A或B抗原的酶特别感兴趣.如果你可以去除那些单糖的抗原,那么你就可以将A型或B型血转化为O型血.”这种神奇的酶是从人体肠道微生物组中发现的.肠道壁的内侧含有糖基化蛋白,称为粘蛋白,它们为细菌提供附着点.这些糖在结构上类似于在A型和B型血液中发现的那些抗原,而特定的细菌家族在切割这些抗原上的效率比之前的酶高了30倍.典例精炼【例1】下列关于酶本质的探索历程,说法不正确的是()A. 巴斯德认为糖类变成酒精是一个纯化学过程,与生命活动无关B. 毕希纳将酵母细胞中引起发酵的物质称为酿酶C. 萨姆纳从刀豆种子中提取出脲酶并证明其是蛋白质D. 切赫和奥特曼发现了具有生物催化功能的RNA【答案】A【解析】A、巴斯德之前,人们认为发酵是纯化学反应,与生命活动无关,而巴斯德认为发酵与活细胞有关,起发酵作用的是整个酵母细胞,A错误;B、毕希纳将酵母细胞中引起发酵的物质称为酿酶,B正确;C、萨姆纳从刀豆种子中提取出脲酶并证明其是蛋白质,C正确;D、切赫和奥特曼发现少数RNA具有生物催化功能,D正确.【总结】本题考察酶的发现历程,对于此类试题,需要考生注意教材中的探索实验及其结论,能结合所学的知识准确判断各选项,属于考纲识记层次的考察.【练1-1】1、下列关于酶研究的叙述,错误的是()A. 在巴斯德之前,人们认为发酵是纯化学反应,与生命活动无关B. 巴斯德与李比希观点的主要不同在于发酵是整个细胞或细胞中的某些物质起作用C. 酵母细胞中的酶在细胞存活、破碎后均能发挥催化作用D. 萨姆纳证明酶的本质是蛋白质,少数RNA也有催化作用【答案】D【解析】在巴斯德之前,人们认为发酵是纯化学反应,与生命活动无关,A正确;巴斯德提出:酿酒中的发酵是由于酵母细胞的存在,而李比希却坚持地认为:引起发酵的是酵母细胞中的某些物质,可见,二者观点的主要不同在于发酵是整个细胞或细胞中的某些物质起作用,B正确;酵母细胞中的酶,在细胞存活、破碎后均能发挥催化作用,C正确;萨姆纳证明酶的本质是蛋白质,奥特曼发现少数RNA也有催化作用,D错误.【练1-2】科学家()设计了一个非常巧妙的实验,最先证明胃具有化学性消化的作用.A.巴斯德B.毕希纳C.萨姆纳D.斯帕兰札尼【答案】D【解析】A、巴斯德指出发酵与活细胞有关;起发酵作用的是整个酵母细胞,A错误;B、毕希纳指出酵母细胞中的某些物质能够在酵母细胞破碎后继续起催化作用,就像在活酵母细胞中一样,B错误;C、萨姆纳从刀豆种子提纯出来脲酶,并证明是一种蛋白质,C错误;D、1773年,意大利科学家斯帕兰扎尼将肉块放入金属笼内让鹰吞下,一段时间后,发现笼内肉块消失了,本实验的设计巧妙地避开了胃的物理性消化,因为金属笼可以避免胃的蠕动对笼内食物的影响,证明了胃具有化学性消化的作用,D正确.故选:D.【练1-3】美国科学家萨姆纳历经九年从刀豆种子中提取出脲酶结晶,对于脲酶的叙述不正确的是()A.脲酶可以将尿素分解成为氨和二氧化碳B.脲酶常温下可以与双缩脲试剂反应,形成紫色物质C.脲酶分子中的组成元素一定包括C、H、O、ND.与脲酶合成有关的细胞器只有核糖体、内质网和高尔基体【答案】D【解析】脲酶是一种细胞内的酶,属于胞内蛋白质,故不需要内质网和高尔基体的加工和运输,故D错误.【练1-4】下列有关酶的发现和特性说法不正确的是()A.斯帕兰扎尼在研究鹰的消化作用的实验中,证明了酶具有消化作用B.温度过低或过高,对酶活性的影响存在差异C.绝大多数酶都是蛋白质D.酶具有极强的催化功能,其原因是降低活化能【答案】A【解析】斯帕兰扎尼在研究鹰的消化作用的实验中,证明了该物质具有消化作用,不清楚该物质是酶,故错误.【练1-5】二十世纪80年代,美国生物学家奥特曼和切赫研究和发现了RNA的催化功能,并由此获得1989年度的诺贝尔化学奖.以下有关叙述中正确的是()A.酶的化学本质不一定都是蛋白质B.某些RNA虽具有催化功能但不能叫做酶C.RNA催化功能的发现说明酶不具有专一性D.所有酶都是在细胞中的核糖体上合成的【答案】A【解析】A、酶是由活细胞产生的,具有生物催化功能的有机物,大多数酶是蛋白质,但是也有少数酶的本质是RNA,如美国生物学家奥特曼和切赫研究和发现了RNA 的催化功能,A正确;B、除了一些蛋白质类的酶以为,某些RNA也是酶,也有催化功能,B错误;C、RNA和蛋白质类的酶都具有专一性,RNA的催化功能的发现,说明了酶的本质不仅仅是蛋白质,C错误;D、蛋白质类的酶是在核糖体合成的,RNA类的酶是在细胞核(或拟核)转录形成的,D错误.故选:A.【练1-6】下列关于酶本质的研究,按研究时间的先后顺序,排列正确的是 ( )①证明了脲酶是一种蛋白质②酒精发酵需要活细胞的参与③发现少数RNA也具有生物催化功能④人们认识到酿酒就是让糖类通过发酵变成酒精和二氧化碳⑤用不含酵母菌的酵母提取液进行发酵获得成功,证明生物体内的催化反应也可在体外进行A.④②⑤①③B.③④⑤②①C.①⑤④②③D.③④①②⑤【答案】A【解析】19世纪人们认为酿酒是让糖类发酵变成酒精和二氧化碳.1857年,巴斯德认为发酵需活细胞参与.毕希纳从细胞中获得了含有酶的提取液,证明生物体内的催化反应也可在体外进行,萨姆纳获得脲酶,证明是一种蛋白质,切赫和奥特曼发现少数RNA也具有生物催化作用.【例2】下列有关酶的叙述正确的有()①产生酶的细胞都有分泌功能②部分从食物中获得,部分在体内转化③酶的基本单位是氨基酸或核糖核苷酸④酶是生物催化剂⑤生长激素与呼吸酶可来自于同一个细胞⑥能降低化学反应的活化能A.3个B.4个C.5个D.6个【答案】B【解析】所有的细胞都可以产生酶,只有部分细胞具有分泌功能;所有的酶都需要自身合成,不能从食物中获得;酶是生物催化剂,其化学本质是蛋白质或RNA,基本组成单位是氨基酸或核糖核苷酸;产生生长激素的细胞是垂体细胞,垂体细胞也能产生呼吸酶;酶通过降低化学反应的活化能发挥催化作用.正确的叙述为③④⑤⑥.【总结】此题考察酶的概念以及特性,酶促反应原理等知识点,意在考察学生对基础知识的理解运用,较为基础,难度不大.【练2-1】核酶(ribozyme)是具有催化功能的RNA分子,在特异地结合并切断特定的mRNA 后.核酶可从杂交链上解脱下来,重新结合和切割其他的mRNA分子,下列关于核酶的叙述,正确的是()A.向核酶中滴加双缩脲试剂,水浴加热可发生紫色反应B.与不加核酶组相比,加核酶组mRNA降解较快,由此可反映核酶的高效性C.核酸具有热稳定性,故核酶的活性不受温度的影响D.核酶与催化底物特异性结合时,有氢键形成,也有磷酸二酯键的断裂【答案】D【解析】根据题意可知,核酶是具有催化功能的RNA分子,因此不会和双缩脲试剂反应产生紫色反应,A错误;与不加核酶组相比,加核酶组mRNA降解较快,由此可反映核酶的催化性,B 错误;核酸具有热稳定性,但是在高温条件下结构也会发生改变,因此核酶的活性也会受温度的影响,C错误;核酶与催化底物特异性结合时,核酶和mRNA之间有氢键形成,而切割mRNA 分子也有磷酸二酯键的断裂,D正确.【练2-2】多酶片中含有的蛋白酶、淀粉酶、脂肪酶具有辅助消化的作用.关于酶的叙述,正确的是()A.多酶片中的酶都是蛋白质B.一个酶分子只起一次作用C.酶提供反应开始时所必需的活化能D.食物消化过程需要酶的作用,而细胞内的化学反应不需酶的作用【答案】A【解析】本题考查对酶基础知识的理解.另外,生物体内各种化学反应均需酶的催化,不管是食物消化,还是细胞内的化学反应,故D项错误.【练2-3】下列关于酶的叙述,正确的是()A.酶只有在生物体内才能起催化作用B.酶都有消化作用C.调节新陈代谢的物质不一定是酶D.酶都是蛋白质【答案】C【解析】酶虽然是由活细胞产生的,但它的催化作用不一定非在生物体内,只要条件适宜,体内体外都可起催化作用,例如探究活动“比较过氧化氢酶和Fe3+的催化效率”中过氧化氢酶就是在试管中发挥作用的.故A项不正确.酶的催化作用表现在多方面,有的酶促进物质合成,有的酶促进物质分解,只有消化酶才能促进消化,故B项也不正确.调节新陈代谢的物质有激素、维生素、无机盐等.酶对代谢过程的化学反应起催化作用.故C项正确.【练2-4】多酶片中含有蛋白酶、淀粉酶和脂肪酶,具有辅助消化的作用.其片剂是糖衣片,这样制作的目的是()A.补充体内糖类物质的供给B.防止胃液的消化C.经唾液消化后即可迅速起作用D.使其中各种酶缓慢的起作用【答案】B【解析】多酶片的外面包有糖衣片,目的是防止胃液的消化,因为吸收营养物质和水分的主要部位是小肠,所以要组织药物的过早消化,胃液中不含有淀粉酶,所以【练2-5】甲、乙两种酶用同一种蛋白酶处理,酶活性与处理时间的关系如下图所示.下列分析错误..的是()A. 甲酶能够抗该种蛋白酶降解B. 甲酶不可能是具有催化功能的RNAC. 乙酶的化学本质为蛋白质D. 乙酶活性的改变是因为其空间结构的改变【答案】B【解析】由图可知甲酶活性不受蛋白酶的影响,说明甲酶应是具有催化作用的RNA,A正确,B 错误.乙酶在蛋白酶的作用下活性降低很快,说明其化学本质为蛋白质,C正确.活性降低是因为其分子结构受到破坏而发生改变,D正确.【练2-6】下列关于酶的表述,全面而准确的是()A. 酶不能脱离生物体起作用B. 酶是蛋白质C. 酶与无机催化剂没有本质区别D. 酶是活细胞产生的有催化剂作用的有机物【答案】D【解析】酶既能在细胞内发挥作用,也能在细胞外发挥作用,A错误;绝大多数酶是蛋白质,极少数酶是RNA,B错误;与无机催化剂相比,酶具有高效性,C错误;酶是活细胞产生的具有催化作用的有机物,D正确.【练2-7】下列有关酶的叙述,正确的是()①酶是微量高效的②有的从食物中获得,有的在体内转化而来③凡是有核的活细胞都能产生酶④酶的基本单位都是氨基酸⑤有的有活性的酶形成过程中需要核糖体、内质网和高尔基体及线粒体等结构参与⑥酶在代谢中有多种功能⑦在新陈代谢和生殖发育中起调控作用⑧酶作用的实质是降低反应的活化能⑨酶既可以作为催化剂,也可以作为另一个反应的底物⑩同一种酶可以存在于分化程度不同的活细胞中A. ①⑤⑦⑧⑨⑩B. ①③⑤⑧⑨⑩C. ①②④⑤⑦⑨D. ②③⑤⑥⑧⑩【答案】B【解析】酶是微量高效的,①正确;酶是由活细胞产生的具有催化活性的有机物,②错误;凡是活细胞都能产生酶,③正确;绝大多数酶是蛋白质,基本单位是氨基酸,少数酶是RNA,基本单位是核糖核酸,④错误;分泌到细胞外有活性的酶形成过程中需要核糖体、内质网和高尔基体及线粒体等结构参与,⑤正确;酶在代谢中只起到催化功能,⑥错误;在新陈代谢和生殖发育中只起到催化作用,⑦错误;酶作用的实质是降低反应的活化能,⑧正确;酶既可以作为催化剂,也可以作为另一个反应的底物,⑨正确;同一种酶可以存在于分化程度不同的活细胞中,如呼吸酶,⑩正确.根据以上分析可知,正确的是①③⑤⑧⑨⑩,故选B.【练2-8】科学家证实:RNaseP酶由蛋白质和RNA组成,将这种酶中的蛋白质和RNA分开,在适宜条件下,RNA仍然具有与这种酶相同的催化活性,而蛋白质不具有.这一结果表明()A.酶都是由蛋白质和RNA组成的B.RNA具有催化作用C.酶的基本组成单位是脱氧核糖核苷酸D.绝大多数酶是蛋白质,少数是RNA【答案】B【解析】根据题意,RNaseP酶由蛋白质和RNA组成,但这并不能说明酶都是由蛋白质和RNA 组成的;题干强调“RNA仍然具有与这种酶相同的催化活性”,说明RNA具有催化作用;RNaseP酶的基本组成单位是核糖核苷酸和氨基酸;“绝大多数酶是蛋白质,少数是RNA”这一说法正确,但本题的实验结果并不能说明这一结论.【练2-9】猪笼草是一种食虫植物,为了验证猪笼草分泌液中有蛋白酶,某学生设计了两组实验,如下图所示.经35℃水浴保温一段时间后,③④中加入适量双缩脲试剂,①②不加任何试剂,下列组合能达到目的的是()A.①和②B.②和③C.①和④D.③和④【答案】A【解析】①②不加任何试剂,能通过蛋白块大小反映是否被消化,分泌液是否有蛋白酶.③④中加入适量双缩脲试剂,分泌液无论有无蛋白酶,都会有紫色反应.【例3】下列关于酶的叙述,正确的是()A. 鸡肝或马铃薯块茎是否制成匀浆对酶促反应速率没有影响B. 酶只能催化一种或几种相似底物的反应C. H202溶液中加入H202酶后出现大量气泡,说明酶具有高效性D. 只比较唾液淀粉酶对蔗糖和淀粉的作用不能证明酶具有专一性【答案】B【解析】鸡肝或马铃薯块茎制成匀浆后,与反应物的接触面积更大,将加快反应速率,A错误.酶的作用具有专一性,一种酶只能催化一种或几种相似底物的反应,这与酶分子自身形状有关,B正确.证明酶具有高效性,必须将酶与无机催化剂比较才能得出,C错误.唾液淀粉酶不能分解蔗糖,而能分解淀粉,此实验能证明酶具有专一性,D错误.【总结】本题考察酶的本质和特性的相关知识,解答的关键是掌握酶的特性及催化剂的特点.【练3-1】下列关于酶的叙述,正确的是()A. 同一种酶可以存在于分化程度不同的活细胞中B. 酶通过提供反应所需的活化能来提高化学反应速率C. 酶是由内分泌腺细胞合成的,具有高效性和专一性D. 低温下酶的活性较低是因为酶的空间结构被破坏【答案】A【解析】同一种酶可以存在于分化程度不同的活细胞中,如与呼吸作用有关的酶,A正确;酶的作用机理是降低化学反应的活化能,B错误;所有活细胞都可以产生酶,酶具有专一性和高效性,C错误;酶的催化活性受温度的影响,低温可以降低酶的活性,但是不会破坏酶的空间结构,D错误.【练3-2】下列关于酶及其特性的叙述,错误的是()A. 都是蛋白质B. 具有高效性C. 具有专一性D. 作用条件温和【答案】A【解析】酶大多数是蛋白质,少数是RNA,A错误.酶与无机催化剂相比具有高效性,B正确.酶具有专一性,只能催化一种或一类化合物,C正确.酶要发挥作用条件温和,D正确.【练3-3】人的血液中一个碳酸酐酶分子每分钟可催化分解19000万个碳酸分子.这说明酶具有( )A.多样性B.专一性C.可控性D.高效性【答案】D【解析】一个碳酸酐酶分子每分钟可催化分解19000万个碳酸分子,体现了酶的高效性.【练3-4】一份淀粉酶能使一百万份淀粉水解成麦芽糖,而对麦芽糖的水解却不起作用.这种现象说明酶具有()A. 高效性和多样性B. 高效性和专_性C. 专一性和多样性D. 稳定性和高效性【答案】B【解析】淀粉酶能使淀粉在很短的时间内水解成麦芽糖说明酶的效果明显,其催化效率远远高于无机催化剂,体现出酶的高效性;淀粉酶只能催化淀粉的水解而对麦芽糖的水解不起作用说明淀粉具有专一性,故选B.【练3-5】下图表示的是某类酶作用的模型.有关叙述正确的是()A. 酶只能在活细胞中发挥催化作用B. 图中模型可用来解释酶的催化具有高效性C. 图中A表示酶,反应前后化学性质不发生变化D. 如果C、D表示两个单糖分子,则B表示麦芽糖分子【答案】C【解析】是由活细胞产生的具有催化作用的有机物,既可以在细胞内也能在细胞外发挥作用,A错误;图中模型可用来解释酶的催化具有专一性,B错误;图中A在化学反应前后化学性质不变,表示酶,C正确;麦芽糖是由两分子相同的葡萄糖组成的,D错误.【练3-6】图表示过氧化氢在不同条件下被分解的速率,图中曲线表明酶的()A. 专一性B. 高效性C. 催化需要适宜的温度D. 催化需要适宜的pH【答案】B【解析】酶的特性有高效性和专一性.这个曲线图中表示出的是酶,无机催化剂,未加酶的生成物量的对照,可以看出有酶参加的化学反应快了很多,体现的是酶的高效性特点.在生物化学反应中,当底物与酶的活性位点形成互补结构时,可催化底物发生变化,如图甲Ⅰ所示.酶的抑制剂是与酶结合并降低酶活性的分子.竞争性抑制剂与底物竞争酶的活性位点,非竞争性抑制剂和酶活性位点以外的其他位点结合,从而抑制酶的活性,如图甲Ⅱ、Ⅲ所示.图乙示意发生竞争性抑制和非竞争性抑制时,底物浓度与起始反应速率的变化曲线图.请据图回答下列问题:(1)当底物与酶活性位点具有互补的结构时,酶才能与底物结合,这说明酶的催化作用具有.(2)青霉素的化学结构与细菌合成细胞壁的底物相似,故能抑制细胞合成细胞壁相关的酶活性,其原因是 __________________.(3)据图乙分析,随着底物浓度升高,抑制效力变得越来越小的是抑制剂,原因是.(4)唾液淀粉酶在最适温度条件下的底物浓度与反应速率的变化如图丙.若将温度提高5℃,请在图丙中绘出相应变化曲线.【答案】(1)专一性(2)青霉素能与这些酶的活性位点结合(或酶活性位点被封闭),使细菌合成细胞壁的底物与酶活性位点结合机会下降(3)竞争性底物浓度越高,底物与酶活性位点结合机会越大,竞争性抑制剂与酶活性位点结合机会越小(4)见下图【解析】据图甲可知,酶的催化作用的专一性体现了底物与酶活性位点具有互补的结构,这种互补的结构还表现在青霉素或细菌合成细胞壁的底物与酶活性位点的结合上.图乙表明,底物浓度越大,竞争性抑制的效力越来越小.图丙曲线是在最适温度下的底物浓度与反应速率的关系,温度提高5℃时,相同底物浓度的条件下反应速率均会降低.出门测试课后作业。
酶
一、酶的本质:酶是由活细胞产生的具有催化活性和高度选择性的特殊蛋白质。
按其组成的不同,将酶分成单纯蛋白质和结合蛋白质两大类。
例如,大多数水解酶属单纯由蛋白质组成的酶; 黄素单核苷酸酶则属由酶蛋白和辅助因子组成的结合蛋白酶。
结合蛋白质中的酶蛋白为蛋白质部分,辅助因子为非蛋白质部分,两者结合成全酶,只有全酶才有催化活性
二、酶的形态结构
所有的酶都含有C、H、O、N四种元素。
按照酶的化学组成可将酶分为单纯酶和复合酶两类。
单纯酶分子中只有氨基酸残基组成的肽链。
结合酶分子中则除了多肽链组成的蛋白质,还有非蛋白成分,如金属离子、铁卟啉或含B 族维生素的小分子有机物。
结合酶的蛋白质部分称为酶蛋白,非蛋白质部分统称为辅助因子(cofactor),两者一起组成全酶;只有全酶才有催化活性,如果两者分开则酶活力消失。
非蛋白质部分如铁卟啉或含B族维生素的化合物若与酶蛋白以共价键相连的称为辅基(prosthetic group),用透析或超滤等方法不能使它们与酶蛋白分开;反之两者以非共价键相连的称为辅酶(coenzyme),可用上述方法把两者分开。
辅助因子有两大类,一类是金属离子,且常为辅基,起传递电子的作用;另一类是小分子有机化合物,主要起传递氢原子、电子或某些化学基团的作用。
结合酶中的金属离子有多方面功能,它们可能是酶活性中心的组成成分;有的可能在稳定酶分子的构象上起作用;有的可能作为桥梁使酶与底物相连接。
辅酶与辅基在催化反应中作为氢(H+和e)或某些化学基团的载体,起传递氢或化学基团的作用。
体内酶的种类很多,但酶的辅助因子种类并不多,常见到几种酶均用某种相同的金属离子作为辅助因子的例子,同样的情况亦见于辅酶与辅基,如3-磷酸甘油醛脱氢酶和乳酸脱氢酶均以NAD+作为辅酶。
酶催化反应的特异性决定于酶蛋白部分,而辅酶与辅基的作用是参与具体的反应过程中氢(H+和e)及一些特殊化学基团的运载。
酶属生物大分子,分子质量至少在1万以上,大的可达百万。
酶的催化作用有赖于酶分子的一级结构及空间结构的完整。
若酶分子变性或亚基解聚均可导致酶活性丧失。
一个值得注意的问题是酶所催化的反应物即底物(substrate),却大多为小分物质它们的分子质量比酶要小几个数量级。
酶的活性中心(active center)只是酶分子中的很小部分,酶蛋白的大部分氨基酸残基并不与底物接触。
组成酶活性中心的氨基酸残基的侧链存在不同的功能基团,如-NH2。
-COOH、-SH、-OH和咪唑基等,它们来自酶分子多肽链的不同部位。
有的基团在与底物结合时起结合基团(binding group)的作用,有的在催化反应中起催化基团(catalytic group)的作用。
但有的基团既在结合中起作用,又在催化中起作用,所以常将活性部位的功能基团统称为必需基团(essential group)。
它们通过多肽链的盘曲折叠,组成一个在酶分子表面、具有三维空间结构的孔穴或裂隙,以容纳进入的底物与之结合并催化底物转变为产物,这个区域即称为酶的活性中心。
而酶活性中心以外的功能集团则在形成并维持酶的空间构象上也是必需的,故称为活性中心以外的必需基团。
对需要辅助因子的酶来说,辅助因子也是活性中心的组成部分。
酶催化反应的特异性实际上决定于酶活性中心的结合基团、催化基团及其空间结构。