第7章 氧化还原反应 电化学基础
- 格式:doc
- 大小:128.00 KB
- 文档页数:13






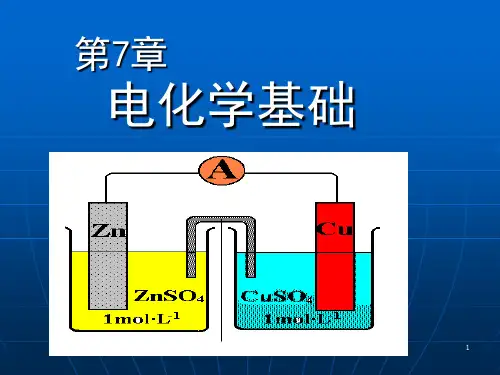
第七章:氧化还原反应 电化学基础主要内容:氧化还原反应的概念原电池 电极电势电极电势的应用重点难点:氧化还原方程式的配平。
原电池的电动势及电极电势。
Nernst 方程式及其有关的简单计算,根据Nernst 方程式分析浓度对电极电势的影响。
浓差电池原理。
元素电势图及其应用,判断氧化剂或还愿剂的相对强弱,判断氧化还原反应进行的方向,计算标准平衡常数。
教学目的:熟悉氧化还原反应的基本概念,能熟练地配平氧化还原反应方程式。
了解原电池及其电动势的概念。
掌握电极电势的概念及其影响因素,Nernst 方程式及其有关的简单计算,电极电势的应用。
掌握元素电势图及其应用。
§7.1 氧化还原反应的基本概念应中,得到电子的物质是氧化剂,失去电子的物质是还原剂。
还原剂失去电子被氧化,氧化剂得到电子被还原。
7.1.1 氧化值在氧化还原反应中,由于发生了电子转移,导致某些元素带电状态发生变化。
为了描述元素原子带电状态的不同,人们提出了氧化值的概念。
氧化值也叫做氧化数。
氧化:氧化数增加的过程;还原:氧化数降低的过程1970年,国际纯粹与应用化学联合会(IUPAC)对氧化值的定义是:氧化值是某元素一个原子的荷电数,这个荷电数是假设把每个化学键的电子指定给电负性更大的原子而求得的。
例如,在NaCl中,钠的氧化值为+1,氯的氧化值为-1。
在SO2中,硫的氧化值为+4,氧的氧化值为-2。
由此可见,氧化值是元素在化合状态时人为规定的形式电荷数。
确定氧化值的规则:★在单质中,元素的氧化值为零。
★在单原子离子中,元素的氧化值等于离子所带的电荷数。
★在大多数化合物中,氢的氧化值为+1,只有在活泼金属的氢化物(如NaH,CaH2)中,氢的氧化值为-1。
★通常,在化合物中氧的氧化值为-2;但在过氧化物(如H2O2,Na2O2,BaO2)中氧的氧化值为-1;而在OF2和O2F2中,氧的氧化值分别为+2和+1。
★在所有氟化物中,氟的氧化值为-1。


第7章氧化还原反应电化学基础第7章氧化还原反应电化学基础⼀、单选题1. 下列电对中,Eθ值最⼩的是:A: Ag+/Ag;B: AgCl/Ag;C: AgBr/Ag;D: AgI/Ag2. Eθ(Cu2+/Cu+)=0.158V,Eθ(Cu+/Cu)=0.522V,则反应2 Cu+Cu2+ + Cu的Kθ为:A: 6.93×10-7;B: 1.98×1012;C:1.4×106; D: 4.8×10-133. 已知Eθ(Cl2/ Cl-)= +1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是:A: Cl2+2e- = 2Cl- B: 2 Cl- - 2e- = Cl2C: 1/2 Cl2+e- = Cl- D: 都是4. 下列都是常见的氧化剂,其中氧化能⼒与溶液pH 值的⼤⼩⽆关的是:A: K2Cr2O7 B: PbO2C: O2 D: FeCl35. 下列电极反应中,有关离⼦浓度减⼩时,电极电势增⼤的是:A: Sn4+ + 2e- = Sn2+B: Cl2+2e- = 2Cl-C: Fe - 2e- = Fe2+ D: 2H+ + 2e- = H26. 为防⽌配制的SnCl2 溶液中Sn2+被完全氧化,最好的⽅法是:A: 加⼊Sn 粒B:. 加Fe 屑C: 通⼊H2D: 均可7. 反应Zn (s) + 2H+→ Zn 2++ H2 (g)的平衡常数是多少?A: 2×10-33 B: 1×10-13 C: 7×10-12 D: 5×10 26⼆、是⾮题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1. 在氧化还原反应中,如果两个电对的电极电势相差越⼤,反应就进⾏得越快2.由于Eθ(Cu+/Cu)= +0.52V , Eθ(I2/ I-)= +0.536V , 故Cu+ 和I2不能发⽣氧化还原反应。
第7章氧化还原反应电化学基础一、单选题1. 下列电对中,Eθ值最小的是:A: Ag+/Ag;B: AgCl/Ag;C: AgBr/Ag;D: AgI/Ag2. Eθ(Cu2+/Cu+)=0.158V,Eθ(Cu+/Cu)=0.522V,则反应2 Cu+Cu2+ + Cu的Kθ为:A: 6.93×10-7;B: 1.98×1012;C: 1.4×106; D: 4.8×10-133. 已知Eθ(Cl2/ Cl-)= +1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是:A: Cl2+2e- = 2Cl- B: 2 Cl- - 2e- = Cl2C: 1/2 Cl2+e- = Cl- D: 都是4. 下列都是常见的氧化剂,其中氧化能力与溶液pH 值的大小无关的是:A: K2Cr2O7 B: PbO2C: O2 D: FeCl35. 下列电极反应中,有关离子浓度减小时,电极电势增大的是:A: Sn4+ + 2e- = Sn2+B: Cl2+2e- = 2Cl-C: Fe - 2e- = Fe2+ D: 2H+ + 2e- = H26. 为防止配制的SnCl2 溶液中Sn2+被完全氧化,最好的方法是:A: 加入Sn 粒B:. 加Fe 屑C: 通入H2D: 均可7. 反应Zn (s) + 2H+→ Zn 2++ H2 (g)的平衡常数是多少?A: 2×10-33 B: 1×10-13 C: 7×10-12 D: 5×10 26二、是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快2.由于Eθ(Cu+/Cu)= +0.52V , Eθ(I2/ I-)= +0.536V , 故Cu+ 和I2不能发生氧化还原反应。
3.氢的电极电势是零。
4.计算在非标准状态下进行氧化还原反应的平衡常数,必须先算出非标准电动势。
5.FeCl3,KMnO4和H2O2是常见的氧化剂,当溶液中[H+]增大时,它们的氧化能力都增加。
三、填空题1. 根据Eθ(PbO2/PbSO4) >Eθ(MnO4-/Mn2+) >Eθ(Sn4+/Sn2+),可以判断在组成电对的六种物质中,氧化性最强的是,还原性最强的是。
2. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别、、。
3. 用电对MnO4-/Mn2+,Cl2/Cl-组成的原电池,其正极反应为,负极反应为,电池的电动势等于,电池符号为。
(Eθ(MnO4-/Mn2+)=1.51V;Eθ(Cl2/Cl-)=1.36V)4. 已知:Cr2O72- +1.36 Cr3+ -0.41 Cr2+ -0.86 Cr,则Eθ(Cr2O72- / Cr2+)= V,Cr2+能否发生歧化反应。
5. 用离子-电子法配平下列氧化还原反应式(1)Cr2O72-+ Fe2+→ Cr3+ + Fe2+ + H2O (酸性介质) ;(2)Mn2+ + BiO3-+ H+→ MnO4-+ Bi3+ + H2O ;(3)H2O2 + MnO4-+ H+→ O2 + Mn2+ + H2O 。
6. 反应2Fe3+(aq) + Cu(s) =2Fe 2++ Cu 2+(aq) 与Fe (s) + Cu 2+ (aq) =Fe2+(aq)+ Cu (s) 均正向自发进行,在上述所有氧化剂中最强的是,还原剂中最强的是。
7. 已知Eθ(Cu 2+/Cu)=0.337V, KθCu(OH) 2,sp,= 2.2×10-20, 则Eθ(Cu (OH)2/Cu)= V 。
8. 常用的两种甘汞电极分别是(1) , (2) , 其电极反应为,常温下两种甘汞电极的电极电势大小顺序为。
9. 根据标准电极电势表,将Hg2+、Cr2O72-、H2O2、Sn、Zn、Br-中的氧化剂、还原剂由强到弱分别排列成序:(1)氧化剂由强到弱;(2)还原剂由强到弱。
四、计算题1. 若下列反应在原电池中正向进行,试写出电池符号和电池电动势的表示式。
(1)Fe + Cu2+Fe2+ + Cu(2)Cu2+ + Ni Cu + Ni2+2. 求出下列原电池的电动势,写出电池反应式,并指出正负极。
(1)Pt | Fe2+(1mol·L-1) , Fe3+(0.0001mol·L-1) || I-(0.0001 mol·L-1),I2(s) | Pt(2)Pt | Fe3+(0.5 mol·L-1),Fe2+(0.05 mol·L-1) || Mn2+(0.01 mol·L-1),H+(0.1 mol·L-1),MnO2(固)| Pt3. 将铜片插入盛有0.5mol·L-1CuSO4溶液的烧杯中,银片插入盛有0.5mol·L-1 AgNO3溶液的烧杯中,组成一个原电池。
(1)写出原电池符号;(2)写出电极反应式和电池反应式;(3)求该电池的电动势。
4. 在pH = 3 和pH = 6时,KMnO4是否能氧化I-离子和Br-离子?5. 已知φ#(H3AsO4/H3AsO3)= 0.559V,φ#(I2/I-)=0.535V,试计算下列反应:H3AsO3 + I2 + H2O H3AsO4 + 2I-+ 2H+在298K时的平衡常数。
如果pH = 7,反应朝什么方向进行?6. 已知:Fe2+ + 2e-Fe φ#= -0.44VFe3+ + e-Fe 2+φ#= +0.771V该电池反应式为:3Fe 2+ = Fe + 2Fe3+计算该电池的E#值及电池反应的△r G m#,并判断反应能否正向自发进行?7. 根据下列反应组成电池,写出电池组成式,计算298K时的电动势,并判断反应自发进行的方向。
(1)2Ag(s) + Cu(NO3)2(0.01 mol·L-1) 2AgNO3(0.1 mol·L-1) + Cu(s)(2)2Cr3+(0.01 mol·L-1) + 2Br-(0.1 mol·L-1) 2Cr 2+ (1 mol·L-1) + Br2(l)8. 已知[Sn2+] = 0.1000 mol·L-1,[Pb 2+] =0.100 mol·L-1(1)判断下列反应进行的方向Sn + Pb 2+Sn 2+ + Pb(2)计算上述反应的平衡常数K。
9. 已知φ#(Br2/ Br-)=1.065V,φ#(IO3-,H+/I2)= 1.20V(1)写出标准状态下自发进行的电池反应式;(2)若[Br-] = 0.0001 mol·L-1,而其它条件不变,反应将如何进行?(3)若调节溶液pH = 4,其它条件不变,反应将如何进行?10 . 已知锰的元素电势图为:(1)求φ#(MnO4-/Mn 2+);(2)确定MnO2可否发生歧化反应?(3)指出哪些物质会发生歧化反应并写出反应方程式。
11. 在298K时,测定下列电池的E = +0.48V,试求溶液的pH值。
(-)Pt,H2(100kPa)|H+(x mol·L-1)||Cu2+(1 mol·L-1)|Cu(+)12. I2在水中溶解度很小,试从两个半反应计算在298K时,I2饱和溶液的浓度。
已知I2(s)+2e =2I-jΘ=0.535VI2(aq)+2e =2I-jΘ=0.621V无机化学习题库参考答案:一、单选题题号 1 2 3 4 5 6 7答案 D C D D B A D二、判断题题号 1 2 3 4 5答案×××××三、填空题1. PbO2,Sn2+2. 减小、不变、不变3. MnO4- + 8H++ 5e → Mn2+ + 4H2O,2Cl- -2e → Cl2 ,0.15V,(-)Pt,Cl2(pθ)|Cl-‖MnO4-,Mn2+,H+|Pt(+)4. 0.917 V,不能5. (1)Cr2O72-+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O(2)2Mn2+ + 5BiO3-+ 14H+ = 2MnO4-+ 5Bi3+ + 7H2O(3)5H2O2 + 2MnO4-+ 6H+ = 5O2 + 2Mn2+ + 8H2O6. Fe3+ , Fe7. -0. 248. 标准甘汞电极, 饱和甘汞电极, Hg2Cl2 + 2e - = 2Hg + 2Cl –, E θ(1) > Eθ(2)9. H2O2> Cr2O72-> Hg2+;Zn > Sn > H2O2> Br-1. 解:(1)(-)Fe | Fe2+ (1 mol·L-1) || Cu2+ (1mol·L-1) | Cu(+)E = j (+)-j (-) = j#(Cu2+/Cu) -j#(Fe2+/Fe) + lg(2)(-)Ni | Ni2+ (1mol·L-1) || Cu2+ (1mol·L-1) | Cu(+)E = j (+)-j (-) = j#(Cu2+/Cu) -j#(Ni2+/Ni) + lg2. 解:(1)Pt | Fe2+(1mol·L-1) , Fe3+(0.0001mol·L-1) || I-(0.0001 mol·L-1),I2(s) | Pt设右边为正极,左边为负极E = j (+) -j (-) =φ#(I2/I-) + 0.0592lg-j#(Fe3+/Fe2+)-0.0592 lg= 0.535-0.771+0.0592lg=0.238V > 0∴假设正确,电池反应式为I2 + 2Fe2+ = 2I-+ 2Fe3+(2)Pt | Fe3+(0.5 mol·L-1),Fe2+(0.05 mol·L-1) || Mn2+(0.01 mol·L-1),H+(0.1 mol·L-1),MnO2(固)| Pt 设右边为正极,左边为负极E = j (+) -j (-)=φ#(MnO2/Mn2+)+lg-j#(Fe3+/Fe2+)-0.0592 lg∴假设正确,电池反应式为MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O 3. 解:(1)(-)Cu | Cu 2+ (0.5 mol·L-1) || Ag + (0.5 mol·L-1) | Ag(+)(2)正极反应Ag+ + e-Ag负极反应Cu 2+ +2e-Cu①×2+②得电池反应式:2Ag+ + Cu = 2Ag + Cu 2+(3)E = j (Ag +/Ag) -j (Cu 2+ /Cu)= j#(Ag +/Ag)+0.0592lg[Ag +]-j#(Cu 2+ /Cu)-lg[Cu 2+]=0.7996+0.0592lg0.5-0.3402-lg0.5 =0.4505(V)4. 解:j#(I2/I-) = 0.535V,j#(Br2/Br-) = 1.08V在酸性条件下:MnO4-+ 8H++ 5e → Mn2+ + 4H2O[MnO4-]=[ Mn2+]=1 mol·L-1j (MnO4-/Mn2+)= j#(MnO4-/Mn2+)+lg[H+]8pH=3时j (MnO4-/Mn2+)=1.51+lg(10-3)8 =1.226(V)既大于j#(I2/I-),也大于j#(Br2/Br-),所以既能够氧化I-,也能够氧化Br-。